| |
| Med Sci (Paris). 2009 April; 25(4): 377–381. Published online 2009 April 15. doi: 10.1051/medsci/2009254377.Rôle de l’histamine et des récepteurs histaminiques dans la pathogenèse du paludisme Walid Beghdadi,1 Adeline Porcherie,1 Bradley S. Schneider,1 David Dubayle,3 Roger Peronet,1 Michel Huerre,2 Takeshi Watanabe,4 Hiroshi Ohtsu,5 Jacques Louis,1 and Salah Mécheri1* 1Unité de Biologie des Interactions hôte-parasite, Institut Pasteur, 28, rue du Docteur Roux, 75015 Paris, France 2Unité de Recherche et d’Expertise Histotechnologie et Pathologie, Institut Pasteur, 28, rue du Docteur Roux, 75015 Paris, France 3Centre National de la Recherche Scientifique, UMR 8119, Université Paris Descartes, 75270 Paris Cedex 06, France 4Center for Innovation in Immunoregulative Technology and Therapeutics, Kyoto University, Japan 5Tohoku University School of Engineering, Sendai 980-8579, Japan |
Malgré les nombreuses tentatives d’éradication, le paludisme reste la première endémie parasitaire et un problème majeur de santé publique dans le monde. Le contrôle du paludisme est difficile en raison de la résistance de Plasmodium falciparum à la plupart des anti-paludiques et de la résistance du moustique-vecteur aux insecticides. Pour ces raisons, le développement d’un vaccin et la mise au point d’approches thérapeutiques innovantes sont devenus nécessaires et urgents. La maladie présente une répartition géographique qui touche principalement les zones tropicales défavorisées d’Afrique, d’Asie et d’Amérique latine. La plupart des cas et des décès surviennent en Afrique subsaharienne avec 2 millions de décès par an dont 75 % d’enfants de moins de 5 ans [
1,
2]. La France est la nation européenne qui recense le plus de cas de paludisme d’importation (6 500-7 000/an) par rapport aux pays de démographies comparables tels que le Royaume-Uni, l’Allemagne, l’Italie, l’Espagne, les Pays-Bas et la Suisse. Les États-Unis déclarent quant à eux environ 1 500 cas annuels [
3]. Cependant, le nombre total de cas de paludisme importés en France a diminué ces deux dernières années (5 267 cas estimés en 2006 contre 4 404 en 2007) [
4,
5]. Le neuropaludisme est un syndrome clinique caractérisé par des manifestations neurologiques graves induites par Plasmodium falciparum chez l’homme et qui restent à l’heure actuelle très difficiles à expliquer. Il peut aussi être induit par une souche bien particulière de Plasmodium bergheï (Pb ANKA) chez les rongeurs. L’étude des mécanismes physiopathologiques étant complexe chez l’homme, les modèles expérimentaux de neuropaludisme chez la souris constituent actuellement l’un des moyens pour aborder et comprendre ces mécanismes. Les modèles in vivo permettent d’étudier les processus physiopathologiques, de mettre en évidence de nouveaux facteurs et de nouveaux mécanismes. Les souris des souches CBA ou C57BL/6 infectées avec Pb ANKA représentent les deux modèles expérimentaux murins de neuropaludisme les plus utilisés et sont considérées comme des souris susceptibles d’être infectées. En revanche, les souris BALB/c sont considérées comme des souris résistantes au développement du neuropaludisme. Trois hypothèses ont été émises afin d’expliquer la neuropathogenèse chez l’homme : la théorie de la perméabilité fondée sur une rupture de la barrière hémato-encéphalique (BHE), la théorie mécanique basée essentiellement sur la cytoadhérence des globules rouges infectés à l’endothélium vasculaire, et enfin la théorie immunologique qui implique les réponses immunitaires antipalustres dans la neuropathogenèse [
6]. Une façon d’aborder la complexité des processus physiopathologiques du neuropaludisme est de proposer un mécanisme unifiant ces hypothèses et qui repose sur l’idée qu’une réponse inflammatoire d’un type particulier serait responsable de la pathogenèse de cette maladie. L’hypothèse que nous proposons réside dans le fait qu’une réponse de type allergique, à l’issue de laquelle des médiateurs inflammatoires comme l’histamine peuvent être générés, fait suite à l’activation immunologique (IgE-dépendante) ou non (IgE-indépendante) des mastocytes et des basophiles par des constituants parasitaires. Les activités biologiques de l’histamine en font un candidat de choix étant donné ses propriétés hémodynamiques, pro-inflammatoires et immunorégulatrices. |
Propriétés biologiques de l’histamine et de ses récepteurs L’histamine est un médiateur chimique stocké dans les granules intracytoplasmiques des mastocytes et des basophiles puis libéré en réponse à différents stimulus et particulièrement lors de réactions d’hypersensibilité de type immédiat dépendantes de l’IgE. Cette molécule est synthétisée par décarboxylation de l’histidine sous l’action de l’histidine décarboxylase (HDC). L’histamine exerce ses effets via l’activation de quatre récepteurs histaminiques H1, H2, H3 et H4 qui sont exprimés à la surface de différentes cellules, telles que les cellules musculaires lisses, les monocytes, les cellules immunocompétentes ou inflammatoires, les cellules endothéliales ou épithéliales et les fibres nerveuses. Selon le type de récepteur histaminique prédominant et le système expérimental étudié, l’histamine peut avoir des effets pro- ou anti-inflammatoires. L’activation du récepteur H1 engendre la plupart des effets pro-inflammatoires de l’histamine mais aussi la polarisation des divers aspects de la réponse immune spécifique en modulant la balance Th1/Th2 [
7]. L’augmentation de l’expression de la P-sélectine (CD62P), qui favorise l’adhésion initiale des monocytes à l’endothélium vasculaire suite à un traitement avec l’histamine, représente un mécanisme important dans la migration des monocytes vers les barrières endothéliales [
8]. L’utilisation d’agonistes ou d’antagonistes des récepteurs H1 et H2 contribue de manière importante aux modifications des mécanismes de défense contre les agents pathogènes. La stimulation des cellules endothéliales vasculaires via les récepteurs H1 conduit à l’augmentation de la perméabilité vasculaire (en particulier dans les veinules postcapillaires) [
9] et à la libération de NO (nitric oxide) [
10]. Par ailleurs, le traitement avec un antagoniste du récepteur H2 semble inhiber l’expression de certaines molécules d’adhésion telles que ICAM-1 (intercellular adhesion molecule) et la sélectine P, et diminuer l’adhésion des polynucléaires neutrophiles [
11] suggérant un rôle pro-inflammatoire de l’histamine via le récepteur H2. Les effets immunosuppresseurs et antiinflammatoires de l’histamine, tels que l’inhibition du chimiotactisme des polynucléaires neutrophiles [
12], la sécrétion d’IL(interleukine)-12 par les monocytes [
13], ou encore l’induction de la production d’IL-10 [13], sont pour la plupart le résultat de la stimulation des récepteurs H2. Le récepteur H3 a été identifié en 1983 [
14], à la fois dans le système nerveux central et périphérique, comme un récepteur présynaptique qui inhibe la synthèse et la libération d’histamine ainsi que d’autres neurotransmetteurs comme la dopamine, la sérotonine ou l’acétylcholine [14]. Il est exprimé dans les fibres nerveuses et sa stimulation par l’histamine diminue la libération d’histamine mais aussi d’autres neuromédiateurs [
15]. L’activation du récepteur H4, exprimé par les cellules mononucléées et les lymphocytes T CD4+ et CD8+ [
16], inhibe la production de la chimiokine CCL2 engendrant ainsi une réduction du recrutement des monocytes [
17]. L’histamine fait l’objet de recherches intenses et son étude est capitale pour mieux comprendre et traiter l’allergie. Par ailleurs, certains travaux s’intéressent à d’autres fonctions. Il est bien connu que cette molécule est impliquée dans des maladies gastriques (l’ulcère gastro-duodénal par exemple) et qu’elle sert de neuromédiateur dans le cerveau. Cette dernière propriété a un intérêt particulier dans les travaux sur le neuropaludisme. |
Relations entre histamine et infection par Plasmodium
L’augmentation des niveaux d’histamine dans le plasma et dans les tissus, provenant de basophiles et mastocytes, a été associée à la sévérité de la maladie au cours des infections à Plasmodium falciparum chez l’homme et dans plusieurs modèles d’infections par Plasmodium chez les animaux [
18,
19]. En outre, des concentrations plasmatiques élevées d’anticorps IgE, qui se lient aux basophiles et aux mastocytes et qui peuvent déclencher la libération d’histamine, ont été associées à la gravité de l’infection par Plasmodium falciparum [
20]. Outre la libération d’histamine déclenchée par les IgE, le HRF (histamine-releasing factor), un peptide décrit chez l’homme et la souris, provoque la libération d’histamine, d’IL-4, et d’IL-13 par les basophiles [
21]. Ce peptide appartient à une famille de protéines appelées protéines de tumeurs contrôlées au niveau traductionnel (TCTP). Récemment, un TCTP présentant une forte homologie avec le HRF humain a été identifié chez Plasmodium falciparum [
22]. Le TCTP de Plasmodium falciparum a pu être mis en évidence dans le plasma de patients infectés et son activité histamino-libératrice sur les basophiles humains a pu être démontrée [
23], suggérant que le TCTP de Plasmodium falciparum peut affecter la réponse immunitaire de l’hôte en influant sur les réponses in vivo par sa capacité à libérer l’histamine [23]. Il convient de noter que depuis le début de l’infection par Plasmodium (piqûre infectante de moustique) et tout au long de l’infection (parasitémie), les vaisseaux sanguins et les cellules immunitaires sont constamment stimulés par l’histamine. L’interférence avec les effets biologiques de l’histamine pourrait représenter une nouvelle stratégie visant à manipuler la réponse immunitaire contre le parasite Plasmodium.
|
Rôle de la signalisation dépendante de l’histamine dans la pathogenèse du paludisme L’effet délétère de l’histamine produite au cours de l’infection par Plasmodium a été bien étudié dans un modèle d’infection par le parasite P bergheï NK65 (Pb NK65), souche létale n’entraînant pas de symptômes de neuropaludisme. Le rôle plus spécifique de l’histamine dans la neuropathogenèse a été élucidé par l’examen des mécanismes physiopathologiques impliqués dans l’infection en utilisant la souche létale Pb ANKA responsable du neuropaludisme dans des modèles de souris sauvages ou déficientes en histamine. |
Rôle de l’histamine et des récepteurs histaminiques dans l’infection par Pb NK65
Ces études ont été abordées par une approche pharmacologique qui consiste à utiliser des antagonistes des récepteurs histaminiques, complétée par une approche génétique utilisant des souris dont les gènes codant pour les récepteurs H1 (H1R−/−) et les récepteurs H2 (H2R−/−
) ont été invalidés. Afin de déterminer le rôle direct de l’histamine dans la pathogenèse du paludisme, des souris déficientes en histamine par délétion du gène codant pour l’histidine décarboxylase (HDC) ont été également examinées. Le traitement avec des antagonistes des récepteurs histaminiques H1 et H2 de souris infectées par la souche Pb NK65 assure une survie prolongée de ces souris contrairement aux souris sauvages non traitées. Les parasitémies des souris infectées traitées ou non par les antagonistes des récepteurs histaminiques ne sont pas différentes de manière significative [
24]. Afin de confirmer l’implication des récepteurs H1 et H2 dans la pathogenèse du paludisme, des souris déficientes en récepteurs H1 ou H2 de l’histamine ont été infectées puis leur survie a été comparée à celle des souris sauvages C57BL/6. Alors qu’aucune différence significative n’a été observée entre les différents groupes de souris en ce qui concerne la parasitémie, le suivi de la mortalité des souris révèle une résistance accrue des souris déficientes pour les récepteurs H1 et H2 (délai de mortalité retardé de 3 jours en moyenne) contrairement aux souris sauvages C57BL/6. Lorsque des souris déficientes en histamine (HDC−/−) ont été infectées dans les mêmes conditions, celles-ci se sont avérées beaucoup plus résistantes que les souris sauvages et les souris individuellement déficientes en récepteur H1 ou H2 [24]. |
Rôle de l’histamine dans la pathogenèse du neuropaludisme L’implication directe de l’histamine dans la neuropathogenèse au cours de l’infection a été démontrée par la survie des souris HDC−/−
et l’absence de signes cliniques de neuropaludisme après une infection par la souche Pb ANKA. Les souris meurent néanmoins très tardivement d’hyperparasitémie (30-35 jours après infection au lieu de 8 à 10 jours). Plusieurs théories ont été proposées pour expliquer la survenue du neuropaludisme chez l’homme : la théorie mécanique, la théorie immunologique et enfin la théorie de la perméabilité. Cette dernière est fondée sur la perméabilité de la barrière hématoencéphalique (BHE) qui constitue l’un des mécanismes hémodynamiques liés à l’histamine [
25] et associés au développement du neuropaludisme chez l’homme [
26]. La résistance des souris HDC−/−
vis-à-vis du parasite Pb ANKA est clairement associée à la préservation de la BHE contrairement aux souris C57BL/6 qui présentent une rupture de la BHE associée à une séquestration de globules rouges infectés dans le cerveau de celles-ci [24] (Figure 1). Une des caractéristiques du neuropaludisme chez la souris est la séquestration des lymphocytes T CD4+ et CD8+ dans les microvaisseaux sanguins du cerveau [
27,
28]. Cela a été confirmé par nos résultats qui montrent une augmentation significative des lymphocytes T CD4+ et CD8+ dans le cerveau des souris C57BL/6 infectées par Pb ANKA. Une telle séquestration n’a pas été observée dans le cerveau des souris HDC−/−
infectées [24]. Ces résultats suggèrent que l’histamine produite au cours de l’infection par Pb ANKA induit une réponse inflammatoire engendrant la séquestration des lymphocytes T dans les capillaires sanguins du cerveau, ce qui favorise le développement du neuropaludisme. Un schéma illustrant notre vision du phénomène est représenté sur la Figure 2. Dans ce contexte, il a été rapporté que l’histamine est essentielle au recrutement des lymphocytes T CD4+ et CD8+ spécifiques de l’antigène [
29]. De nombreuses études ont démontré le rôle essentiel de la molécule d’adhésion ICAM-1 dans la séquestration des globules rouges infectés, et par conséquent dans le développement de la pathogenèse du paludisme, notamment par l’utilisation de souris déficientes en ICAM-1, qui sont résistantes au neuropaludisme [
30,
33]. Nos résultats confortent l’implication de l’expression d’ICAM-1 dans la pathogenèse du neuropaludisme. La faible expression d’ICAM-1 à la surface des cellules endothéliales vasculaires du cerveau de souris HDC−/−
peut expliquer l’absence de séquestration des lymphocytes T dans le cerveau de ces souris. Il est intéressant de noter une réduction de la synthèse d’ICAM-1 chez les souris HDC−/−
qui présentent un profil de résistance similaire à celui des souris ICAM-1−/−
, suggérant ainsi un mécanisme de contrôle de l’histamine sur l’expression d’ICAM-1. En effet, il a été rapporté que l’histamine stimule l’expression d’ICAM-1 et VCAM-1 (vascular cell adhesion molecule) par les cellules endothéliales [
31] et que la cétirizine, un antagoniste du récepteur H1, a été identifiée comme une molécule possédant des propriétés anti-inflammatoires par sa capacité d’inhibition de recrutement et d’activation de leucocytes et par la réduction de l’expression d’ICAM-1 sur les kératinocytes [
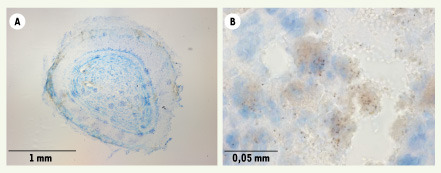
32].  | Figure 1.
Mise en évidence d’agrégats de globules rouges dans le cerveau de souris C57BL/6 6 jours après infection avec Plasmodium bergheï
ANKA. A. Dépôts de globules rouges infectés (x 40).B. Les mêmes érythrocytes infectés observés à un plus fort grossissement (x 600) où on peut distinguer des dépôts d’hémozoïne. Dans les mêmes expériences, les souris HDC-KO déficientes en histamine ne montrent aucun dépôt d’agrégats. |
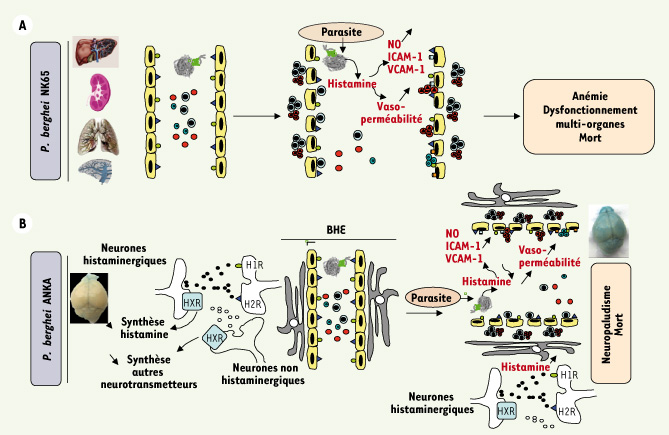
 | Figure 2.
Représentation schématique du rôle de l’histamine. L’histamine est impliquée dans l’augmentation de la perméabilité capillaire(A) et la rupture de la barrière hémato-encéphalique (BHE) (extravasation du bleu Evans)(B) à la suite de l’infection par Plasmodium bergheï souche NK65 (souche létale mais sans signes neurologiques)(A) ou par Pb ANKA (souche létale génératrice de neuropaludisme)(B). Dans les deux cas, l’histamine, libérée par des mécanismes qui restent à identifier, est à l’origine de l’augmentation de la synthèse de NO, d’une surexpression de molécules d’adhésion ICAM-1 et VCAM-1 ainsi qu’une augmentation de la perméabilité capillaire. Il en découle une séquestration au niveau des endothéliums capillaires périphériques (A) ou centraux (B) de globules rouges infectés ainsi que de lymphocytes T CD4 et CD8. Au niveau central, l’origine de l’histamine peut être périphérique ou centrale. Dans ce dernier cas, la synthèse et la libération de l’histamine, qui est également un neurotransmetteur, sont sous le contrôle de facteurs de nature encore indéfinie (HXR). |
|
En résumé, les résultats présentés dans cette revue sont en accord avec des données publiées précédemment démontrant l’association entre les niveaux d’histamine produite au cours de l’infection et la sévérité du paludisme chez l’homme et la souris. Ces résultats sont également en accord avec le concept selon lequel des mécanismes pathogéniques du paludisme grave serait lié à un défaut de contrôle d’une réponse inflammatoire excessive. Cela ouvre des perspectives nouvelles en termes d’approches thérapeutiques puisque, aussi bien dans les modèles murins de neuropaludisme que dans des essais cliniques chez l’homme, l’utilisation d’antihistaminiques H1 semble montrer une certaine efficacité. Les mécanismes mettant en jeu l’histamine révèlent également le rôle possible de la réponse allergique dans la pathogenèse du paludisme. De ce point de vue, la caractérisation des mécanismes de la réponse inflammatoire allergique au cours de l’infection palustre est une voie d’investigation prometteuse dans le futur. |
1. Hay SI, Guerra CA, Tatem AJ, et al. The global distribution and population at risk of malaria : past, present, and future. Lancet Infect Dis 2004; 4 : 327–36. 2. Wongsrichanalai C, Pickard AL, Wernsdorfer WH, Meshnick SR. Epidemiology of drug-resistant malaria. Lancet Infect Dis 2002; 2 : 209–18. 3. Legros F, Amaud A, El Mimouni B, Danis M, et CNREPIA. Paludisme d’importation en France métropolitaine : données épidémiologiques 2001-2004. Bull Epidemiol Hebd 2006; 32. 6. Van der Heyde HC, Nolan J, Combes V, et al. A unified hypothesis for the genesis of cerebral malaria : sequestration, inflammation and hemostasis leading to microcirculatory dysfunction. Trends Parasitol 2006; 22 : 503–8. 7. Simons FE. Advances in H1-antihistamines. N Engl J Med 2004; 351 : 2203–17. 8. Da Costa Martins P, Garcia-Vallejo JJ, van Thienen JV, et al. P-selectin glycoprotein ligand-1 is expressed on endothelial cells and mediates monocyte adhesion to activated endothelium. Arterioscler Thromb Vasc Biol 2007; 27 : 1023–9. 9. Svensjo E, Grega GJ. Evidence for endothelial cell-mediated regulation of macromolecular permeability by postcapillary venules. Fed Proc 1986; 45 : 89–95. 10. Van De Voorde J, Leusen I. Role of the endothelium in the vasodilator response of rat thoracic aorta to histamine. Eur J Pharmacol 1993; 87 : 113–20. 11. Takeuchi Y, Okayama N, Imaeda K, et al. Effects of histamine 2 receptor antagonists on endothelial-neutrophil adhesion and surface expression of endothelial adhesion molecules induced by high glucose levels. J Diabetes Complications 2007; 21 : 50–5. 12. Bury TB, Corhay JL, Radermecker MF. Histamine-induced inhibition of neutrophil chemotaxis and T-lymphocyte proliferation in man. Allergy 1992; 47 : 624–9. 13. Elenkov IJ, Webster E, Papanicolaou DA, et al. Histamine potently suppresses human IL-12 and stimulates IL-10 production via H2 receptors. J Immunol 1998; 161 : 2586–93. 14. Arrang JM, Garbarg M, Schwartz JC. Auto-inhibition of brain histamine release mediated by a novel class (H3) of histamine receptor. Nature 1983; 302 : 832–7. 15. Haas HL, Sergeeva OA, Selbach O. Histamine in the nervous system. Physiol Rev 2008; 88 : 1183–241. 16. Zhu Y, Michalovich D, Wu H, et al. Cloning, expression, and pharmacological characterization of a novel human histamine receptor. Mol Pharmacol 2001; 59 : 434–41. 17. Dijkstra D, Leurs R, Chazot P, et al. Histamine downregulates monocyte CCL2 production through the histamine H4 receptor. J Allergy Clin Immunol 2007; 120 : 300–7. 18. Bhattacharya U, Roy S, Kar PK, et al. Histamine and kinin system in experimental malaria. Indian J Med Res 1988; 88 : 558–63. 19. Srichaikul T, Archararit N, Siriasawakul T, Viriyapanich T. Histamine changes in Plasmodium falciparum malaria. Trans R Soc Trop Med Hyg 1976; 70 : 36–8. 20. Perlmann P, Perlmann H, ElGhazali G, Blomberg MT. IgE and tumor necrosis factor in malaria infection. Immunol Lett 1999; 65 : 29–33. 21. MacDonald SM, Rafnar T, Langdon J, Lichtenstein LM. Molecular identification of an IgE-dependent histamine-releasing factor. Science 1995; 269 : 688–90. 22. Bhisutthibhan J, Pan XQ, Hossler PA, et al. The Plasmodium falciparum translationally controlled tumor protein homolog and its reaction with the antimalarial drug artemisinin. J Biol Chem 1998; 273 : 16192–8. 23. MacDonald SM, Bhisutthibhan J, Shapiro TA, et al. Immune mimicry in malaria : Plasmodium falciparum secretes a functional histamine-releasing factor homolog in vitro and in vivo. Proc Natl Acad Sci USA 2001; 98 : 10829–32. 24. Beghdadi W, Porcherie A, Schneider BS, et al. Inhibition of histamine-mediated signaling confers significant protection against severe malaria in mouse models of disease. J Exp Med 2008; 205 : 395–408. 25. Abbott NJ. Inflammatory mediators and modulation of blood-brain barrier permeability. Cell Mol Neurobiol 2000; 20 : 131–47. 26. Medana IM, Turner GD. Human cerebral malaria and the blood-brain barrier. Int J Parasitol 2006; 36 : 555–68. 27. Belnoue E, Kayibanda M, Vigario AM, et al. On the pathogenic role of brain-sequestered alphabeta CD8+ T cells in experimental cerebral malaria. J Immunol 2002; 169 : 6369–75. 28. Yanez DM, Manning DD, Cooley AJ, et al. Participation of lymphocyte subpopulations in the pathogenesis of experimental murine cerebral malaria. J Immunol 1996; 157 : 1620–4. 29. Bryce PJ, Mathias CB, Harrison KL, et al. The H1 histamine receptor regulates allergic lung responses. J Clin Invest 2006; 116 : 1624–32. 30. Favre N, Da Laperousaz C, Ryffel B, et al. Role of ICAM-1 (CD54) in the development of murine cerebral malaria. Microbes Infect 1999; 1 : 961–8. 31. Kimura S, Wang KY, Tanimoto A, et al. Acute inflammatory reactions caused by histamine via monocytes/macrophages chronically participate in the initiation and progression of atherosclerosis. Pathol Int 2004; 54 : 465–74. 32. Shimizu T, Nishihira J, Watanabe H, et al. Cetirizine, an H1-receptor antagonist, suppresses the expression of macrophage migration inhibitory factor : its potential anti-inflammatory action. Clin Exp Allergy 2004; 34 : 103–9. 33. Baunaure F, Langsley G. Trafic protéique dans le globule rouge infecté par Plasmodium. Med Sci (Paris) 2005; 21 : 523–9. |