| |
| Med Sci (Paris). 2009 April; 25(4): 371–376. Published online 2009 April 15. doi: 10.1051/medsci/2009254371.Les récepteurs centraux de l’IGF-1 contrôlent la longévité chez la souris Martin Holzenberger* Centre de Recherche Inserm, Bâtiment Kourilsky, Hôpital Saint-Antoine, 184, rue du Faubourg Saint-Antoine, 75571 Paris Cedex 12, France |
Le vieillissement est un phénomène fascinant : simple dans son principe et sa raison d’être, mais d’une complexité inquiétante dans le détail. Le vieillissement survient de façon simultanée dans toutes les cellules somatiques des organismes multicellulaires. C’est un processus physiologique et universel du vivant, clairement distinct des maladies. Cependant, de très nombreuses maladies peuvent être associées au vieillissement, et l’interaction entre maladie et vieillissement augmente considérablement la complexité du problème. De plus, il existe des syndromes de vieillissement accéléré qui miment de façon partielle, ou segmentaire, le vieillissement naturel. Nos connaissances dans ce domaine proviennent d’années de recherche, d’abord descriptive puis expérimentale, sur les mécanismes moléculaires, en bonne partie grâce à l’étude de la sénescence cellulaire in vitro. Au début des années 1990, la découverte chez les invertébrés, notamment C. elegans et la drosophile, de gènes régulateurs de la durée de vie a permis des progrès importants [
1–
4]. La plupart de ces « gènes de longévité » identifiés chez les invertébrés interagissent et leurs produits forment une importante voie de signalisation. Ces dernières années, il a pu être montré que beaucoup de membres de cette voie de signalisation contribuent également au vieillissement. On a ensuite constaté, non sans surprise, que les voies de signalisation homologues chez les vertébrés étaient des cascades régulatrices de la croissance et du métabolisme, dépendant des récepteurs de l’insuline et des facteurs de croissance insulino-semblables, les IGF (insulin-like growth factor). Pour cette raison, la transposition des résultats du nématode aux mammifères a été assez rapide. Aujourd’hui, la longévité de nombreux modèles de souris génétiquement modifiées dans ces axes hormonaux a été examinée (Figure 1). Les augmentations de la durée de vie les plus conséquentes ont été obtenues en modifiant les gènes fonctionnant en amont du récepteur des IGF (IGF-1R), notamment ceux impliqués dans la régulation neuroendocrine de l’hormone somatotrope (STH, ou GH), qui active et contrôle l’IGF-I, principal ligand d’IGF-1R pendant la vie post-natale et chez l’adulte [
5–
8]. Les recherches sur le vieillissement chez les vertébrés se sont donc rapidement orientées vers les régulations endocrines et neuroendocrines de la fonction somatotrope.  | Figure 1.
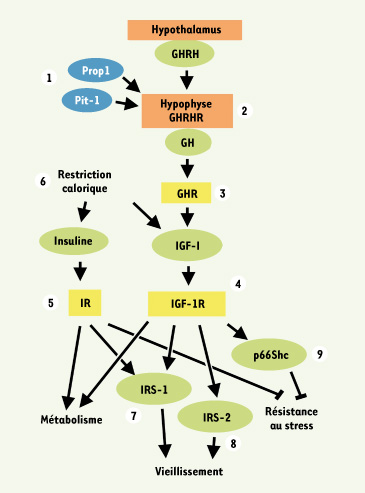
L’axe somatotrope régule la longévité chez les mammifères. Plusieurs modèles de souris génétiquement modifiées montrent une durée de vie significativement allongée. C’est le cas des mutations naturelles de Prop1, Pit-1, et de GHRHR (1,2) et du knockout (KO) du récepteur de la GH (3). Le KO hétérozygote d’IGF-1R et le KO du récepteur de l’insuline ciblé spécifiquement aux adipocytes, étendent la longévité (4,5). La restriction calorique diminue à la fois les deux ligands insuline et IGF-I (6), et l’inactivation constitutive d’IRS1 et celle spécifique du cerveau d’IRS2 prolongent la duré de vie (7,8), tout comme le KO classique de p66Shc, une isoforme de Shc qui régule les réponses au stress oxydant. |
|
L’axe hormonal somatotrope contrôle le vieillissement et la durée de vie chez les mammifères Le rôle de l’axe GH/IGF Il est d’abord surprenant que tout l’axe hormonal somatotrope, avant tout connu pour sa capacité à synchroniser croissance et différenciation cellulaire dans les différents tissus chez les vertébrés, soit aussi un levier efficace contrôlant la mortalité et la durée de vie. Ainsi, des mutations spontanées des facteurs de transcription Prop1 et Pit-1, marqueurs de la différenciation des lignages antéhypophysaires au cours du développement, provoquent un pan-hypopituitarisme avec une forte diminution en GH [
33]. Il en résulte une augmentation de la durée de vie d’environ une bonne moitié, mais aussi des effets sur le métabolisme, la croissance et la fertilité des mutants, par le biais des autres fonctions endocrines du complexe hypothalamo-hypohysaire [
9,
10]. Une mutation spontanée du gène codant pour le récepteur de la GH releasing hormone (GHRH) [
7, 8], mais aussi l’inactivation par ciblage de gène du récepteur de la GH (GHR) ont ensuite montré le rôle essentiel de la GH dans les effets constatés [ 5,
6] ; la confirmation du rôle de l’axe GH/IGF a été obtenue avec les inactivations géniques partielles ou complètes d’IGF-1R, d’IRS1 ( insulin receptor substrate 1) et de p66Shc [
11–
13], qui montrent que tous les composants de cet axe, chacun à sa façon, augmentent la durée de vie et la résistance au stress oxydant des individus. Deux aspects sont fondamentaux : d’une part, il y a d’abord la forte conservation de cette fonction des gènes IGF/insuline au cours de l’évolution. Ce mécanisme semble donc être précieux et utile. De plus, il est remarquable que le « coupable » soit une signalisation hormonale, faite pour réguler des processus adaptatifs et pour conférer de la plasticité. En même temps, parmi les modèles génétiques de longévité évoqués plus haut, aucun pour l’instant n’avait démontré que le défaut endocrine principal consistait en une diminution primaire de la GH et/ou de l’IGF-I. C’est-à-dire qu’il n’existe pas de modèle où la modification de longévité soit produite à partir d’une diminution hormonale donc purement endocrinienne. C’est désormais chose faite, avec un nouveau modèle de souris invalidée pour IGF-1R spécifiquement dans le cerveau, développé ces dernières années dans notre laboratoire. Cette souris développe peu après la naissance une insuffisance somatotrope marquée par une sécrétion de GH et d’IGF-I fortement bridée, qui permet aux individus porteurs de la mutation de vivre significativement plus longtemps [
14]. Ainsi, il est effectivement possible que le processus fondamental sous-jacent à ce phénotype de longévité soit un processus adaptatif qui permette aux individus d’ajuster croissance (et donc taille corporelle), métabolisme et durée de vie aux conditions environnementales, en particulier aux fluctuations naturelles des ressources. De tels mécanismes impliquent une certaine plasticité individuelle, en particulier au niveau de l’axe somatotrope et du SNC. Des travaux récents chez le ver et la mouche ont montré que des signaux insulino-semblables actifs dans le système nerveux changent la survie de l’individu d’une manière qui dépend du type cellulaire impliqué [
15–
20]. Afin de savoir si cela pouvait également être le cas chez les mammifères, nous avons génétiquement manipulé la signalisation IGF spécifiquement dans le cerveau, puis exploré croissance, métabolisme et durée de vie chez ces mutants [14,
31]. Modèles d’inactivation d’IGF-1R Deux modèles ont été créés. Le premier avait une inactivation complète d’IGF-1R dans le cerveau ( bIGF1R−/−
). Ce mutant souffrait cependant d’une importante microcéphalie, avec des conséquences profondes sur le développement et le comportement, tout en présentant une longévité normale. Pour le deuxième modèle, nous avons seulement inactivé IGF-1R sur l’un des deux allèles, produisant ainsi une insensibilité partielle à l’IGF-I spécifiquement dans le cerveau, tout en conservant la présence normale d’IGF-1R partout ailleurs dans l’organisme. La croissance de ce mutant bIGF1R+/−
a été clairement ralentie dès les premiers jours après la naissance et nous avons suspecté une dysrégulation de l’axe somatotrope. Cela a ensuite été confirmé, puisque le contenu en GH dans l’hypophyse chez ces souris était fortement diminué à partir de 10 jours de vie, et la forte augmentation physiologique d’IGF-I qui accompagne normalement la rapide croissance postnatale était absente chez les mutants. Puisque ce knockout d’IGF-1R ne concernait que le cerveau et pas l’antéhypophyse, dont les cellules dérivent de la paroi du pharynx, nous avons suspecté des altérations dans le système nerveux central (SNC), et plus précisément dans l’hypothalamus et les neurones GHRH et somatostatine (SRIH), dont les projections se terminent dans les couches extérieures de l’éminence médiane de l’hypothalamus. Effectivement, l’expression hypothalamique de GHRH et l’accumulation de GHRH dans l’éminence médiane étaient significativement diminuées, tandis que celle de SRIH était normale, soulignant ainsi la spécificité cellulaire du phénotype. L’expression de Pit-1, qui dépend de GHRH et contrôle la différenciation des cellules somatotropes de l’hypophyse, était diminuée de moitié chez les mutants bIGF1R+/−
. Cette insuffisance somatotrope persistait chez l’adulte avec un taux de GHRH chroniquement bas, et un taux de SRIH augmenté, résultant en une production hypophysaire de GH très inférieure à la normale chez les mutants. En toute logique, chacun des marqueurs d’activité de la GH que nous avons ensuite testé, comme les expressions hépatiques d’IGF-I et d’IGFBP-3 (IGF binding protein), étaient basses. Enfin, l’activation des récepteurs IGF dans les tissus périphériques se révélait très diminuée par rapport à la normale [ 14]. Le complexe hypothalamo-hypophysaire relaie plusieurs autres signaux neuroendocrines, et les cellules sécrétoires de GH sont intimement mélangées avec les autres types cellulaires neuroendocrines présents dans l’hypophyse. Néanmoins, nous n’avons pas détecté des altérations consistantes dans les signalisations gonadotropes, thyréotropes ou adrénocorticotropes, ou dans les caractéristiques phénotypiques qui auraient pu en résulter. Cela indique une forte spécificité dans la régulation de l’axe somatotrope par l’IGF-1R central. L’origine de cette régulation pourrait se situer directement dans les réseaux neuronaux responsables du contrôle de la sécrétion du GHRH et de son antagoniste fonctionnel SRIH. Cette insuffisance somatotrope explique d’abord le retard de croissance de ce mutant. Ensuite, nous avons mesuré l’impact de l’action de GH et d’IGF-I sur le métabolisme énergétique, en particulier sur l’homéostasie glucidique. Tandis que la plupart des organes étaient proportionnellement plus petits chez les mutants, le tissu adipeux, et en particulier son composant sous-cutané, était significativement plus important, indiquant une diminution de l’action lipolytique de la GH. Cela s’accompagnait d’un profil lipidique caractéristique d’un début d’obésité. Le manque de GH et d’IGF-I provoque également une certaine intolérance au glucose, probablement due à une combinaison entre résistance périphérique et déficit relatif en sécrétion d’insuline. Puisque ces effets sur le métabolisme énergétique prédisposent à des pathologies cardiovasculaires, ils n’étaient a priori pas promoteurs de longévité. |
Brider IGF-I et l’hormone de croissance dans le cerveau fait vivre plus longtemps Classiquement, l’inactivation des récepteurs GHRH et GH, et plus généralement les mutations qui inhibent le développement des cellules somatotropes, augmentent la longévité. Quand nous avons mesuré la durée de vie des souris bIGF1R+/−, nous avons constaté effectivement une durée de vie moyenne prolongée de 836 jours à 914 jours et un effet du même ordre chez les mâles et les femelles. En même temps, la mortalité était jusqu’à six fois inférieure chez les mutants, et ce de façon particulièrement visible avant 700 jours d’âge. Cependant, la durée de vie maximale entre le groupe contrôle et le mutant n’était pas différente. Ainsi, une des caractéristiques majeures de cette longévité est que la variabilité interindividuelle de la durée de vie apparaît moins forte chez les mutants. Ceux-ci meurent plus tard que les contrôles, et tous dans une fenêtre de temps plus étroite. Il semble donc que plafonner le développement du tonus somatotrope empêche sélectivement l’apparition de trajectoires de vie courtes [14]. Naturellement, nous nous sommes intéressés aux maladies manifestes chez ces souris au moment de leur décès. Bien que cette analyse post-mortem n’ait pas révélé de différence significative, elle a tout de même montré une tendance à moins de maladies dégénératives et de tumeurs, et chez les mutants une moindre fréquence d’individus présentant de multiples maladies au moment du décès que chez les contrôles. Nous avons montré qu’en diminuant la sensibilité du cerveau pour le facteur de croissance IGF-I, l’axe somatotrope entier est inhibé dans son développement, ce qui se traduit d’abord par un retard de croissance, mais entraine également des altérations du métabolisme et une extension de la durée de vie. Ce mécanisme possède visiblement une forte spécificité puisque d’autres axes neuroendocrines ne sont pas modifiés. Les souris mutantes bIGF1R+/−
conservent notamment leur fertilité et leurs réponses au stress, et leur comportement reste normal. Par ailleurs, une restriction alimentaire au cours de la toute première période de vie postnatale provoque également une forte diminution du développement somatotrope [
21]. Cependant, nous ne savons pas encore si cette restriction calorique passagère diminue aussi la mortalité des souris à la fin de leur vie, mais nous avons déjà pu montrer que la fréquence des maladies métaboliques et cardiovasculaires est modifiée en même temps que la nutrition périnatale [21]. Quel mécanisme commun pour ces phénotypes à répercussion neuroendocrine peut-il être envisagé ? Le développement et la maturation des circuits hypothalamo-hypophysaires somatotropes dépendent particulièrement d’un fort degré de signalisation IGF. Ces circuits se comportent donc comme une boucle d’autocontrôle positif, qui se renforce, par exemple, si les conditions nutritionnelles sont suffisantes (Figure 2). Il est à noter que l’IGF-I est parmi les meilleurs marqueurs nutritionnels, chez l’adulte mais aussi au cours du développement [
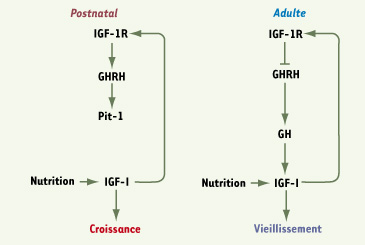
22]. Comment cette régulation se produit-elle au niveau des cellules à GHRH au cours du développement ? Il est possible que ce contrôle du développement et, in fine, la fonction des neurones à GHRH soient directement liés à la stimulation IGF qu’ils reçoivent. Celle-ci pourrait augmenter le nombre de neurones maintenus au cours du développement, ou modifier durablement l’expression des gènes impliqués dans la sécrétion de GHRH. Il est cependant possible également que des interactions plus ou moins distantes entre neurones GHRH et d’autres neurones affectés par le manque d’IGF-1R provoquent ce phénotype de façon plus indirecte.  | Figure 2.
Effet pléïotrope négatif de la signalisation IGF-1 sur l’axe somatotrope au cours du développement et du vieillissement. Le développement fonctionnel de l’axe somatotrope dans la période postnatale (schéma de gauche) dépend de la signalisation d’IGF-1R dans le cerveau. IGF-I, produit par exemple en réponse à l’alimentation, stimule IGF-1R dans le SNC et induit la production de GHRH et de Pit-1, ce qui augmente ensuite par rétrocontrôle positif l’expression de GH et d’IGF-I. Une réduction de signalisation IGF dans le cerveau, comme chez la souris bIGF1RKO+/−, retarde le développement somatotrope et mène à une déficience en GH. Chez l’adulte (à droite), le rétrocontrôle négatif classique d’IGF-I périphérique par l’IGF-1R hypothalamique prédomine, ce qui limite la sécrétion de GHRH et de GH. Le développement postnatal précoce est marqué par une importante plasticité neuroendocrine de la fonction somatotrope, contrôlée par des signaux IGF dans le SNC. Ce mécanisme prédispose les individus à des trajectoires endocrines spécifiques. |
Nos expériences montrent que le développement somatotrope possède une grande plasticité et qu’il est possible de l’inhiber efficacement [14, 31]. Cela réduit non seulement la mortalité et augmente la durée de vie moyenne, mais diminue aussi la variabilité interindividuelle de la durée de vie par rapport aux souris contrôles. On peut alors se demander pourquoi des individus de type sauvage, génétiquement identiques, montrent une aussi grande variabilité de longévité. Une possibilité, qui nous paraît assez probable aujourd’hui, est qu’il se crée tôt dans la vie, et grâce à des mécanismes neuroendocrines liés au développement, une importante diversité interindividuelle de l’activité somatotrope qui engendre des trajectoires neuroendocrines individualisées, ce qui a pour conséquence que les individus vieillissent à des rythmes « personnalisés ». Cependant, le rôle de la signalisation insuline/IGF dans le cerveau va certainement au-delà de la régulation de la trajectoire somatotrope, et un travail récent sur les conséquences d’un knockout d’IRS2 spécifiquement dans le cerveau sur la durée de vie montre que des aspects métaboliques importants s’y rajoutent [
23]. |
Facteurs de croissance insulino-semblables et longévité humaine Les recherches de ces dernières années ont montré que même dans des espèces très éloignées, la régulation de la longévité est contrôlée par des gènes homologues impliqués dans la signalisation d’axes endocrines. Les régulations sous-jacentes sont fortement conservées au cours de l’évolution, ce qui pourrait refléter le fait qu’elles touchent à des fonctions vitales, comme le métabolisme, la résistance au stress oxydant et la survie. Il est donc légitime de se demander si cela s’applique aussi, ou au moins en partie, à l’homme. Bien que la plupart des résultats dans ce domaine soient encore descriptifs, et parfois circonstanciels, des résultats récents permettent déjà la transposition prudente de ces hypothèses à d’autres mammifères et à l’homme. Il existe en premier une expérimentation grandeur nature : par croisement et sélection, l’homme a généré un très large spectre de variantes phénotypiques chez le chien, avec des différences en taille allant jusqu’à 50 fois entre le pékinois et certains dogues. Il a été récemment montré que ces différences en taille dépendent très largement d’un allèle IGF-I [
24,
32], et que la taille adulte des chiens est étroitement corrélée aux niveaux circulants de l’IGF-I. En même temps, les différences en durée de vie moyenne entre souches peuvent varier du simple au double, les plus petits chiens vivant en moyenne au-delà de 15 ans [
25]. Bien que chez l’homme quelques travaux montrent également une corrélation négative entre durée de vie et taille adulte, ces résultats sont relativisés par le fait qu’au cours de l’histoire, la taille moyenne des humains a généralement augmenté en parallèle avec l’espérance de vie, quoique pour des raisons différentes. Cependant, il y a également des études génétiques humaines qui montrent une association entre durée de vie et certains allèles codant pour des protéines jouant un rôle dans la signalisation IGF/insuline [
26,
27]. Une étude prospective faite sur des populations âgées aux Pays-Bas a récemment mis en évidence chez la femme une association entre allèles prédisposant à une signalisation IGF/insuline basse et la survie ultérieure. Pour mieux saisir une signalisation endocrine complexe, ces chercheurs ont utilisé un ensemble de marqueurs génétiques pour établir une valeur composite, reflétant au mieux l’activité somatotrope. Les allèles qui contribuaient le plus étaient ceux de la GH, de l’IGF-I et de l’IRS-1. Celui de la GH expliquait à lui seul 2 cm de taille adulte en moins et une augmentation significative de la survie chez les femmes âgées. Enfin, au début de l’année 2008, des mutations non-synonymes d’IGF-1R humain ont été trouvées surreprésentées dans des cohortes de centenaires aux États-Unis [
28]. Le groupe contrôle pose souvent un problème particulier dans les études de centenaires chez l’homme, mais ces chercheurs ont pris la précaution d’utiliser les enfants des centenaires comme cohorte avec patrimoine génétique proche des parents centenaires, et leurs épouses et époux comme groupe témoin. Un criblage de toute la région codante d’IGF-I et d’IGF-1R n’a révélé aucun polymorphisme utile pour le ligand IGF-I, mais un grand nombre de polymorphismes et de mutations synonymes pour le récepteur des IGF. Plus important, deux mutations avec échange d’acide aminé, chacune dans une région connue pour être déterminante pour la fonction du récepteur ont été identifiées, alors que les contrôles n’en possédaient pas. Suh et al. [28] ont ensuite étendu la recherche de ces deux mutations à l’ensemble de leur cohorte de centenaires, où ils ont trouvé sept autres porteurs. Cependant, ils ont en même temps identifié un porteur parmi les contrôles. Cela suggère qu’un récepteur IGF muté aide à survivre jusqu’à cent ans, mais ce type de mutation n’est pas une condition suffisante. Dans leurs cohortes de centenaires et descendants, les auteurs ont retrouvé les traits physiologiques typiques d’une inactivation partielle d’IGF-1R, comme une taille inférieure à la normale et une augmentation du ligand IGF-I dans le sang, conséquence d’un rétrocontrôle endocrine négatif chez l’adulte [11]. Finalement, des expériences avec des lymphoblastes « centenaires » immortalisés et porteurs de mutations montraient des anomalies de signalisation, bien que cette partie du travail n’apparaisse pas aussi convaincante que la génétique humaine. Dans ce contexte, il est intéressant que, chez les patients acromégales, des niveaux élevés en GH après traitement chirurgical soient prédictifs d’une mort précoce [
29], et que des niveaux élevés en IGF-I chez les personnes âgées soient corrélés avec une mortalité augmentée [
30]. De plus, la durée de vie d’individus acromégales souffrant de gigantisme pituitaire (aujourd’hui traités suffisamment tôt dans leur vie) était très diminuée par rapport à l’espérance de vie des populations normales. Ainsi, il paraît très souhaitable aujourd’hui d’augmenter nos efforts pour pouvoir étudier les conséquences du tonus somatotrope sur la santé et la longévité humaine dans un plus grand nombre de circonstances. |
Je remercie les membres du laboratoire pour leurs contributions et remarques critiques sur le manuscrit et N.R. Holzenberger pour la révision du texte. Le laboratoire est subventionné par l’INSERM, la CE (NoE LifeSpan, 036894), l’ANR (NT05-3 42491) et l’Université Pierre et Marie Curie, Paris 6.
|
1. Kenyon C, Chang J, Gensch E, et al. A C. elegans mutant that lives twice as long as wild-type. Nature 1993; 366 : 461–4. 2. Kenyon C. A conserved regulatory system for aging. Cell 2001; 105 : 165–8. 3. Tatar M, Kopelman A, Epstein D, et al. A mutant Drosophila insulin receptor homolog that extends life-span and impairs neuroendocrine function. Science 2001; 292 : 107–10. 4. Giannakou ME, Partridge L. Role of insulin-like signalling in Drosophila lifespan. Trends Biochem Sci 2007; 32 : 180–8. 5. Coschigano KT, Clemmons D, Bellushi LL, Kopchick JJ. Assessment of growth parameters and life span of GHR/BP gene-disrupted mice. Endocrinology 2000; 141 : 2608–13. 6. Coschigano KT, Holland AN, Riders ME, et al. Deletion, but not antagonism, of the mouse growth hormone receptor results in severely decreased body weights, insulin, and insulin-like growth factor I levels and increased life span. Endocrinology 2003; 144 : 3799–810. 7. Godfrey P, Rahal JO, Beamer WG, et al. GHRH receptor of little mice contains a missense mutation in the extracellular domain that disrupts receptor function. Nat Genet 1993; 4 : 227–32. 8. Flurkey K, Papaconstantinou J, Miller RA, Harrison DE. Lifespan extension and delayed immune and collagen aging in mutant mice with defects in growth hormone production. Proc Natl Acad Sci USA 2001; 98 : 6736–41. 9. Flurkey K, Papaconstantinou J, Miller RA, Harrison DE. Lifespan extension and delayed immune and collagen aging in mutant mice with defects in growth hormone production. Proc Natl Acad Sci USA 2001; 98 : 6736–41. 10. Brown-Borg HM, Borg KE, Meliska CJ, Bartke A. Dwarf mice and the ageing process. Nature 1996; 384 : 33. 11. Holzenberger M, Dupont J, Ducos B, et al. IGF-1 receptor regulates life span and resistance to oxidative stress in mice. Nature 2003; 421 : 182–7. 12. Selman C, Lingard S, Choudhury AI, et al. Evidence for lifespan extension and delayed agerelated biomarkers in insulin receptor substrate 1 null mice. FASEB J 2008; 22 : 807–18. 13. Migliaccio E, Giorgio M, Mele S, et al. The p66shc adaptor protein controls oxidative stress response and life span in mammals. Nature 1999; 402 : 309–13. 14. Kappeler L, De Magalhaes Filho C, Dupont J, et al. Brain insulin-like growth factor receptors determine mammalian growth and lifespan. PLoS Biol 2008; 6 : 2144–53. 15. Apfeld J, Kenyon C. Cell nonautonomy of C. elegans daf-2 function in the regulation of diapause and lifespan. Cell 1998; 95 : 199–210. 16. Wolkow CA, Kimura KD, Lee MS, Ruvkun G. Regulation of C. elegans life-span by insulin like signaling in the nervous system. Science 2000; 290 : 147–50. 17. Apfeld J, Kenyon C. Regulation of lifespan by sensory perception in Caenorhabditis elegans. Nature 1999; 402 : 804–8. 18. Alcedo J, Kenyon C. Regulation of C. elegans longevity by specific gustatory and olfactory neurons. Neuron 2004; 41 : 45–55. 19. Hwangbo DS, Gershman B, Tu MP, et al. Drosophila dFOXO controls lifespan and regulates insulin signalling in brain and fat body. Nature 2004; 429 : 562–6. 20. Giannakou ME, Goss M, Junger MA, et al. Long-lived Drosophila with overexpressed dFOXO in adult fat body. Science 2004; 305 : 361. 21. Kappeler L, De Magalhaes Filho C, Leneuve P, et al. Early postnatal nutrition determines somatotropic function in mice. Endocrinology 2009; 150 : 314–23. 22. Thissen JP, Underwood LE, Ketelslegers JM. Regulation of insulin-like growth factor-I in starvation and injury. Nutr Rev 1999; 57 : 167–76. 23. Taguchi A, Wartschow LM, White MF. Brain IRS2 signaling coordinates life span and nutrient homeostasis. Science 2007; 317 : 369–72. 24. Sutter NB, Bustamante CD, Chase K, et al. A single IGF1 allele is a major determinant of small size in dogs. Science 2007; 316 : 112–5. 25. Patronek GJ, Waters DJ, Glickman LT. Comparative longevity of pet dogs and humans: implications for gerontology research. J Gerontol 1997; 52 : B171–8. 26. Bonafé M, Barbieri M, Marchegiani F, et al. Polymorphic variants of insulin-like growth factor I (IGF-I) receptor and phosphoinositide 3-kinase genes affect IGF-I plasma levels and human longevity: cues for an evolutionarily conserved mechanism of life span control. J Clin Endocrinol Metab 2003; 88 : 3299–104. 27. Van Heemst D, Beekman M, Mooijaart SP, et al. Reduced insulin/IGF-1 signalling and human longevity. Aging Cell 2005; 4 : 79–85. 28. Suh Y, Atzmon G, Cho MO, et al. Functionally significant insulin-like growth factor I receptor mutations in centenarians. Proc Natl Acad Sci
USA 2008; 105 : 3438–42. 29. Kauppinen-Makelin R, Sane T, Reunanen A, et al. A nationwide survey of mortality in acromegaly. J Clin Endocrinol Metab 2005; 90 : 4081–6. 30. Raynaud-Simon A, Lafont S, Berr C, et al. Plasma insulin-like growth factor I levels in the elderly: relation to plasma dehydroepiandrosterone sulfate levels, nutritional status, health and mortality. Gerontology 2001; 47 : 198–206. 31. Kappeler L, De Magalhaes Filho C, Le Bouc Y, Holzenberger M. Durée de vie, génétique et axe somatotrope. Med Sci (Paris) 2006; 22 : 259–65. 32. Gilgenkrantz S. Un allèle IGF1 pour les petits chiens. Med Sci (Paris) 2007; 23 : 556–8. 33. Pulichino AM, Vallette-Kasic S, Couture C, Brue T, Drouin J. Mutations du facteur de transcription Tpit et différenciation hypophysaire. Med Sci (Paris) 2004; 20 : 1009–13. |