| |
| Med Sci (Paris). 2009 April; 25(4): 346–348. Published online 2009 April 15. doi: 10.1051/medsci/2009254346.L’offre et la demande : l’influence du métabolisme énergétique sur l’angiogenèse Przemyslaw Sapieha,* Karine Zaniolo, David Hamel, Jean-Sébastien Joyal, and Sylvain Chemtob Centre de recherche, CHUM mère-enfant Sainte-Justine, Université de Montréal, 3175, Côte Ste-Catherine, Montréal (Québec), H3T 1C5 Canada MeSH keywords: Animaux, Anoxie, Rétinopathie diabétique, Métabolisme énergétique, Humains, Nouveau-né, Injections, Ischémie, Souris, Néovascularisation pathologique, Néovascularisation physiologique, Petit ARN d'interférence, Récepteurs couplés aux protéines G, Néovascularisation rétinienne, Vaisseaux rétiniens, Rétinopathie du prématuré, Acide succinique, Corps vitré |
La croissance vasculaire est un processus biologique essentiel non seulement au cours du développement tissulaire, mais également lors de la restauration de l’intégrité des tissus à la suite de dommages ischémiques. Dans de nombreuses pathologies, allant de la croissance tumorale aux rétinopathies ischémiques prolifératives, un dérèglement des processus angiogéniques entraîne la formation d’un réseau vasculaire excessif et désordonné [
1]. Contrecarrer cette croissance vasculaire anormale constituerait un puissant moyen de prévenir et de traiter ces maladies. |
Les rétinopathies ischémiques prolifératives et l’angiogenèse Plusieurs maladies oculaires ont une origine vasoproliférative. La rétinopathie proliférative diabétique (RD) et la rétinopathie du prématuré (RP) en sont malheureusement des exemples fréquents et représentent les deux principales causes de cécité chez les personnes de moins de cinquante ans dans les pays industrialisés [
2,
3]. Ces pathologies sont caractérisées par une croissance vasculaire anormale et excessive pouvant aller, selon la sévérité, jusqu’au détachement rétinien. Dans les cas de rétinopathie proliférative diabétique et de rétinopathie du prématuré, la croissance vasculaire anormale et excessive est précédée par une phase ischémique caractérisée par la vaso-oblitération des microvaisseaux rétiniens. Dans la rétinopathie du prématuré, cette dégénérescence vasculaire est causée par un excès de radicaux libres et un niveau insuffisant de facteurs de croissance. Quant à la rétinopathie proliférative diabétique, c’est l’hyperglycémie qui engendre la dégénérescence vasculaire. Dans les deux cas, cette phase initiale est associée à une perte de la microvasculature rétinienne et à un état d’hypoxie. Dès lors, la rétine déclenche une série de mécanismes compensatoires, tels que la surproduction de facteurs de croissance pro-angiogéniques dont l’expression est régulée par le niveau d’oxygène. Ainsi, cette production anormale de facteurs angiogéniques provoque une seconde phase, vasoproliférative, de la maladie appelée néovascularisation [
4]. Cette néovascularisation anarchique exacerbe la pathologie. Les approches thérapeutiques courantes telles que la photocoagulation au laser [
5], diminuent cette croissance vasculaire excessive. Cependant elles sont invasives et relativement tardives, ne limitant que partiellement les dommages fonctionnels. La conception de nouvelles stratégies thérapeutiques ciblant la cause de ces pathologies, plutôt que leurs conséquences, pourrait diminuer leurs effets dévastateurs sur l’acuité visuelle des patients. |
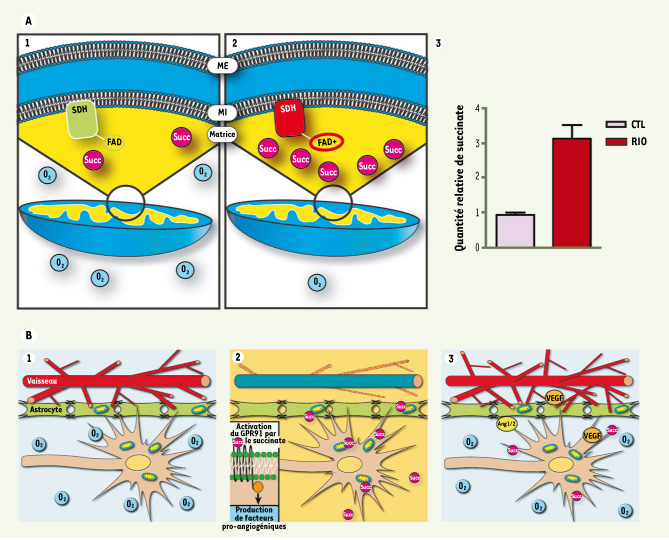
Jusqu’à maintenant, les recherches consacrées à l’exploration des mécanismes moléculaires à l’œuvre dans les rétinopathies prolifératives ont peu considéré l’effet de l’hypoxie sur le métabolisme énergétique. Normalement, le réseau vasculaire assure un apport d’oxygène et de nutriments adéquat à la rétine. Lors d’une dégénérescence vasculaire, il y a un arrêt partiel du métabolisme énergétique oxydatif assuré par le cycle de Krebs dans les zones rétiniennes hypoxémiques. En l’absence d’oxygène, l’enzyme succinate déhydrogénase est inhibé par la flavine non-oxydée, les nucléotides nicotiques et la présence de radicaux libres (Figure 1a). L’interruption du cycle de Krebs favorise l’accumulation de succinate, un intermédiaire bien connu du métabolisme énergétique cellulaire.  | Figure 1.
Schématisation de la réponse cellulaire à l’hypoxie et mécanisme proposé de revascularisation. A. En situation normoxique (1), la succinate déshydrogénase (SDH) convertit le succinate en fumarate et alimente la chaîne de transport d’électrons. En période hypoxique (2), la chaîne de transport est saturée et la SDH s’avère incapable de convertir le succinate. Dans une rétine hypoxique, comme cela est observé dans le modèle de rétinopathie induite par l’oxygène (RIO), la quantité de succinate est environ 3 fois supérieure à celle qui est observée dans les tissus contrôles (CTL) (3). B. Le système vasculaire assure un équilibre entre l’oxygène consommé et celui qui est fourni (1). Dans le contexte d’une dégénérescence vasculaire, l’apport en oxygène devient insuffisant et le succinate s’accumule et active le GPR91 (2). L’activation de ce récepteur entraîne la production, par les neurones, de facteurs pro-angiogéniques (3). VEGF : vascular endothelial growth factor ; Ang 1/2 : angiopoïétines 1/2. |
|
GPR91 : récepteur de succinate et maître régulateur de l’angiogenèse Connu de longue date, le succinate n’était perçu jusqu’à récemment qu’au titre d’intermédiaire du cycle de Krebs sans fonction de signalisation propre. Grâce à la découverte de son récepteur, le GPR91 [
6], le ligand succinate semble bien être la solution au chaînon manquant unissant le compromis énergétique induit par l’ischémie rétinienne et le processus de réparation vasculaire. Le GPR91 est un récepteur couplé aux protéines G ; il est fortement exprimé dans l’œil par les neurones ganglionnaires de la rétine interne. Ces cellules neuronales sont le siège de la plus haute activité métabolique de la rétine interne [
7]. Il serait donc concevable que lors d’une ischémie rétinienne, ces cellules ganglionnaires via la production de succinate et l’activation de GPR91, stimulent la croissance vasculaire pour rétablir l’équilibre énergétique (Figure 1b) [
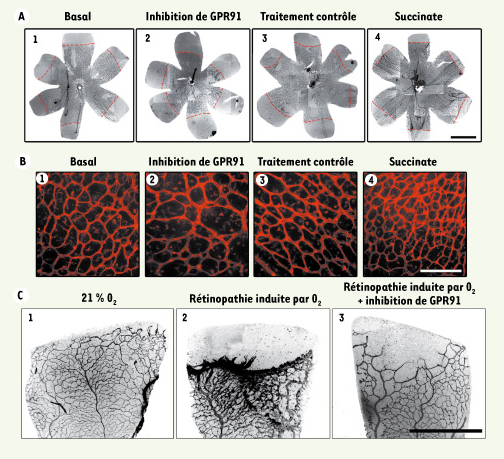
8]. En accord avec cette hypothèse, nous avons observé qu’une injection intraoculaire de succinate augmente considérablement la croissance vasculaire rétinienne (Figure 2a) [8]. Nos résultats suggèrent que la croissance anormale et démesurée des vaisseaux sanguins pourrait être attribuable aux niveaux élevés de succinate lors des ischémies prolifératives. Dans les mêmes conditions expérimentales, le succinate augmente considérablement la production de plusieurs facteurs pro-angiogéniques, tels que le facteur de croissance endothélial vasculaire (VEGF) et les angiopoïétines 1 et 2 ; de plus, cet effet est indépendant de l’activation du facteur induit par l’hypoxie (hypoxia-inducible factor [HIF]). Inversement, l’atténuation de l’expression du GPR91 par l’utilisation d’ARN interférents diminue considérablement la revascularisation excessive et anarchique observée dans les rétinopathies prolifératives (Figure 2c). Les effets anti-angiogéniques provoqués par l’inhibition de l’expression du GPR91 ont également été démontrés lors du développement vasculaire rétinien. L’ensemble de ces résultats démontre que le GPR91 joue un rôle primordial dans la croissance vasculaire rétinienne.  | Figure 2.
Le GPR91 et le succinate influencent le développement vasculaire rétinien. A. Montages plats de rétines dont les vaisseaux sanguins ont été marqués. Les rétines ont été prélevées chez des ratons de 4 jours. On a préalablement injecté dans le corps vitré de l’œil de ces ratons au premier jour de leur vie la solution véhicule seule (1) et additionnée de siARN dirigé contre GPR91 (2), GADPH (contrôle négatif) (3) et de succinate (4). La délimitation rouge représente l’aire de vascularisation (barre d’échelle 1 mm). B. Images agrandies (barre d’échelle 200 µm) représentant la densité vasculaire rétinienne dans les conditions décrites en A. C. L’inhibition du GPR91 atténue la néovascularisation rétinienne qui se produit suite à la phase ischémique de la rétinopathie induite par l’oxygène. Montages plats de rétines de ratons (barre d’échelle 1mm) après une injection intravitréale d’un lentivirus exprimant un shARN dirigé contre GPR91. |
|
Les neurones rétiniens jouent un rôle important lors de la réponse angiogénique dirigée par le succinate. En effet, l’ablation des neurones ganglionnaires rétiniens chez le rat (après section du nerf optique) élimine l’expression du GPR91, ce qui a pour conséquence d’abolir l’effet pro-angiogénique du succinate. La contribution capitale des neurones à l’angiogenèse est confirmée par l’absence de plexus vasculaire rétinien chez des souris génétiquement modifiées dépourvues de neurones ganglionnaires. L’expression de GPR91 dans les neurones de la rétine et son rôle dans l’angiogenèse suggèrent sa contribution à l’association neuro-vasculaire essentielle au développement fonctionnel de l’œil. En somme, notre étude propose de nouveaux concepts qui améliorent notre compréhension des pathologies vasoprolifératives rétiniennes [8]. D’une part, le succinate, intermédiaire du cycle de Krebs connu depuis plus de 60 ans, est pour la première fois identifié comme un ligand pro-angiogénique essentiel au développement vasculaire rétinien via le récepteur GPR91. D’autre part, nous avons mis en évidence la contribution majeure des neurones ganglionnaires de la rétine durant le processus de revascularisation, puisqu’ils agissent comme senseurs des niveaux d’oxygène, remodelant ainsi l’environnement vasculaire à la suite d’une ischémie rétinienne. L’ensemble de ces découvertes suggère que la néovascularisation pathologique qui caractérise la rétinopathie proliférative diabétique et la rétinopathie du prématuré est engendrée partiellement par des processus neuronal et vasculaire qui dépendent du GPR91 et de l’accumulation du succinate causée par l’hypoxie. La découverte de ce nouveau rôle du succinate et de son récepteur GPR91 font de ce récepteur une cible thérapeutique évidente. L’inhibition du GPR91 permettrait de contrer la vascularisation excessive observée dans les rétinopathies ischémiques et, à l’inverse, la stimulation du GPR91 permettrait la revascularisation des zones dévascularisées dans la rétine et possiblement dans le cerveau après un accident vasculaire cérébral. |
1. Carmeliet P. Angiogenesis in health and disease. Nat Med 2003; 9 : 653–60. 2. Gilbert C, Rahi J, Eckstein, et al. Retinopathy of prematurity in middle-income countries. Lancet 1997; 350 : 12–4. 3. Gao BB, Clermont A, Rook S, et al. Extracellular carbonic anhydrase mediates hemorrhagic retinal and cerebral vascular permeability through prekallikrein activation. Nat Med 2007; 13 : 181–8. 4. Smith LE. Pathogenesis of retinopathy of prematurity. Semin Neonatol 2003; 8 : 469–73. 5. Chen J, Smith LE. Retinopathy of prematurity. Angiogenesis 2007; 10 : 133–40. 6. He W, Miao FJ, Lin DC, et al. Citric acid cycle intermediates as ligands for orphan G proteincoupled receptors. Nature 2004; 429 : 188–93. 7. Braun RD, Linsenmeier RA, Goldstick TK. Oxygen consumption in the inner and outer retina of the cat. Invest Ophthalmol Vis Sci 1995; 36 : 542–54. 8. Sapieha P, Sirinyan M, Hamel D, et al. The succinate receptor GPR91 in neurons has a major role in retinal angiogenesis. Nat Med 2008; 14 : 1 067–76. |