La principale difficulté pour modéliser le système nerveux est précisément son aspect tridimensionnel, qui exige de cultiver les cellules dans une architecture 3D.
Notre équipe a acquis une longue expérience dans la reconstruction d’organes en trois dimensions. L’architecture que nous utilisons souvent pour amener les cellules à former un tissu est une éponge de collagène. Il s’agit d’un biomatériau formé principalement de collagène bovin de type I et III, stabilisé par des liaisons ioniques assurées par du chitosane (un polysaccharide d’origine marine, biodégradable, biocompatible et bioactif) dont les dimensions peuvent être ajustées à volonté, mais que l’on utilise en général coulé directement dans des plaques de culture 12 puits, avec un diamètre de 22 mm et une épaisseur de 1,5 mm. Nous avons montré que cette éponge conduisait à la formation d’un tissu conjonctif de grande qualité lorsqu’on y cultivait des fibroblastes [
13]. En revanche, son utilisation directement avec des cellules nerveuses (neurones matures et cellules gliales) s’est révélée infructueuse, car celles-ci ne sont ni des cellules ayant la capacité de migrer, dans le cas des neurones, ni susceptibles de sécréter une matrice extracellulaire en abondance, deux propriétés essentielles au remodelage du biomatériau.
Nous avons donc choisi une autre stratégie, celle qui consiste à reconstruire d’abord un tissu conjonctif avec une éponge ensemencée avec des fibroblastes et à ensemencer ensuite à sa surface les cellules nerveuses pour y favoriser la migration axonale des neurones. L’éponge représente alors le tissu conjonctif à travers lequel les nerfs migrent jusqu’à atteindre leur cible, un muscle, par exemple. La couche de cellules nerveuses à la surface de l’éponge mime alors la moelle épinière. Ce principe a été appliqué à l’étude de la migration axonale des neurones sensoriels et des neurones moteurs [
14,
15].
Les fibroblastes servant à la reconstruction du tissu conjonctif sont isolés à partir de la peau. Les cellules de Schwann, elles, sont reconstituées à partir de nerfs sciatiques de souris adultes. Les neurones moteurs, neurones sensoriels, microglies et astrocytes proviennent de moelles épinières d’embryons de souris ou de ganglions nerveux rachidiens [
16].
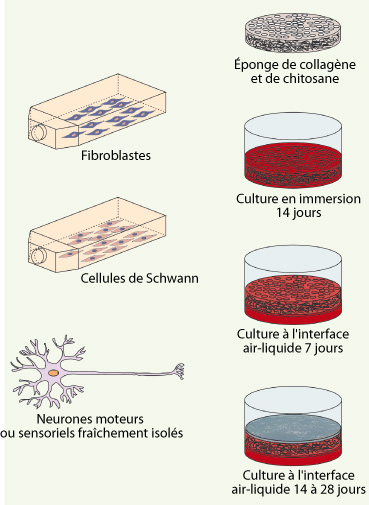
L’éponge est ensemencée avec les fibroblastes (avec ou sans cellules de Schwann) pour reconstruire un tissu conjonctif, puis cultivée deux semaines. Pendant la troisième semaine, l’éponge est placée en culture à l’interface air-liquide pour établir un gradient de facteurs de croissance stimulant la migration axonale à travers le tissu. Les neurones sont ensuite ensemencés à la surface de l’éponge pour deux à trois semaines de culture supplémentaire (Figure 1, Figure 2A).
 | Figure 1.
Le modèle d’étude de la migration axonale des neurones moteurs en trois dimensions. Le modèle est d’abord composé d’une éponge de collagène-chitosane, qui sert d’architecture 3D, dans laquelle sont ensemencés des fibroblastes avec ou sans cellules de Schwann. Après 3 semaines de maturation, les neurones moteurs sont déposés à la surface de l’éponge et cultivés 2 à 3 semaines supplémentaires à l’interface air-liquide pour favoriser la migration axonale vers le bas de l’éponge grâce à la présence des facteurs neurotrophiques dans le milieu de culture. |
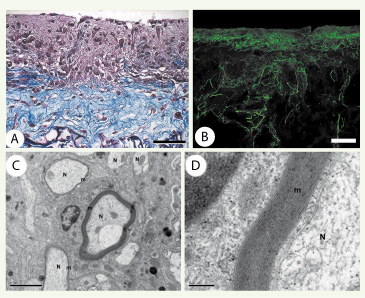
 | Figure 2.
Évaluation du modèle en 3D. A. Aspect histologique de la couche de neurones moteurs déposée au-dessus de l’éponge colonisée par les fibroblastes, qui ont sécrété de grandes quantités de matrices extracellulaires (en bleu). B. Migration à travers l’éponge d’un grand nombre d’axones exprimant le neurofilament M (en vert). C, D. Après 28 jours de maturation des neurones moteurs en présence de cellules de Schwann, la formation de gaines de myéline autour des axones migrant à travers l’éponge est observée en microscopie électronique à transmission. N : neurone, m : myéline. D est un agrandissement de C. Barres en A : 60 µm, en B : 100 µm, en C : 2 µm et en D : 0,2 µm (modifié de [ 14] avec l’autorisation de Wiley Interscience). |
En présence de facteurs neurotrophiques, BDNF (brain-derived neurotrophic factor), NT3 (neurotrophin 3), CNTF (ciliary neurotrophic factor), GDNF (glial cell-derived neurotrophic factor) pour les neurones moteurs, NGF (nerve growth factor) pour les neurones sensoriels, une migration axonale est observée sur une distance de près de 1 mm (visualisée par un marquage en immunofluorescence du neurofilament M, un marqueur des neurones) (Figure 2B), qu’il s’agisse de neurones sensoriels ou moteurs [14, 15]. De plus, ce modèle tridimensionnel permet la maturation des axones émis par les neurones moteurs, puisque le tiers de ceux-ci exprime, en plus du neurofilament M présent dans toutes les fibres, le neurofilament H, un marqueur d’une différenciation poussée de ces axones. Enfin, en présence de cellules de Schwann, nous avons non seulement démontré que ces cellules migraient spontanément pour se placer le long des axones, mais, en plus, qu’elles formaient des gaines de myéline autour d’eux après 28 jours de culture (Figure 2C, D) [14]. C’est la première fois que la formation de gaines de myéline in vitro autour d’axones de neurones moteurs est démontrée. Ce résultat ouvre des perspectives très encourageantes pour l’étude des maladies neurodégénératives dans lesquelles la gaine de myéline est atteinte (syndrome de Guillain-Barré par exemple).
Un autre aspect innovant de ce modèle tient à la possibilité unique de reproduire in vitro à l’intérieur de l’éponge un réseau bien structuré de pseudo-capillaires. Ces capillaires forment une lumière étanche, bien qu’ils ne contiennent pas de sang comme in vivo [
17]. Il est donc possible de combiner, dans notre modèle, à la fois un réseau de pseudo-capillaires et un réseau nerveux et, donc, d’étudier les interactions croisées entre ces deux systèmes. En effet, il existe de nombreuses similitudes biologiques et moléculaires entre les systèmes nerveux et vasculaire. Il a été ainsi démontré que l’innervation sensorielle détermine l’alignement des petits vaisseaux sanguins de la peau et leur différenciation en artériole ou en veinule, entre autres, par l’intermédiaire d’une sécrétion de VEGF (vascular endothelial growth factor) [
18]. Des résultats préliminaires nous ont permis d’établir que, dans ce modèle, les nerfs sensitifs produisent un effet angiogénique.
Ce modèle présente donc une grande flexibilité, puisqu’il peut être constitué, au choix, de différents types de neurones, de différents types de cellules gliales (astrocytes, oligodendrocytes, microglies, cellules de Schwann) et d’autres types cellulaires comme les cellules endothéliales ou musculaires, provenant de souris sauvages ou de souris transgéniques ou ayant un phénotype pathologique. De plus, comme il peut être maintenu en culture pendant plus d’un mois en présence des neurones, il peut être utilisé pour tester l’effet de différents types de molécules sur la migration axonale, la myélinisation ou la cytotoxicité neuronale.
Le principal inconvénient de ce modèle est sa complexité, car il requiert une bonne maîtrise des techniques de génie tissulaire pour reconstruire un tissu en trois dimensions. De plus, la contrainte inhérente à tous les modèles in vitro utilisant des neurones est l’obligation d’obtenir des cellules fraîchement isolées à chaque expérience. Cet impératif se traduit par une quantité de travail et un coût importants, qui en rendent difficile la commercialisation, à moins d’utiliser des lignées cellulaires transformées. D’autre part, l’imagerie du réseau nerveux dans un tissu en trois dimensions est nécessairement plus compliquée à réaliser que dans un réseau monocouche, et exige d’utiliser la microscopie confocale. Enfin, le mélange de plusieurs types cellulaires rend difficiles les études d’expression des gènes.
Ce modèle pourra se révéler extrêmement performant dès lors qu’il pourra être constitué de cellules prélevées chez des patients atteints d’une maladie neurodégénérative. Des progrès récents dans le domaine des cellules souches permettent d’espérer pouvoir obtenir ces cellules par différenciation, à partir de précurseurs neuraux tirés d’une source de tissu accessible. Nous avons ainsi démontré qu’il était possible de différencier en neurones des précurseurs neuraux isolés à partir de peau normale humaine [
19] et nous travaillons également à les différencier en cellules de Schwann. Ces travaux ouvrent la perspective de développer un modèle entièrement humain, constitué de cellules neurales différenciées à partir d’une petite biopsie de peau prélevée chez des patients souffrant, par exemple, de la maladie de Parkinson ou de la sclérose latérale amyotrophique. En déterminant quelle combinaison contenant le moins de cellules malades par rapport aux cellules saines induit la dégénérescence nerveuse, il serait possible de mieux cerner l’origine de la maladie, ainsi que son processus évolutif.