| |
| Med Sci (Paris). 2009 March; 25(3): 232–233. Published online 2009 March 15. doi: 10.1051/medsci/2009253232.Biogénèse de la télomérase : un long voyage jusqu’au bout des chromosomes Franck Gallardo and Pascal Chartrand* Département de biochimie, Université de Montréal, CP 6128, Succursale Centre-ville, Montréal, Québec H3C 3J7 Canada MeSH keywords: Chromosomes de champignon, Chromosomes humains, Humains, ARN fongique, Saccharomyces cerevisiae, Telomerase |
La télomérase est une enzyme essentielle qui maintient la stabilité des génomes en ajoutant des séquences répétées aux extrémités 3’ des chromosomes : les télomères [
1]. Si l’activité de la télomérase est constitutive chez les eucaryotes unicellulaires comme la levure, son expression chez l’humain se limite aux tissus en forte prolifération. La réactivation de cette enzyme dans des cellules somatiques participe directement aux mécanismes de transformation tumorale puisque plus de 85 % des tumeurs expriment la télomérase. D’un autre point de vue, l’inhibition de l’activité de la télomérase dans les cellules transformées induit un fort taux de rémission in vitro, ce qui en fait une cible potentielle pour les thérapies anticancéreuses [
2]. La télomérase est un complexe ribonucléoprotéique (RNP) qui possède une activité rétrotranscriptase et qui porte sa propre matrice d’ARN, appelée TLC1 chez la levure et hTR chez l’humain. Cet ARN sert aussi de squelette pour l’assemblage des composants protéiques du complexe. Chez la levure S. cerevisiae, la protéine Est2p (hTERT chez l’humain) est responsable de l’activité catalytique. Elle contient la fonction de rétrotranscriptase et est accompagnée des sous-unités régulatrices, Est1p et Est3p, qui sont accessoires à l’activité catalytique in vitro mais essentielles in vivo. Est1p est responsable de l’activation de la télomérase aux extrémités terminales des télomères [
3], tandis que la fonction d’Est3p est moins bien caractérisée. Un autre complexe, le complexe yKu70/80, lie l’ARN TLC1 et est associé au processus de recrutement de la télomérase aux télomères [
4]. |
Trafic intracellulaire et biogenèse de la télomérase chez la levure Même si les facteurs associés à l’activité télomérasique et à sa régulation sont bien caractérisés, la biogenèse de cette enzyme reste mal connue. À cause du très faible nombre de copies de l’ARN TLC1 (29 molécules par cellule haploïde [
5]), les études cytologiques visant à détecter cet ARN in situ chez la levure n’ont été réalisées qu’en condition de surexpression, mais elles ont apporté des informations suggérant un trafic intracellulaire de cet ARN [
6,
7]. En utilisant des techniques d’hybridation in situ en fluorescence sur la forme endogène de l’ARN TLC1 de la levure S. cerevisiae, notre équipe a pu étudier en détail son trafic et proposer un lien avec la biogenèse de la télomérase [
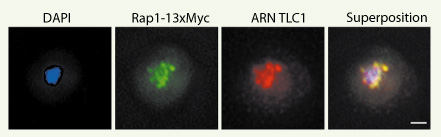
8]. L’ARN TLC1 se regroupe en 6 à 10 foci dans le nucléoplasme des cellules et on le retrouve avec les foci télomériques en phase G1/S du cycle cellulaire (Figure 1). Cet ARN est transcrit sous une forme précurseur contenant une coiffe mono-méthyle guanosine et une queue poly A ; sa forme mature possède une coiffe tri-méthyle guanosine et est sans queue poly A. En étudiant la localisation de l’ARN TLC1 dans une souche contenant une délétion de l’hyperméthylase Tgs1p, nous avons observé que l’hyperméthylation de la coiffe de ce transcrit dépend de Tgs1p et a lieu dans le nucléole. Ce résultat suggère qu’une étape initiale de la maturation de l’ARN TLC1 réside dans le nucléole.  | Figure 1.
L’ARN TLC1 colocalise avec les télomères en phase G1 du cycle cellulaire. Colocalisation entre l’ARN TLC1 (rouge) et la protéine télomérique Rap1-13xMyc (vert) dans une cellule de levure sauvage en phase G1 du cycle cellulaire. Les signaux des deux images ont été déconvolués, superposés et la colocalisation a été mesurée en utilisant le programme Metamorph™ ; 92 % des foci de TLC1 et Rap1p colocalisent. DAPI : ADN nucléaire. Barre de calibration : 1 µm. Image tirée de [ 8]. |
La délétion des protéines Est1-3, ainsi que celle du complexe yKu70/80 induit, de façon surprenante, une accumulation de l’ARN TLC1 dans le cytoplasme des cellules. Cependant, cette accumulation cytoplasmique pourrait être le reflet d’un export nucléaire lié à un défaut de recrutement de la télomérase aux télomères. Afin de vérifier que l’ARN TLC1 est capable de faire la navette entre le noyau et le cytoplasme, des essais de trafic nucléo-cytoplasmique par hétérocaryon ont été utilisés. Les hétérocaryons sont issus de la fusion de cellules TLC1 positives et négatives. Les cellules TLC1 positives contiennent un allèle mutant du gène KAR1 qui permet la fusion cellulaire mais prévient la fusion des deux noyaux. En utilisant cette technique, l’ARN TLC1 fut détecté dans tous les noyaux des hétérocaryons, démontrant un trafic nucléo-cytoplasmique de la forme endogène de cet ARN. En utilisant des mutants conditionnels des différentes voies d’import/export nucléaire, nous avons montré que l’ARN TLC1 mature est exporté du noyau par une voie dépendante de l’exportine Crm1p et ré-importé au noyau par une voie dépendante des importines Kap122p et Mtr10p. |
Un mécanisme de contrôle de qualité ? Nous avons disséqué pour la première fois le trafic nucléo-cytoplasmique d’un ARN nucléaire résidant qui est nécessaire à la fonction télomérasique chez la levure. Il apparaît que l’accumulation nucléaire de la télomérase est dépendante de son propre assemblage, puisque la délétion d’un seul de ses composants protéiques induit une accumulation cytoplasmique de l’ARN TLC1. Il est possible que l’assemblage de la télomérase soit vérifié dans le cytoplasme et qu’un mécanisme de contrôle de qualité inhibe l’import nucléaire de formes mal assemblées. Ces défauts d’assemblage pourraient, par exemple, être liés à un problème de repliement de l’ARN TLC1, ce qui aurait des conséquences graves sur la fonction télomérasique en créant des mutants à activité constitutive ou à activité dominante négative. |
Trafic de la télomérase et homéostasie des télomères chez l’humain Le contrôle de la localisation intracellulaire de hTR est également un élément de la régulation de l’élongation des télomères humains. Dans les cellules de cancer, hTR s’accumule dans les corps de Cajal, un corps nucléaire où s’effectuent l’assemblage et la modification des snRNP (small nuclear ribonucleoproteins) et snoRNP (small nucleolar ribonucleoproteins) [
9,
10]. Un mutant de hTR ne pouvant plus être localisé aux corps de Cajal peut toujours s’associer à hTERT, mais l’élongation des télomères est alors diminuée, accréditant l’idée que les corps de Cajal interviennent dans le recrutement de la télomérase aux télomères [
11]. Est-ce que la localisation de hTR dans les corps de Cajal fait partie d’un mécanisme d’assemblage et de contrôle de qualité de la télomérase chez l’humain ? La question reste à explorer. Notre étude suggère cependant que la biogenèse et le recrutement de la télomérase aux télomères dépend d’un long trafic de son ARN, et que ce trafic constitue un niveau de contrôle potentiel de l’activité de la télomérase. |
1. Vega LR, Mateyak MK, Zakian VA. Getting to the end: telomerase access in yeast and humans. Nat Rev Mol Cell Biol 2003; 4 : 948–59. 2. Harley CB. Telomerase and cancer therapeutics. Nat Rev Cancer 2008; 8 : 167–79. 3. Taggart AK, Teng SC, Zakian VA. Est1p as a cell cycle-regulated activator of telomere-bound telomerase. Science 2002; 297 : 1023–6. 4. Stellwagen AE, Haimberger ZW, Veatch JR, Gottschling DE. Ku interacts with telomerase RNA to promote telomere addition at native and broken chromosome ends. Genes Dev 2003; 17 : 2384–95. 5. Mozdy AD, Cech TR. Low abundance of telomerase in yeast: implications for telomerase haploinsufficiency. RNA 2006; 12 : 1721–37. 6. Ferrezuelo F, Steiner B, Aldea M, Futcher B. Biogenesis of yeast telomerase depends on the importin mtr10. Mol Cell Biol 2002; 22 : 6046–55. 7. Teixeira MT, Forstemann K, Gasser SM, Lingner J. Intracellular trafficking of yeast telomerase components. EMBO Rep 2002; 3 : 652–9. 8. Gallardo F, Olivier C, Dandjinou AT, et al. TLC1 RNA nucleo-cytoplasmic trafficking links telomerase biogenesis to its recruitment to telomeres. EMBO J 2008; 27 : 748–57. 9. Jady BE, Bertrand E, Kiss T. Human telomerase RNA and box H/ACA scaRNAs share a common Cajal body-specific localization signal. J Cell Biol 2004; 164 : 647–52. 10. Zhu Y, Tomlinson RL, Lukowiak AA, et al. Telomerase RNA Accumulates in Cajal Bodies in Human Cancer Cells. Mol Biol Cell 2004; 15 : 81–90. 11. Cristofari G, Adolf E, Reichenbach P, et al. Human Telomerase RNA Accumulation in Cajal Bodies Facilitates Telomerase Recruitment to Telomeres and Telomere Elongation. Mol Cell 2007; 27 : 882–9. |