| |
| Med Sci (Paris). 2009 January; 25(1): 64–68. Published online 2009 January 15. doi: 10.1051/medsci/200925164.Allo-immunisation fœto-maternelle anti-CD10 Pierre Ronco,1,2* Hanna Debiec,1,2 and Vincent Guigonis3 1Unité Inserm UMR S 702, UPMC Université Paris 6, Assistance Publique- Hôpitaux de Paris, Hôpital Tenon, Paris, France 2Service de Néphrologie et Dialyses, Hôpital Tenon, 4, rue de la Chine, 75020 Paris, France 3Département de Pédiatrie, CHU de Limoges, Limoges, France |
L’allo-immunisation est définie par une réponse immune dirigée contre des antigènes d’un individu ou d’un organisme de la même espèce mais génétiquement distinct. Il y a trois causes principales d’allo-immunisation. La première est la transplantation d’organe ; la seconde est la transfusion de sang total ou d’éléments figurés du sang ; la troisième est la grossesse. Les mécanismes physiologiques qui permettent à une mère d’être tolérante vis-à-vis de son fœtus semi-allogénique restent mal expliqués. La tolérance n’est que partielle. La production d’anticorps anti-HLA et dirigés contre les antigènes de groupes sanguins est souvent observée en cas de grossesses répétées. Pendant la grossesse, l’allo-immunisation peut induire une maladie périnatale. Pendant longtemps, on a considéré que les maladies foeto-maternelles par allo-immunisation se résumaient à l’anémie hémolytique, principalement par incompatibilité Rhésus, et à la thrombopénie néonatale, principalement par incompatibilité dans le système HPA-1 (human platelet antigen). Cet article est consacrée à la découverte d’un nouveau mécanisme de maladie rénale par alloimmunisation fœto-maternelle contre l’antigène CD10 [endopeptidase neutre (EPN)]. |
L’allo-immunisation fœto-maternelle : un nouveau mécanisme de maladie rénale Des mutations du gène MME(membrane metallo-endopeptidase)chez les mères, responsables de maladie rénale chez les enfants Nous avons récemment caractérisé un groupe de glomérulopathies anténatales par allo-immunisation fœto-maternelle. Dans ces maladies dont l’acronyme est Fmaig ( feto-maternal alloimmune antenatal glomerulopathies), il existe une anomalie du gène MME ( membrane metallo-endopeptidase) codant pour la protéine CD10/EPN 1, qui induit une maladie rénale chez le nouveau-né. Les mères qui ont un défaut d’expression de cette protéine s’immunisent pendant leur grossesse contre l’antigène CD10 hérité du père, qui est exprimé par les syncytiotrophoblastes et par les cellules fœtales [
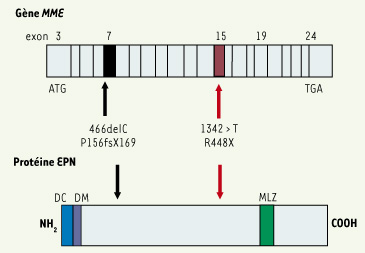
1]. Les exons 3 à 24 du gène MME codent pour une protéine membranaire constituée de 748 acides aminés, avec un court segment intracytoplasmique amino-terminal, un seul domaine transmembranaire, et un large domaine extracellulaire carboxy-terminal, qui porte le site enzymatique actif (Figure 1). Dans trois familles originaires des Pays-Bas, du Portugal et du Maroc chez lesquelles la déficience en EPN est transmise selon un mode autosomique dominant (en accord avec la localisation du gène MME sur le chromosome 3), nous avons identifié deux mutations tronquantes, localisées respectivement dans les exons 7 et 15 du gène MME
(Figure 1). Le gène muté est non fonctionnel, en raison d’une instabilité de l’ARN messager ou d’une destruction prématurée de la protéine [
2].  | Figure 1.
Schéma du gène MME et de l’endopeptidase neutre. Le gène comporte 24 exons. Deux mutations ont été détectées dans les exons 7 et 15. La mutation dans l’exon 7 est une délétion d’un nucléotide qui entraîne un décalage du cadre de lecture et l’apparition prématurée d’un codon stop. La mutation dans l’exon 15 introduit un codon stop. Pour 466delC, P156fsX169: délétion d’une cytosine en position 466 (codon 156) qui induit un décalage du cadre de lecture avec une terminaison prématurée de la transcription au codon 169. Pour 1342 > T, R448X : mutation non sens remplaçant une cytosine par une thymidine en position 1342, qui induit le remplacement d’un codon arginine par un codon stop en position 448. La protéine est composée d’un court domaine cytoplasmique (DC), d’un domaine transmembranaire (DM), et d’un large domaine extracellulaire qui contient un motif liant le zinc (MLZ) essentiel à l’activité enzymatique. Les mutations dans les exons 7 et 15 prédisent une protéine tronquée, qui est rapidement dégradée dans le protéasome. |

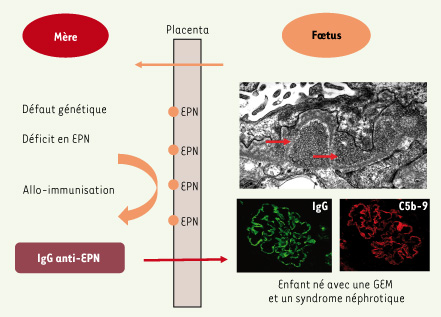
Les anticorps anti-EPN induisent la maladie rénale anténatale Les anticorps anti-EPN produits par les mères déficientes en CD10 et transférés au fœtus sont responsables de la glomérulopathie extramembraneuse (GEM) observée chez les nouveau-nés (Figure 2). Les GEM sont des maladies immunologiques dans lesquelles des anticorps sont produits contre une cible antigénique qui peut être présente à la surface des podocytes glomérulaires (Encadré). La formation de dépôts immuns suivie de l’activation du complément à la surface de ces cellules est responsable de lésions glomérulaires et d’altérations de la perméabilité capillaire qui sont à l’origine de la protéinurie [
3,
4,
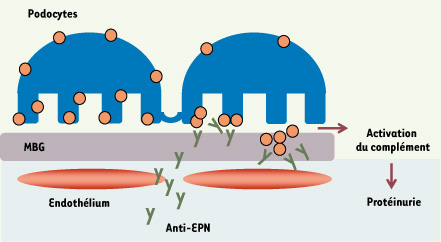
18]. L’EPN apparaît au stade du corps en S ( voir Encadré) et continue à être exprimée dans les podocytes matures [ 4]. Elle peut être la cible des anticorps maternels circulants dès le stade post-capillaire quand les glomérules commencent à être perfusés (Figure 3). Les biopsies rénales des patients atteints de GEM anténatale montrent la présence de dépôts volumineux au contact des podocytes, dans lesquels l’examen au microscope confocal révèle la présence de l’antigène EPN, d’anticorps de classe IgG, et du complexe d’attaque membranaire du complément C5b-9.  | Figure 2.
Schéma physiopathologique des glomérulopathies extramembraneuses néonatales par allo-immunisation dirigée contre l’endopeptidase neutre. L’enfant est né avec une forme sévère de syndrome néphrotique du à une glomérulopathie extramembraneuse caractérisée par des dépôts denses aux électrons (flèches) contenant des IgG (vert) et le complexe d’attaque membranaire du complément C5b-9 (rouge). La mère, déficiente génétiquement en EPN, s’est immunisée pendant la grossesse contre l’endopeptidase neutre exprimée par les cellules placentaires. Les IgG maternelles anti-endopeptidase neutre ont été transférées au fœtus à travers le placenta. |
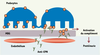 | Figure 3.
Mécanisme de formation des dépôts extramembraneux dans l’allo-immunisation anti-EPN. Dès que les glomérules sont vascularisés, les anticorps anti-EPN traversent l’endothélium fenestré (rouge) et la membrane basale glomérulaire (MBG), et atteignent leur cible antigénique, l’EPN (ronds oranges) à la surface des podocytes. La fixation de l’anticorps entraîne une redistribution de l’antigène (clustering) suivie du relargage des complexes immuns qui adhèrent à des composants de la MBG (membrane basale glomérulaire). Les complexes immuns augmentent en taille et activent le complément, induisant une cascade d’événements qui augmentent la perméabilité de la paroi capillaire aux protéines et provoquent l’apparition d’un syndrome néphrotique. |
Les membres des familles portant les mutations du gène MME n’ont aucune manifestation rénale à l’exception des enfants nés de mères immunisées [2]. Cette observation et le fait que des lapins injectés avec les immunoglobulines maternelles anti-EPN ont développé une GEM [1], confirment que la maladie observée est due au passage transplacentaire des anticorps, et non pas directement aux altérations génétiques. La sévérité de la maladie rénale dépend de la réponse allo-immune Bien que les mutations du gène MME aient été détectées chez toutes les mères immunisées, l’expression de la maladie rénale est variable chez les enfants. Sa sévérité est déterminée par le taux des anticorps maternels, et aussi par leurs sous-classes. Le développement de la maladie semble nécessiter la production d’anticorps maternels de sous-classe IgG1. Si seulement des IgG4 anti-EPN sont produites, aucune protéinurie n’est observée chez les nouveau-nés [ 2]. L’absence de manifestations rénales ne peut pas être expliquée par un défaut de passage transplacentaire des IgG4, car à la naissance, les concentrations fœtales et maternelles d’IgG4 et d’IgG3 sont équivalentes, alors que celles d’IgG1 sont plus élevées chez le fœtus et celles d’IgG2 plus importantes chez la mère [
6]. Les sous-classes d’IgG interagissent de façon différente avec le complément. Les IgG1 et les IgG3 sont capables de fixer le C1q et d’activer la voie classique du complément, conduisant à la production de C5b-9, alors que les IGg4 n’activent pas le complément [
7]. L’allo-immunisation fœto-maternelle : une cause méconnue de néphropathie à l’adolescence ? Après la naissance, l’insuffisance rénale et le syndrome néphrotique se sont rapidement amendés chez tous les enfants. Cependant, le patient le plus âgé a développé de façon retardée à l’âge adulte, une insuffisance rénale chronique sévère nécessitant le recours à la transplantation. Cette insuffisance rénale est probablement la conséquence des lésions de GEM combinées à une réduction anténatale du nombre de néphrons liée au conflit immunologique. La production par les enfants d’anticorps dirigés contre les idiotypes ou allotypes portés par les IgG maternelles, a pu contribuer à la progression de la maladie rénale. Cette observation suggère qu’une maladie rénale anténatale liée à l’alloimmunisation anti-EPN, peut se manifester sous la forme d’une GEM ou d’une insuffisance rénale « idiopathique » à l’adolescence ou éventuellement plus tard. Les sujets déficients en EPN n’ont pas de phénotype : des hommes différents des souris ! L’EPN appartient à une famille de métallopeptidases fixant le zinc qui comporte 7 membres. Les six individus identifiés déficients en EPN sont apparemment en bonne santé. L’absence de phénotype apparent était inattendue, car l’EPN est une ectoenzyme largement distribuée dans l’organisme, qui dégrade des hormones peptidiques ayant un rôle important comme le glucagon, les enképhalines, la substance P, la neurotensine, l’ocytocine, la bradykinine, les peptides natriurétiques, l’endothéline, ainsi que le peptide β-amyloïde qui est l’agent pathogène de la maladie d’Alzheimer [
8]. L’absence de conséquences apparentes du déficit en EPN peut probablement être expliquée par une redondance fonctionnelle avec d’autres enzymes [
9,
10]. Les souris déficientes en EPN ont un comportement différent, manifestant entre autres une hypotension, une sensibilité accrue au choc infectieux, une forme précoce de maladie d’Alzheimer, des tumeurs prostatiques, et un goût prononcé pour l’alcool ( voir revue dans [
11]). L’allo-immunisation : une nouvelle cause de maladie d’organe chez le nouveau-né et plus tard ? Il est possible que des mutations tronquantes d’antigènes podocytaires autres que l’EPN, qui ne provoquent pas de symptômes chez les femmes porteuses, puissent conduire à une réaction allo-immune et au passage transplacentaire d’anticorps « néphritogènes ». De même, une immunisation dirigée contre des allo-variants de protéines exprimées par les cellules placentaires chez la mère, et par les cellules glomérulaires chez le fœtus, pourrait provoquer une maladie rénale néonatale. Ce scénario pourrait aussi être impliqué dans des maladies pédiatriques affectant d’autres organes que le rein, comme certaines formes d’hémochromatose néonatale récurrente [
12], et chez des patients développant une GEM après transplantation de rein ou de moelle osseuse. Dans le cas de la transplantation rénale, un receveur asymptomatique déficient en EPN pourrait reconnaître comme étrangère l’EPN exprimée par les cellules rénales du donneur, et produire des anticorps anti-EPN qui se fixent sur l’EPN des podocytes du greffon. |
Surveillance des femmes allo-immunisées contre l’endopeptidase neutre La GEM anténatale allo-immune est une maladie sévère qui menace le pronostic vital et rénal du nouveau-né. Nous avons observé récemment que les nouveau-nés issus d’une seconde grossesse étaient plus sévèrement affectés, présentant à la naissance un syndrome néphrotique majeur, un défaut de fonctionnement du tubule proximal et une ostéopénie. L’aggravation des manifestations cliniques après une seconde grossesse n’était pas inattendue, étant annoncée par une augmentation majeure du titre des anticorps maternels anti-EPN résultant d’une nouvelle exposition à l’EPN placentaire. Contrairement à l’allo-immunisation fœto-maternelle anti-Rhésus, l’immunisation anti-EPN survient lors de la première grossesse quand le système immunitaire maternel reconnaît l’EPN du placenta, et les grossesses ultérieures représentent des « rappels » d’immunisation [
13]. Il est important : (1) d’identifier des familles à risque de glomérulonéphrite allo-immune ; et (2) de mettre au point un dosage des anticorps. Dès lors qu’une famille est identifiée, la déficience en EPN peut être rapidement détectée chez les membres de la famille en mesurant l’activité enzymatique ou l’antigène dans les urines, et en recherchant les mutations du gène MME. La surveillance des grossesses chez les mères déficientes en EPN repose sur le dosage par ELISA des anticorps anti-EPN des sous-classes IgG1 et IgG4. Ces dosages peuvent utiliser l’EPN recombinante ou les allo-épitopes de l’EPN contre lesquels les anticorps sont produits. En utilisant des segments de l’ADN complémentaire du gène MME humain exprimés dans les cellules d’insecte et des peptides chevauchants de 12 acides aminés du segment immunogène, nous avons identifié 2 épitopes linéaires immunodominants spécifiquement reconnus par les lymphocytes B des mères immunisées. |
Vers des traitements immunosuppresseurs spécifiques de l’antigène L’objectif du traitement est de réduire le titre des allo-anticorps maternels le plus tôt possible pendant la grossesse. Jusqu’à présent, nous avons utilisé seulement des méthodes non spécifiques pour diminuer le titre des anticorps anti-EPN. Un traitement hebdomadaire par voie intraveineuse avec de fortes doses d’immunoglobulines commencé dès la 18e semaine de gestation et associé à des corticoïdes, a effectivement diminué la réponse immune humorale. Les immunoglobulines par voie intraveineuse permettent également, en théorie, de réduire le passage transplacentaire des anticorps en saturant le récepteur Fc néonatal qui joue un rôle important dans le passage des Ig de la mère au fœtus. Dans d’autres affections dans lesquelles un processus d’allo-immunisation foeto-maternelle est prouvé ou envisagé, le traitement par les immunoglobulines et les plasmaphérèses a été utilisé avec succès : c’est le cas dans les anémies fœtales sévères par allo-immunisation [
14] et dans l’hémochromatose néonatale récurrente [12]. Cependant, les dérivés des produits sanguins exposent au risque de contamination infectieuse. D’autres options thérapeutiques ciblant les cellules B, comme le Rituximab (anticorps anti-CD20), ont été utilisées dans les maladies auto-immunes, y compris dans les GEM [
15], mais sont contre-indiquées pendant la grossesse. Dans l’idéal, le traitement devrait supprimer de façon sélective la réactivité immunologique vis-à-vis de l’antigène cible, sans altérer le fonctionnement du système immunitaire dans son ensemble. L’administration nasale de faibles doses d’antigène ou de peptide synthétique immunodominant a permis d’induire une tolérance dans plusieurs modèles expérimentaux d’auto-immunité et d’allo-immunité, en particulier dans des glomérulonéphrites et dans la maladie hémolytique par incompatibilité Rhésus [
16,
17]. Nous avons débuté la cartographie des épitopes peptidiques reconnus par les cellules T des mères immunisées. Nous avons parallèlement établi un modèle expérimental d’allo-immunisation fœto-maternelle anti-EPN chez la souris, en croisant des souris femelles déficientes en EPN avec des mâles sauvages. Ce modèle sera utilisé dans des expériences pilotes pour induire la tolérance par voie nasale ou veineuse avec de petites doses de peptides immunodominants spécifiques des cellules T. L’objectif est de transférer le protocole expérimental aux femmes déficientes en EPN. |
Nos observations ont remis en cause le dogme selon lequel les maladies dues à une allo-immunisation fœto-maternelle seraient restreintes aux éléments figurés du sang. La maladie rénale que nous avons décrite nous a permis d’identifier le premier antigène cible de la surface des podocytes impliqué dans les GEM. La cartographie des épitopes peut permettre le dosage spécifique des anticorps néphritogènes et l’induction d’une tolérance peptidique. |
La recherche des auteurs est financée par des dotations du GIS-Institut des Maladies Rares, de l’Agence de la Biomédecine, de l’ANR, par le Programme Hospitalier de Recherche Clinique (PHRC, V. Guigonis, Limoges), et par le programme FP7 de la Communauté Européenne (Thème 1, EUNEFRON, HEALTH-F2-2007-201590).
|
Footnotes |
1. Debiec H, Guigonis V, Mougenot B, et al. Antenatal membranous glomerulonephritis due to anti-neutral endopeptidase antibodies. N Engl J Med 2002; 346 : 2053–60. 2. Debiec H, Nauta J, Coulet F, et al. Role of truncating mutations in MME gene in feto-maternal allo-immunization and neonatal glomerulopathies. Lancet 2004; 364 : 1252–9. 3. Hörl WH, Kerjaschki D. Membranous glomerulonephritis (MGN) J Nephrol 2000; 13 : 291–316. 4. Cunningham PN, Quigg RJ. Contrasting roles of complement activation and its regulation in membranous nephropathy. J Am Soc Nephrol 2005; 16 : 1214–22. 5. Platt JL, Grant BW, Eddy AA, Michael AF. Immune cell populations in cutaneous delayed-type hypersensitivity. J Exp Med 1983; 158 : 1227–42. 6. Simister NE. Placental transport of immunoglobulin G. Vaccine 2003; 21 : 3365–9. 7. Clark MR. IgG effector mechanisms. Chem Immunol 1997; 65 : 88–110. 8. Turner AJ, Brown CD, Carson JA, Barnes K. The neprilysin family in health and disease. Adv Exp Med Biol 2000; 477 : 229–40. 9. Ikeda K, Emoto N, Raharjo SB, et al. Molecular identification and characterization of novel membrane-bound metalloprotease, the soluble secreted form of which hydrolyzes a variety of vasoactive peptides. J Biol Chem 1999; 274 : 32469–77. 10. Bonvouloir N, Lemieux N, Crine P, et al. Molecular cloning, tissue distribution, and chromosomal localization of MMEL2, a gene coding for a novel human member of the neutral endopeptidase-24.11 family. DNA Cell Biol 2001; 20 : 493–8. 11. Ronco P, Debiec H. Molecular pathomechanisms of membranous nephropathy: from Heymann nephritis to alloimmunization. J Am Soc Nephrol 2005; 16 : 1205–13. 12. Whitington PF, Kelly S. Outcome of pregnancies at risk for neonatal hemochromatosis is improved by treatment with high-dose intravenous immunoglobulin. Pediatrics 2008; 121 : e1615–21. 13. Nortier JL, Debiec H, Tournay Y, et al. Neonatal disease in neutral endopeptidase alloimmunization: lessons for immunological monitoring. Pediatr Nephrol 2006; 1 : 1399–405. 14. Collinet P, Subtil D, Puech F, Vaast P. Successful treatment of extremely severe fetal anemia due to Kell alloimmunization. Obstet Gynecol 2002; 100 : 1102–5. 15. Ruggenenti P, Chiurchiu C, Brusegan V, et al. Rituximab in idiopathic membranous nephropathy: a one-year prospective study. J Am Soc Nephrol 2003; 14 : 1851–7. 16. Reynolds J, Prodromidi EI, Juggapah JK, et al. Nasal administration of recombinant rat alpha3(IV)NC1 prevents the development of experimental autoimmune glomerulonephritis in the WKY rat. J Am Soc Nephrol 2005; 16 : 1350–9. 17. Hall AM, Cairns LS, Altmann DM, et al. Immune responses and tolerance to the RhD blood group protein in HLA-transgenic mice. Blood 2005; 105 : 2175–9. 18. Monteiro RC, Leroy V, Launay P, et al. Pathogénie de la maladie de Berger : Implication des immunoglobulines A et de leurs récepteurs. Med Sci (Paris) 2003; 19 : 1233–41. |