| |
| Med Sci (Paris). 2009 January; 25(1): 28–30. Published online 2009 January 15. doi: 10.1051/medsci/200925128.La dissémination précoce de cellules métastatiques Une nouvelle donnée aux conséquences majeures ! Alain Puisieux1,2,3* and Stéphane Ansieau1,2* 1Inserm U590, F-69008 Lyon, France 2Centre Léon Bérard, 28, rue Laennec, F-69008 Lyon, France 3Université Lyon 1, ISPB, F-69003 Lyon, France MeSH keywords: Mouvement cellulaire, Humains, Métastase tumorale, Protéines nucléaires, Facteur de transcription Twist |
Le dogme d’une sous-population aux propriétés métastatiques prédéterminées L’Agence internationale de recherche sur le cancer (IARC) recense chaque année plus de 10 millions de nouveaux cas de cancers. Six millions de personnes meurent chaque année d’un cancer, soit 12 % des décès dans le monde. L’incidence des cancers pourrait augmenter de 50 % d’ici à 2020 pour atteindre 15 millions de nouveaux cas chaque année, notamment en raison du vieillissement de la population. Dans les pays industrialisés, les gens âgés ne sont pas les seuls touchés : le cancer est désormais la première cause de mortalité avant 65 ans. Si les progrès médicaux, principalement dans les domaines du dépistage et de la chirurgie, permettent d’éliminer au plus tôt la tumeur primaire, la principale complication et source de décès vient de la dissémination de cellules cancéreuses capables, parfois après des années de dormance [
11], de générer des métastases. Définir l’origine de ces cellules métastatiques et leurs déterminants moléculaires est donc un enjeu médical majeur tant à des fins prédictives que thérapeutiques. En partant du principe que la dissémination métastatique est un évènement tardif, lié à la sélection d’une sous-population de cellules présente dans la tumeur primaire, de nombreuses équipes ont tenté d’identifier des marqueurs susceptibles de prédire l’activité métastatiques des tumeurs. En comparant l’expression de gènes de lignées métastatiques ou non, de lignées placées dans des conditions de stress (conditions d’hypoxie par exemple), différentes « signatures » géniques ont été établies. Validées statistiquement sur un grand nombre de tumeurs, ces signatures ont permis de mettre en évidence l’importance de toute une batterie deprotéines, essentielles à la dissémination des cellules à partir de la tumeur primaire, à leur survie dans le flux sanguin ou lymphatique et à leur capacité à proliférer dans l’organe secondaire ciblé [
1,
12,
13]. Leur relevance a ensuite été expérimentalement vérifiée en montrant que l’inhibition conjointe de l’expression de plusieurs des gènes identifiés est suffisante pour ralentir la prise tumorale et abolir la dissémination métastatique d’une lignée mammaire humaine dans des expériences de xénogreffes [
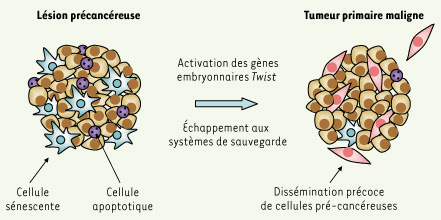
2].  | Figure 1.
Modèle alternatif de progression tumorale.
|
|
Le dogme mis en échec par la dissémination précoce de cellules cancéreuses Si les métastases résultent de la sélection de quelques cellules dans lesquelles ces gènes spécifiques sont exprimés, comment expliquer les cas de patients présentant des métastases sans qu’aucune tumeur primaire ne soit détectée, voire la transmission de cellules cancéreuses lors de don d’organes à partir d’un donneur chez lequel aucune tumeur primaire n’a été décelée ? Les études menées en Allemagne par le groupe de Christophe Klein ont permis de remettre en question le modèle généralement admis, en caractérisant chez des patientes atteintes de cancers du sein, des cellules épithéliales mammaires ayant migré dans la moelle osseuse (DTC, disseminated tumor cells). L’absence dans ces cellules d’anomalies chromosomiques majeures suggère qu’elles aient migré à un stade où les systèmes de réparation de l’ADN sont encore capables d’assurer l’intégrité du génome, autrement dit dès le stade bénin [
3,
4] : une hypothèse ensuite vérifiée dans un modèle de progression tumorale mammaire murin [
5]. Quels avantages sélectifs favorisent la dissémination de ces cellules ? |
Une partie de la réponse pourrait être apportée par l’étude des propriétés des gènes Twist. Ces gènes, qui assument des fonctions embryonnaires essentielles, sont généralement indétectables dans les tissus adultes sains et surexprimés dans des cancers [
6]. L’étude de leurs propriétés nous a permis de montrer que les protéines produits de ces gènes favorisent d’une part la transition du stade bénin au stade malin, en éliminant les deux barrières naturelles capables de s’opposer à la prolifération anarchique de cellules, que sont l’induction de la mort des cellules par apoptose et l’arrêt définitif de leur prolifération (un processus connu sous le nom de sénescence prématurée) [
7,
8]. L’inhibition de ces mécanismes résulte de la capacité des protéines Twist à bloquer conjointement les deux voies de signalisation dépendantes des protéines Rb et p53 en empêchant l’induction des inhibiteurs de cycline-kinases p16INK4A, p21CIP1 et de la protéine ARF. Elles coopèrent d’autre part avec les oncogènes activés, exprimés dans ces cellules, pour inhiber l’expression de gènes épithéliaux (comme la E-cadhérine), activer inversement celle de gènes mésenchymateux (comme la vimentine) et ainsi induire un changement cellulaire profond (un mécanisme de trans-différenciation connu sous le nom de transition épithélio-mésenchymateuse, [
9]) capable de promouvoir la mobilité cellulaire. Autrement dit, l’activation des gènes embryonnaires Twist permet simultanément de favoriser l’émergence et la dissémination de cellules cancéreuses [8]. La mise en évidence d’une dissémination précoce de cellules cancéreuses, capables d’évoluer indépendamment de la tumeur primaire a évidemment des conséquences importantes sur les approches à développer tant pour évaluer le risque de métastases (fins prédictives) que pour élaborer de nouvelles stratégies pour les éradiquer. Bien que la caractérisation des tumeurs primaires ait été à de nombreux égards informative, la caractérisation des DTC en montre les limites. Ainsi, dans le cadre du cancer de l’œsophage, l’amplification du gène HER2 dans les DTC apparaît comme un facteur de risque important alors que sa détection dans la tumeur primaire ne constitue pas un facteur de mauvais pronostic [
10]. La caractérisation de ces DTC présente donc un intérêt thérapeutique évident. Le nombre de gènes embryonnaires réactivés dans les cancers par ailleurs ne cesse de croître. Définir l’impact sur la progression tumorale de programmes embryonnaires dans leur ensemble en lieu et place d’un gène donné apparaît désormais comme une nécessité. |
1. Nguyen DX, Massagué J. Genetic determinants of cancer metastasis. Nat Rev Gen 2007; 8 : 341–52. 2. Gupta GP, Nguyen DX, Chiang AC, et al. Mediators of vascular remodelling co-opted for sequential steps in lung metastasis. Nature 2007; 446 : 765–70. 3. Schmidt-Kittler O, Ragg T, Daskalakis A, et al. From latent disseminated cells to overt metastasis: genetic analysis of systemic spread breast cancer progression. Proc Natl Acad Sci
USA 2003; 100 : 7737–42. 4. Schardt JA., Meyer M, Hartmann CH, et al. Genomic analysios of single cyokeratin-positive cells from bone marrow reveals early mutational events in breast cancer. Cancer Cell 2005; 8 : 227–39. 5. Hüsemann Y, Geigl JB, Schubert F, et al. Systemic spread is an early step in breast cancer. Cancer Cell 2008; 13 : 58–68. 6. Puisieux A, Valsesia-Wittmann S, Ansieau S. A twist for survival and cancer progression. Br J Cancer 2006; 94 : 13–7. 7. Valsesia-Wittmann S, Magdeleine M, Dupasquier S, et al. Oncogenic cooperation between H-Twist and N-Myc overrides failsafe programs in cancer cells. Cancer Cell 2004; 6 : 625–30. 8. Ansieau S, Bastid J, Doreau A, et al. Induction of EMT by Twist proteins as a collateral effect of tumor-promoting inactivation of premature senescence. Cancer Cell 2008; 14 : 79–89. 9. Thiery JP. Epithelial-mesenchymal transition in development and pathologies. Curr Opin Cell Biol 2003; 15 : 740–6. 10. Stoecklein NK, Hosch SB, Bezler M, et al. Direct genetic analysis of single disseminated cancer cells for prediction of outcome and therapy selection in esophageal cancer. Cancer Cell 2008; 13 : 441–53. 11. Quesnel B. « Je te tiens, tu me tiens »… Dormance tumorale : un équilibre instable ? Med Sci (Paris) 2008; 24 : 575–6. 12. Raguénez G, Bénard J. Prédire le potentiel métastatique : l’apport de la génomique. Med Sci (Paris) 2003; 19 : 1050–1. 13. Bertucci F, Finetti P, Cervera N, Birnbaum D. Classification pronostiquedu cancer du sein et profils d’expression génique sur puces à ADN. Med Sci (Paris) 2008; 24 : 599–606. |