| |
| Med Sci (Paris). 2009 January; 25(1): 24–26. Published online 2009 January 15. doi: 10.1051/medsci/200925124.Un nouvel espoir dans le traitement de la schistosomiase Colette Dissous,* Arnaud Ahier, and Thavy Long Inserm U547, Institut Pasteur Lille, Université Lille 2, 1, rue du Professeur Calmette, 59019 Lille, France MeSH keywords: Animaux, Modèles animaux de maladie humaine, Humains, Souris, Stress oxydatif, Vaccin antiprotozoaire, Schistosoma, Schistosomiase, Schistosomicides |
La schistosomiase, aussi connue sous le nom de bilharziose, est une maladie parasitaire chronique causée par un ver plat de la classe des trématodes et du genre Schistosoma. Trois espèces principales de schistosomes, S. mansoni, S. haematobium et S. japonicum, infectent les populations humaines. Ces parasites ont un cycle de vie complexe qui évolue à la fois chez un hôte vertébré et chez un mollusque d’eau douce produisant des cercaires qui infectent les individus par voie transcutanée. La schistosomiase est une maladie des pays pauvres, qui fait partie des « neglected tropical diseases » (NTD) et constitue un problème majeur de santé publique dans les pays du tiers-monde. On estime à plus de 700 millions le nombre de personnes à risque à travers le monde, à 200 millions celui des individus infectés et à plus de 250 000 le nombre de décès annuels causés par la maladie, principalement en Afrique sub-saharienne [
1]. |
Les traitements de la schistosomiase En l’absence d’un vaccin disponible, le contrôle de la schistosomiase repose essentiellement sur la chimiothérapie. Au cours du XXe siècle, de nombreuses drogues allant de molécules très toxiques (comme les dérivés de l’antimoine) à des composés chimiques mieux tolérés (niridazole, hycanthone, oxamniquine, metrifonate, oltipraz…) ont été utilisées tour à tour pour le traitement de la schistosomiase [
2]. Depuis ces trente dernières années, la drogue la plus largement utilisée est le Praziquantel (Biltricide®) car elle présente de nombreux avantages. Administrable oralement en une seule prise et d’un prix très modéré, cette drogue est efficace contre les trois espèces de schistosomes avec très peu d’effets secondaires. Toutefois, le traitement par le Praziquantel est très peu actif sur les formes jeunes du parasite dans les infections récentes. Il doit donc être renouvelé régulièrement et l’utilisation massive du Praziquantel en zones d’endémie laisse présager l’apparition de souches parasitaires résistantes, certains isolats moins sensibles ayant déjà été identifiés [
3]. Pour cela, l’OMS (Organisation Mondiale de la Santé) a défini comme une priorité stratégique la recherche de nouveaux médicaments contre les schistosomes. Ces dernières années, un réel effort a été entrepris pour développer de nouvelles thérapies contre les schistosomes, et un certain nombre de composés schistosomicides ont été découverts dans divers laboratoires. En particulier, les drogues anti-malariques comme les artémisines ou plus récemment leurs dérivés synthétiques (1,2-4 trioxolanes), se sont révélées être efficaces contre les formes juvéniles et adultes de S. mansoni [
4]. L’utilisation de ces anti-malariques pour le traitement de la schistosomiase suscite toutefois des mises en garde contre l’apparition de résistances dans le paludisme et de nombreuses autres objections. Les avancées réalisées dans le décryptage du génome des schistosomes ont permis dans le même temps de caractériser un certain nombre de protéines essentielles à la croissance et à la survie du parasite [
13]. Certaines de ces protéines possèdent des caractéristiques structurales très différentes de celles de leurs homologues mammifères et peuvent ainsi être des cibles potentielles pour de nouveaux agents chimiothérapeutiques. Parmi elles, on peut noter plusieurs protéine kinases impliquées dans la relation avec l’hôte ainsi que dans la fécondité des vers femelles [
5,
6], mais aussi des cystéine protéases qui sont essentielles à la digestion et à la nutrition du parasite et représentent à ce titre des cibles privilégiées. Des travaux récents ont démontré que le composé K11777 (un inhibiteur de protéase de type vinylsulfone déjà utilisé en phase pré-clinique dans la maladie de Chagas1) inhibe fortement l’activité de la cathepsine B1 de S. mansoni et entraîne une diminution significative de la charge parasitaire et de la pathologie chez les souris infectées [
7]. |
Le furoxan : une nouvelle drogue très prometteuse Les schistosomes sont des parasites sanguins vivant dans un environnement aérobie et soumis à un stress oxydatif important, qui est dû au métabolisme même du parasite ainsi qu’à la pression immunitaire permanente exercée par l’hôte parasité. Pour résister à ce stress, les schistosomes possèdent un système redox thiol-dépendant efficace (Figure 1) et c’est précisément celui-ci que l’équipe du Dr Williams (Illinois State University, États-Unis) a choisi de cibler pour développer de nouvelles drogues anti-schistosome. Une raison majeure pour choisir la voie des enzymes anti-oxydantes comme moyen d’attaque contre le parasite a d’abord été la démonstration par ces mêmes auteurs que la balance thiol-redox du parasite est gérée par des enzymes très différentes de celles de l’hôte [
8]. En effet, chez les vertébrés il existe deux voies de détoxification des espèces réactives de l’oxygène qui dépendent l’une de la thiorédoxine, l’autre du glutathion, et qui font intervenir deux flavoenzymes (dépendantes du NADPH), la Thiorédoxine réductase (Trx) et la Glutathion réductase (GR), pour maintenir respectivement les taux adéquats de thiols à l’état réduit [
14,
15]. Chez le schistosome, ces deux voies sont confondues et dépendent d’une seule enzyme, la Thiorédoxine glutathion réductase (TGR) [
9]. Le caractère essentiel de TGR pour la survie du parasite et les propriétés uniques de TGR ont fait d’elle une cible attractive pour de nouvelles chimiothérapies [
10]. 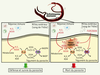 | Figure 1.
Mécanisme d’action du furoxan sur l’équilibre redox du schistosome. Les molécules oxydantes (H2O2, ROOH) provenant du métabolisme oxydatif du parasite ou produites par les cellules immunes de l’hôte sont prises en charge et réduites par l’enzyme Prx2 (peroxyrédoxine 2) qui utilise deux thiols réducteurs, glutathion (GSH) et thiorédoxine (Trx) comme substrats. Les molécules oxydées (GSSG et Trx(S-S)) sont ensuite réduites par TGR (thiorédoxine glutathion réductase), une flavoenzyme dépendante du NADPH. En présence du furoxan (4-phenyl-3-furoxancarbonitrile, PubChem compound ID1756), un puissant inhibiteur de TGR, le maintien du taux de thiols réduits ne peut être assuré et les molécules oxydantes s’accumulent dans le tégument du parasite. De plus le furoxan produit des molécules de NO (monoxyde d’azote) qui augmentent le stress oxydant et provoquent la mort du parasite. (photo : couple de schistosomes mâle et femelle-Louis de Vos, Université libre de Bruxelles) |
Les premières données ont montré que l’enzyme TGR était inhibée par plusieurs schistosomicides déjà connus (oltipraz et tartrate d’antimoine) mais pas par le Praziquantel [10]. Plus récemment, pour la première fois chez les parasites helminthes, un criblage à haut débit automatisé de plusieurs banques de petites molécules, incluant au total plus de 70 000 composés et ciblant la voie anti-oxydante de S. mansoni, a permis d’identifier des candidats comme les phosphonic amides et les oxadiazole 2-oxides, ayant un pouvoir inhibiteur sur l’activité enzymatique de TGR et une activité toxique sur les parasites en culture [
11,
12]. L’un de ces composés, le 4-phényl-1,2,5-oxadiazole-3-carbonitrile-2-oxyde (ou furoxan) a été retenu pour être le plus actif contre les différents stades de S. mansoni, entraînant aussi la mort des vers adultes de S. japonicum et S. haematobium. La toxicité du furoxan semble être exacerbée par sa capacité à générer en présence de thiols des molécules d’oxyde nitrique (NO), qui renforcent l’état de stress oxydant du parasite. Chez les souris, l’administration de furoxan (10mg/kg par jour pendant cinq jours) est bien tolérée et induit une protection significative, que le traitement ait lieu au début ou à des périodes plus tardives de l’infection. Actif sur tous les stades du parasite, le furoxan est de toute évidence un composé leader de choix pour le développement de nouvelles drogues actives contre le schistosome et représente un grand espoir pour le traitement de la schistosomiase [12]. |
Footnotes |
1. Van der Werf MJ, de Vlas SJ, Brooker S, et al. Quantification of clinical morbidity associated with schistosome infection in sub-Saharan Africa. Acta Trop 2003; 86 : 125–39. 2. Cioli D, Pica-Mattocia L, Archer S. Antischistosomal drugs: past, present and future ? Pharmacol Ther 1995; 68 : 35–85. 3. Ismail M, Botros S, Metwally A, et al. Resistance to praziquantel: direct evidence from Schistosoma mansoni isolated from Egyptian villagers. Am J Trop Med Hyg 1999; 60 : 932–5. 4. Xiao SH, Keiser J, Chollet J, et al. The in vitro and in vivo activities of synthetic trioxolanes on major human schistosome species. Antimicrobial Agents Chemother 2007; 51 : 1440–5. 5. Dissous C, Ahier A, Khayath N. Protein tyrosine kinases as new potential targets against human schistosomiasis. Bioessays 2007; 29 : 1281–8. 6. Knobloch J, Beckmann S, Burmeister C, et al. Tyrosine kinase and cooperative TGFbeta signaling in the reproductive organs of Schistosoma mansoni. Exp Parasitol 2007; 117 : 318–36. 7. Abdulla MH, Lim KC, Sajid M. Schistosomiasis mansoni: novel chemotherapy using a cysteine protease inhibitor. Plos Med 2007; 4 : e14. 8. Alger HM, Williams DL. The disulfide redox system of Schistosoma mansoni and the importance of a multifunctional enzyme, thioredoxin glutathione reductase. Mol Biochem Parasitol 2002; 121 : 129–39. 9. Angelucci F, Miele AE, Boumis G, et al. Glutathione reductase and thioredoxin reductase at the crossroad: the structure of Schistosoma mansoni thioredoxin glutathione reductase. Proteins 2008; 72 : 936–45. 10. Kuntz AN, Davioud-Charvet E, Sayed AA, et al. Thioredoxin glutathione reductase from Schistosoma mansoni: an essential parasite enzyme and a key drug target. Plos Med 2007; 4 : e206. 11. Simeonov A, Jadhav A, Sayed AA, et al. Quantitative high-throughput screen identifies inhibitors of the Schistosoma mansoni redox cascade. Plos Neglected Trop Dis 2008; 2 : e127. 12. Sayed AA, Simeonov A, Thomas CJ, et al. Identification of oxadiazoles as new drug leads for the control of schistosomiasis. Nat Med 2008; 14 : 407–12. 13. Pierce RJ, Bertin B, Capron A. Vers la génomique du schistosome. Med Sci (Paris) 2004; 20 : 271–2. 14. Guichard C, Pedruzzi E, Fay M, Ben Mkaddem S, Coant N, Daniel F, Ogier-Denis E. Les Nox/Duox : une nouvelle famille de NADPH oxydases. Med Sci (Paris) 2006; 22 : 953–9 15. Barouki R. Stress oxydant et vieillissement. Med Sci (Paris) 2006; 22 : 266–72 |