| |
| Med Sci (Paris). 2008 August; 24(8-9): 697–699. Published online 2008 August 15. doi: 10.1051/medsci/20082489697.Révolutions dans l’approche thérapeutique du cancer du rein Rationnel moléculaire et applications cliniques Bernard Escudier* and Marine Gross-Goupil Institut Gustave Roussy, 39, avenue Camille Desmoulins, 94805, Villejuif Cedex, France MeSH keywords: Essais cliniques comme sujet, Antienzymes, Humains, Interférons, Interleukine-2, Tumeurs du rein, Protein-tyrosine kinases, Protéines recombinantes |
2006 puis 2007 auront été des années charnières révolutionnant la prise en charge du cancer du rein métastatique, longtemps considéré comme résistant aux cytotoxiques et à la radiothérapie conventionnelle, et traité par chirurgie et immunothérapie. La compréhension sur le plan moléculaire des phénomènes associés au développement des cancers du rein à cellules claires, qui représentent 70 à 75% des tumeurs rénales, ainsi que l’émergence de nouvelles thérapeutiques ciblées, ont permis le développement et la mise sur le marché de quatre molécules, remettant en question la place de l’immunothérapie, via l’IFN (interféron) et l’IL-2 (interleukine-2). |
Chronique d’une mort annoncée du traitement par l’IFN et l’IL-2 ? Il y a 10 ans, l’étude Crecy démontrait la supériorité de la combinaison IL-2 et IFN, comparée à chacune de ces molécules en monothérapie, en termes de réponse objective et de survie sans progression ; mais il n’y avait pas de bénéfice démontré sur la survie globale, et l’on observait une toxicité sévère [
1]. En parallèle, cet essai a permis la détermination de facteurs pronostiques, identifiant les patients ayant une très faible chance de réponse, dé inis par l’existence de plus d’un site métastatique, de localisations secondaires hépatiques, et d’un délai de moins d’un an entre le diagnostic de la tumeur primitive et la survenue de la rechute métastatique. Vingt ans après le début de leur emploi, l’étude PERCY Quattro, comparant 3 modalités d’administration des cytokines (IFN, IL-2, IFN+IL-2), n’a pas mis en évidence de bénéfice sur la survie, comparé à la médroxyprogestérone, chez les 492 patients traités pour cancer du rein de pronostic intermédiaire, mais en revanche, une majoration d’incidence d’évènements toxiques sérieux (40,2 à 74,8 % d’évènements toxiques de grade 3-4 pour les bras cytokines, comparé à 9,9% pour le groupe médroxyprogestérone, principalement fièvre et altération de l’état général) [
2]. L’emploi de l’association IFN+IL-2 n’est plus recommandé désormais que dans les formes de bon pronostic (bon état général, 1 seul site métastatique) permettant d’induire des réponses objectives, parfois complètes. |
Les nouvelles thérapeutiques ciblées : rationnel moléculaire et applications cliniques L’étude des formes familiales de carcinome rénal à cellules claires, survenant dans le cadre du syndrome de Von Hippel Lindau, associant tumeurs bénignes ou kystes (pancréas, surrénale…) et hémangioblastomes, glioblastomes, et phéochromocytomes selon le sous-type, a permis de décrire le gène VHL situé sur le bras court du chromosome 3 (3p25-26). Partant de cette observation, la mise en évidence de mutations du gène VHL dans 60 à 70 % des formes sporadiques de carcinome rénal à cellules claires, a permis d’appréhender l’une des étapes essentielles du développement tumoral que représente la néo-angiogenèse [
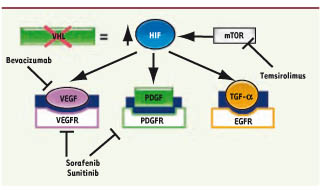
11]. Le produit du gène, la protéine VHL, est normalement impliqué dans la formation du complexe E3-ligase, à l’origine de l’ubiquitinylation du facteur HIF-1α (hypoxia-inducible factor-1α), hydroxylé en présence d’oxygène, et de sa dégradation secondaire. L’inactivation du gène VHL, nécessairement par atteinte des 2 allèles, induit un déficit secondaire en protéine VHL, responsable de l’accumulation d’HIF-1α - mimant l’augmentation survenant en réponse à l’hypoxie - lui-même stimulant la production de facteurs de croissance tels que le VEGF (vascular endothelial growth factor), le PDGF (platelet derived growth factor), et le TGF-α (transforming growth factor α, se liant à l’EGFR) favorisant angiogenèse et prolifération tumorale [
3]. Le blocage des voies de transduction du signal - voie PI3kinase/AKT et raf/MAPkinase - liées à ces récepteurs, soit par l’inhibition des tyrosines kinases (TK), soit par le blocage du ligand (VEGF) est donc apparu logiquement comme l’une des clés du traitement du cancer du rein (Figure 1).
 | Figure 1.
Interactions VHL-HIF-Facteurs de croissance, cibles et agents thérapeutiques actuels et potentiels (adapté de [ 11] avec permission). |
|
Inhibiteurs des TK et des récepteurs de cytokines Deux inhibiteurs des tyrosines kinases ont ainsi été approuvés en 2006, ainsi qu’un anticorps monoclonal dirigé contre le VEGF, en 2007.
-
Le sunitinib (Sutent®), inhibiteur de multiples cibles à activité TK (VEGF-R1 et 2, PDGF-R α et β, cKit, Flt-3), administré par voie orale, à la dose de 50 mg/jour, pendant 4 semaines sur 6, a permis, en première ligne chez 750 patients métastatiques dans le cadre d’une étude de phase III, randomisée comparé à l’IFN (9 MIU, 3 fois /semaine, voie sous-cutanée), d’obtenir un gain significatif de temps de survie sans progression (11 mois versus 5, HR = 0,42, p < 0,001), ainsi qu’un gain de taux de réponses (31 % versus 6 %, p < 0,001) [
4]. Les effets secondaires de cet agent résident principalement en une asthénie, des diarrhées, des nausées ainsi qu’une toxicité hématologique (lymphopénies, neutropénie et anémie). Ce bénéfice thérapeutique est retrouvé chez la totalité des patients, indépendamment des facteurs pronostiques et du risque évalué. Le sunitinib est logiquement devenu le traitement standard de première ligne des patients métastatique de risque faible ou intermédiaire.
-
Le sorafenib (Nexavar®), inhibiteur des activités TK des récepteurs VEGF-R2, VEGF-R3, Flt-3, c-kit et PDGF-Rβ, administré per os, à la dose de 400 mg, deux fois/jour a également démontré son efficacité dans le cadre d’une étude randomisée de phase III, comparé au placébo, après échec d’une première ligne de traitement [
5]. Le protocole a inclus 903 patients, et les résultats ont montré un allongement significatif de la survie sans progression, de 24 semaines comparé à 12 semaines (p < 0,01) dans le bras contrôle. Sur le plan de la toxicité, hypertension artérielle, toxicité cutanée, à type de syndrome mains-pieds, et diarrhées ont été décrites. Le sorafenib a donc été approuvé en traitement de seconde ligne de cancers du rein métastatiques, après échec des cytokines.
-
Le bevacizumab (Avastin®), anticorps monoclonal, dirigé contre toutes les isoformes du VEGF [
9] a logiquement trouvé également sa place dans le cadre d’une étude de phase III, randomisée en double-aveugle (AVOREN) [
6]. Les patients (649) ont été inclus dans l’un ou l’autre de deux bras de traitement : IFN (9 MIU, 3 fois/semaine) avec placébo, et IFN et bevacizumab (10 mg/kg/ 2 semaine). Le bras expérimental a permis d’obtenir un gain significatif de survie sans progression (10,2 mois versus 5,4 mois ; HR = 0,63, p < 0,0001), ainsi que de taux de réponses (30,6% versus 12,4 %, p < 0,0001). Le profil de toxicité associait hypertension artérielle, épistaxis, protéinurie, et hématurie. L’association bevacizumab et IFN représente une option thérapeutique dans le traitement de première ligne du cancer du rein métastatique, mais pose le problème, de nouveau, de la place de l’interféron dans l’arsenal thérapeutique.
|
Agents inhibiteurs de mTOR Enfin, le temsirolimus (Torisel®), appartenant à la classe des agents inhibiteurs de mTOR (mamalian target of rapamycin) kinase [
10], via le blocage de la voie PI3kinase-AKT, a confirmé son efficacité, dans le cadre d’une étude de phase III, chez 626 patients métastatiques de mauvais pronostic, en première ligne, comparé à sa combinaison avec l’IFN, ou à l’IFN seul [
7]. Administré par perfusion veineuse, à la dose de 25 mg hebdomadaire, le temsirolimus augmente de 49% la survie globale des patients par rapport à l’IFN (10,7 versus 7,3 mois, p=0,008). La toxicité associe asthénie, dyspnée, anémie et troubles métaboliques (hyperlipidémies et hyperglycémies). Le temsirolimus a donc été approuvé en 2007 pour le traitement de première ligne de cancers du rein métastatiques de pronostic défavorable. Très récemment, l’everolimus (RAD001), un autre inhibiteur de mTOR, a été rapporté, lors d’un communiqué de presse de Novartis début 2008, comme efficace après échec d’un ou de 2 inhibiteurs des TK. |
Le développement de ces nouvelles options thérapeutiques et des molécules potentielles en cours d’évaluation (axitinib, pazopanib, VEGF-trap, everolimus notamment) amène à se poser diverses questions, qui devront faire l’objet d’essais cliniques. L’objectif principal des traitements anticancéreux reste de guérir, et donc d’induire une régression complète des métastases. Peut-on espérer que l’association de ces agents permettra ces régressions complètes, cela reste une question, compte tenu en particulier des facteurs limitants de la combinaison, dont la nécessité de réduction de doses, compte tenu de la similitude des profils de toxicité (hypertension artérielle, toxicité hématologique, diarrhées, toxicité cutanée…). L’accès à quatre nouveaux médicaments dans le cancer du rein pose déjà la question de l’ordre dans lequel ils doivent être donnés, sous réserve que les traitements séquentiels aient un intérêt pour le patient. Le développement de nouveaux critères d’évaluation de l’efficacité, notamment l’imagerie fonctionnelle évaluant la vascularisation tumorale, doit permettre de mieux guider nos traitements [
8]. Surtout, une meilleure compréhension des mécanismes de résistance devrait permettre de mieux la prévenir ou la contourner. Enfin, après le développement chez les patients métastatiques, quelle est la place de ces traitements en néo-adjuvant avant néphrectomie, ou en situation adjuvante ? Plusieurs essais en cours devraient permettre d’y répondre. |
1. Negrier S, Escudier B, Lasset C, et al. Recombinant human interleukin-2, recombinant human Interferon alpha-2a, or both in metastatic renal cell carcinoma. N Engl J Med 1998; 338 : 1272–8. 2. Négrier S, Perol D, Ravaud A, et al. Medroxyprogesterone, Interferon alpha-2a, Interleukin 2 or combination of both cytokines in patients with metastatic renal carcinoma of intermediate prognosis. Results of a randomized controlled trial. Cancer 2007; 110 : 2448–57. 3. Krieg M, Haas R, Brauch H, et al. Up-regulation of hypoxia-inducible factors HIF-1α and HIF-2α under normoxic conditions in renal carcinoma cells by von Hippel-Lindau tumor suppressor gene loss of function. Oncogene 2000; 19 : 5435–43. 4. Motzer RJ, Hutson, Tomczak P, et al. Phase III randomized trial of sunitinib malate (SU11248) versus interferon-alfa as first-line systemic therapy for patients with metastatic renal cell carcinoma. N Engl J Med 2007; 356 : 115–24. 5. Escudier B, Eisen T, Stadler WM, et al. Sorafenib in advanced clear-cell renal carcinoma. N Engl J Med 2007; 356 : 125–34. 6. Escudier B, Pluzanska A, Koralewski P, et al. Bevacuzimab plus interferon alfa-2a for treatment of metastatic renal cell carcinoma: a randomized, double-blind phase III trial. Lancet 2007; 67 : 1257–64. 7. Hudes G, Carducci M, Tomczak P, et al. Temsirolimus, interferon alfa or both for advanced renal cell carcinoma. N Engl J Med 2007; 356 : 2271–81. 8. Lamuraglia M, Escudier B, Chami L, et al. To predict progression-free survival and overall survival in metastatic renal cancer treated with sorafenib : pilot study using dynamic contrast-enhanced Doppler ultra-sound. Eur J Cancer 2006; 42 : 2472–9. 9. Galaup A, Germain S. Les anticorps anti-PlGF : un nouvel outil thérapeutique anti-angiogénique ? Med Sci (Paris) 2008; 24 : 459–62. 10. Le Bacquer O, Martineau Y, Mamane Y. Quand la traduction sort de sa TORpeur. Med Sci (Paris) 2006; 22 : 514–8. 11. Kaelin WG Jr. Molecular basis of the VHL hereditary cancer syndrome. Nat Rev Cancer 2002; 2 : 673–82 |