| |
| Med Sci (Paris). 2008 August; 24(8-9): 684–686. Published online 2008 August 15. doi: 10.1051/medsci/20082489684.Sociologie des cellules épithéliales Mathieu Poujade,1 Erwan Grasland-Mongrain,1 Laurence Petitjean,1 Myriam Reffay,1 Axel Buguin,1 Benoît Ladoux,2 and Pascal Silberzan1* 1UMR 168, Institut Curie, Centre de Recherche/CNRS/Université Paris 6, 26, rue d’Ulm, 75248 Paris, France 2UMR 7057 CNRS/Université Paris 7, 75205 Paris, France MeSH keywords: Communication cellulaire, Mouvement cellulaire, Cellules épithéliales, Humains, Pseudopodes |
Dans de nombreuses situations physiologiques, des cellules initialement immobiles peuvent être amenées à migrer en réponse à une stimulation. Par exemple, un épithélium blessé va avoir tendance à se refermer pour rétablir son intégrité (et donc sa fonction). Cet effet est par ailleurs utilisé en laboratoire comme un test de motilité : à partir d’un épithélium à confluence, l’on arrache mécaniquement une partie de la monocouche et l’on observe la propension des cellules restantes à combler ce nouvel espace. Sur des petites blessures, il est fréquent d’observer un mode de fermeture dit de purse string où des câbles d’actine se développent le long du bord de la blessure nouvellement formée. Ces câbles glissent alors les uns sur les autres par l’action de moteurs moléculaires (les myosines), ce qui contracte cet anneau et ferme la blessure à la manière d’un cordon fermant une bourse [
1]. Pour des blessures de tailles plus importantes, les cellules proches des bords s’étalent et migrent activement sur la surface de manière à envahir celle-ci. Notons une différence considérable par rapport aux études portant sur la motilité de cellules individuelles : il s’agit ici d’une migration collective au cours de laquelle les cellules en mouvement maintiennent entre elles des contacts cellule-cellule [
2]. Cependant, même une situation a priori aussi simple pose un certain nombre de questions dont celle, essentielle, de la cause première de cette migration. En effet, en plus d’offrir de la surface libre aux cellules restantes (ce processus étant le plus souvent invoqué comme à l’origine de cette migration), la blessure abime les cellules du bord nouvellement formé, qui sont perméabilisées voire détruites ; de plus, le contenu intra cellulaire des cellules initialement dans la tranchée est relargué dans le milieu environnant ce qui constitue potentiellement un autre stimulus d’origine biochimique également capable d’affecter les cellules restantes. Ce test de motilité présente également des difficultés pratiques : les bords de la blessure sont irréguliers, des contacts cellule-cellule initialement présents ont nécessairement été rompus, des débris arrachés sont inévitablement présents dans la tranchée et enfin, la surface dégagée n’est plus vierge chimiquement, elle a été conditionnée par les cellules présentes avant la blessure qui y ont déposé diverses protéines. |
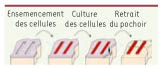
Micro-pochoirs : un test non biaisé d’analyse de la migration épithéliale Pour contourner ces difficultés et répondre à la question de l’origine de la migration collective, nous avons développé une technique originale, très simple dans son principe, faisant appel à la microfabrication : il s’agit de fabriquer des films minces ajourés dans un matériau élastique inerte à base de silicone que l’on place en contact avec la surface, de laisser pousser les cellules dans les ouvertures et, lorsqu’elles sont parvenues à confluence, de retirer ces micro-pochoirs [
3]. De cette manière, on fait apparaître des bords libres sans affecter l’intégrité des cellules (Figure 1). Nous avons alors pu observer que dans ces conditions « modèles » qui contournent les difficultés énoncées plus haut, les cellules que nous avons étudiées (des cellules MDCK, prototypiques de cellules épithéliales) migrent effectivement confirmant ainsi que la surface libre est à elle seule suffisante pour déclencher une motilité collective.
 | Figure 1.
Principe des expériences. Le retrait du pochoir déclenche la motilité des cellules (adapté de [ 3] avec permission © [2007], National Academy of Sciences, USA). |
Les avantages de la technique sont nombreux : on peut en particulier citer le fait que les bords initiaux sont parfaitement rectilignes et se prêtent donc facilement à une analyse quantitative. Ils répondent aux exigences formulées plus haut en y ajoutant une propriété : du fait de la stratégie consistant à multiplier les blessures (représentées ici par les ouvertures dans le film mince) sur le même épithélium, il s’agit d’un procédé qui permet de mener facilement des tests de motilité identiques en parallèle en plaques multipuits. Partant d’une situation initiale très bien définie (un bord parfaitement rectiligne), on peut facilement caractériser la progression moyenne de l’épithélium sur la surface. On retrouve alors un résultat déjà rapporté dans la littérature : cette progression suit une loi quadratique en temps, elle est donc accélérée. L’explication de ce comportement moyen n’est pas encore claire mais semble provenir, comme on le verra plus loin, de la superposition de plusieurs phénomènes différents. Cependant, ce comportement, si il est bien vérifié pour des bandes initialement relativement larges, cesse de l’être pour des largeurs initiales inférieures à environ 150 µm. La progression est alors ralentie et semble s’opérer à vitesse constante. On peut raisonnablement penser que si la bande est suffisamment étroite, les deux bords ne se comportent plus de manière indépendante. Pour mieux comprendre quelles cellules se déplacent dans l’épithélium et comment, nous avons étudié celui-ci au cours du temps par une technique habituellement utilisée en hydrodynamique : la PIV (Particle Image Velocimetry) qui permet d’accéder aux champs de déplacements dans l’épithélium en étudiant les corrélations entre images successives (à la différence des techniques plus traditionnelles qui suivent chaque cellule individuellement). On observe alors que les cellules ne se déplacent pas individuellement mais plutôt en groupe. La taille de ces groupes est de l’ordre de 150 µm, proche de la largeur limite pour laquelle on observe un changement de comportement dynamique pour la progression moyenne du bord. Quelle est la part de la prolifération cellulaire dans cette migration ? Il s’agit d’un point crucial puisque plusieurs modèles théoriques postulent l’activation de la prolifération en réponse à une blessure [
4]. En fait, un pointage précis de toutes les divisions dans l’épithélium montre que le taux de division reste constant au cours de l’expérience. Il aurait même tendance à décroître pour les cellules les plus proches du bord alors qu’il n’est pas affecté au centre. Ce résultat, qui met en évidence une migration active des cellules en réponse à une blessure plutôt qu’un envahissement passif dû à la prolifération, est confirmé par des expériences dans lesquelles cette dernière est inhibée par une drogue. |
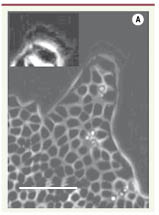
Les porte-drapeaux des migrations de cellules épithéliales Nous n’avons jusqu’ici décrit qu’un comportement moyen. En fait, la progression est très irrégulière. La ligne du bord, rectiligne au début de l’expérience devient vite tourmentée jusqu’à présenter des digitations (Figure 2). L’analyse plus précise de ces digitations fait ressortir la présence de cellules très particulières dites leaders à leur extrémité. Ces cellules sont très différentes des autres, plus grandes, très étalées, elles développent à l’avant un lamellipode large et très actif, présentant de nettes ondulations (ruffling) (Figure 3). De ce point de vue, elles présentent les propriétés caractéristiques d’un fibroblaste. Toutefois, elles maintiennent également des liaisons très fortes avec leurs voisines directes, comme l’atteste la présence de cadhérines, ce qui leur confère un caractère Janus fibroblastique-épithélial très particulier. Il est de plus intéressant de noter que ces cellules leaders sont issues de l’épithélium où elles ne présentaient aucune différence notable par rapport aux autres (elles ne viennent d’ailleurs pas nécessairement du bord initial mais ont pu y parvenir par les déplacements coopératifs discutés plus haut). Par ailleurs, lorsque deux bords opposés font la jonction, fermant ainsi la blessure, les cellules leaders redeviennent purement épithéliales, à nouveau indiscernables des autres cellules. Ce changement de phénotype, pour spectaculaire qu’il soit, est donc transitoire.
 | Figure 2.
Évolution d’une bande de cellules MDCK. A. t = 90 min. B. t = 12 h. La barre mesure 400 µm. Le temps t=0 est compté à partir du retrait du pochoir (adapté de [ 3] avec permission © (2007) National Academy of Sciences, USA). |
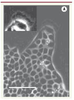 | Figure 3.
Digitation précédée par une cellule leader 18 heures après retrait du pochoir. L’image prise en contraste de phase montre clairement le lamellipode à l’avant de la cellule. Dans l’encart, le contraste a été augmenté pour permettre une meilleure visualisation. La barre mesure 100 µm (adapté de [ 3] avec permission © [2007] National Academy of Sciences, USA). |
Les facteurs de croissance sont connus pour affaiblir les liaisons cellule-cellule et stimuler la motilité et la prolifération. Lorsqu’ils sont présents à des concentrations suffisamment faibles pour maintenir les contacts entre cellules, la migration est plus rapide mais on n’observe pas de digitation à proprement parler encore que la plupart des cellules de bord développent un lamellipode limité. Même si l’intégrité de l’épithélium est préservée, on se rapproche ici de comportements plus individuels. |
Migration épithéliale collective au cours de l’angiogenèse ou de la tumorigenèse La formation de ces doigts et leur allure évoque plusieurs phénomènes liés à une migration collective par exemple dans le développement de la ligne latérale du poisson zèbre [
5] ou dans les phénomènes d’angiogenèse ou de tubulogenèse [
6]. On peut également en rapprocher nos observations des cultures tridimensionnelles de tumeurs épithéliales. Que ce soit dans des conditions modèles ou in vivo chez la souris, les modes d’invasion sont très variés depuis ceux utilisés par des cellules isolées migrant individuellement jusqu’à ceux des groupes de cellules se déplaçant collectivement. De tels groupes échappent à la description par le modèle couramment admis de la transition épithéliale-mésenchymateuse [
7] dans la mesure où ils maintiennent des contacts cellule-cellule. Parmi ces exemples de migration collective à partir de tumeurs, des digitations formées par des cellules leaders ont été identifiées avec une fonction supplémentaire de protéolyse du collagène dans lequel migrent ces structures [
8]. La ressemblance frappante avec les digitations observées dans nos expériences, si elle se confirmait, fournirait un bon modèle pour l’étude de ces structures et pourrait ainsi ouvrir des pistes très riches. La prochaine étape sera de mieux comprendre l’apparition et l’évolution des doigts et en particulier d’envisager des mécanismes dans lesquels c’est le leader qui « tire » sur l’épithélium, ce qui demanderait des forces importantes et d’autres où c’est l’ensemble des cellules du doigt qui migre activement, « poussant » une cellule de tête qui apparaitrait ainsi comme leader et qui pourrait avoir une autre fonction. Il s’agit d’une question fondamentale en particulier dans le contexte esquissé plus haut, à laquelle il est difficile de répondre simplement. Des expériences de mesures de forces [
9] ou de photoablation devraient cependant permettre de trancher. |
1. Jacinto A, Martinez-Arias A, Martin P. Mechanisms of epithelial fusion and repair. Nat Cell Biol 2001; 3 : E117–23. 2. Farooqui R, Fenteany G. Multiple rows of cells behind an epithelial wound edge extend cryptic lamellipodia to collectively drive cell-sheet movement. J Cell Sci 2005; 118 : 51–63. 3. Poujade M, Grasland-Mongrain E, Hertzog A, et al. Collective migration of an epithelial monolayer in response to a model wound. Proc Natl Acad Sci USA 2007; 104 : 15988–93. 4. Maini PK. Peyresq lecture: notes on nonlinear phenomena. In : Montaldi J, Kaiser R, eds. New York : World Scientific, 2000 : 201–37. 5. Haas P, Gilmour D. Chemokine signaling mediates self-organizing tissue migration in the zebrafish lateral line. Dev Cell 2006; 10 : 673–80. 6. Hogan BL, Kolodziej PA. Organogenesis: molecular mechanisms of tubulogenesis. Nat Rev Genet 2002; 3 : 513–23. 7. Thiery JP. Epithelial-mesenchymal transitions in tumour progression. Nat Rev Cancer 2002; 2 : 442–54. 8. Wolf K, Wu YI, Liu Y, et al. Multi-step pericellular proteolysis controls the transition from individual to collective cancer cell invasion. Nat Cell Biol 2007;9 : 893–904. 9. Buguin A, Chavrier P, Ladoux B, du Roure O, Saez A, Silberzan P. Un substrat de micropiliers pour étudier la migration cellulaire. Med Sci (Paris) 2005; 21 : 765–7. |