| |
| Med Sci (Paris). 2008 June; 24(6-7): 579–580. Published online 2008 June 15. doi: 10.1051/medsci/20082467579.VEGF111 : Dr Jekyll et Mr Hyde ? Charles A. Lambert,* Pierre Mineur,* and Betty V. Nusgens* Laboratoire de Biologie des Tissus Conjonctifs, GIGA-Cancer, Tour de Pathologie B23/3, Université de Liège, 4000 Liège, Belgique MeSH keywords: Humains, Tumeurs, Néovascularisation pathologique, Néovascularisation physiologique, Fragments peptidiques, Facteur de croissance endothéliale vasculaire de type A |
Le VEGF (vascular endothelial growth factor) est l’un des principaux facteurs contrôlant le développement et le maintien de l’arbre vasculaire chez l’homme. Des thérapies pro-angiogènes utilisant le VEGF sont actuellement en phase d’essais précliniques et cliniques pour le traitement de pathologies très diverses [
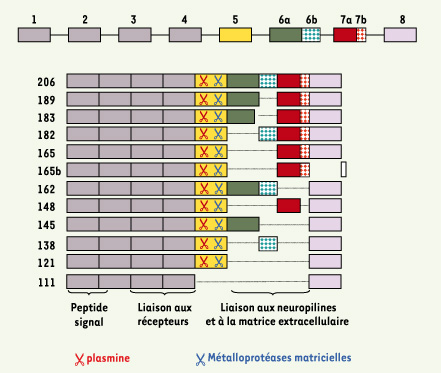
1]. C’est le cas de maladies ischémiques, pour lesquelles le bénéfice d’une revascularisation des tissus est évident, mais également d’autres pathologies associées à un déficit en VEGF comme l’éclampsie et la sclérose latérale amyotrophique. Le gène codant pour le VEGF contient 8 exons (Figure 1). Jusqu’à récemment, tous les variants décrits étaient codés par les exons 1 à 5, et différaient dans l’épissage (voir Encadré) précis des exons 6 à 8. Les exons 1 et 2 codent pour le peptide signal, impliqué dans la sécrétion de la protéine dans le milieu extracellulaire, les exons 3 et 4 pour les sites de liaison aux récepteurs et pour un site de glycosylation, et les exons 6 et 7 pour les séquences de liaison à la matrice extracellulaire et aux neuropilines. Ainsi les variants 206 et 189 sont peu biodisponibles en raison de leur liaison élevée à la matrice extracellulaire, alors que le variant 121 est actif et librement diffusible. Le variant 165 a des propriétés de liaison intermédiaires. Un variant utilisant un exon alternatif 8b présente des propriétés anti-angiogènes. L’exon 5 code pour les sites principaux de clivage par la plasmine et les métalloprotéases matricielles ([
2,
3] et Iruela-Arispe, communication personnelle).
 | Figure 1.
Variants du VEGF. Description de l’utilisation des exons dans les différents variants du VEGF, et de la fonction des séquences qu’ils codent. Le numéro d’identification des variants correspond au nombre d’acides aminés contenus dans la molécule mature après excision du peptide signal, et la lettre b indique l’utilisation de l’exon 8b. Les exons ne sont pas dessinés à l’échelle. |
|
Nous avons récemment cloné un nouveau variant d’épissage alternatif du VEGF, codé par les exons 1 à 4 et 8a (VEGF111, DQ229900) [
4]. C’est le seul exemple connu de VEGF humain ne contenant pas les séquences codées par l’exon 5. L’exclusion de cette séquence de l’ARN messager ne modifie pas le cadre de lecture des séquences situées en aval. Ce nouveau variant est exprimé uniquement dans les cellules traitées par des agents infligeant des dommages à l’ADN, tels que le rayonnement ultraviolet et des agents chimiothérapeutiques. Il n’a été détecté dans aucun des tissus sains testés - suggérant qu’il n’est pas indispensable à l’organisme - ni dans une série de tissus cancéreux humains. Sur la base de sa séquence, nous avons prédit que le VEGF111 est sécrété, biologiquement actif et résistant à la protéolyse. Ces hypothèses se sont révélées exactes. D’une part, le VEGF111 exprimé par recombinaison dans des cellules humaines en culture in vitro est sécrété dans le milieu de culture. D’autre part il active ses récepteurs, stimule la multiplication de cellules endothéliales in vitro et induit la formation de structures pseudo-capillaires dans des corps embryonnaires formés à partir de cellules souches embryonnaires de souris. Enfin il est résistant à la dégradation par la plasmine et les fluides biologiques riches en protéases comme les exsudats d’ulcères. Les cellules humaines exprimant le VEGF165, le VEGF121 ou le VEGF111 par recombinaison ont été injectées à des souris immunodéficientes. Si les cellules exprimant le VEGF165, et dans une moindre mesure celles exprimant le VEGF121, ont produit des tumeurs vascularisées, les cellules exprimant le VEGF111 produisent des tumeurs peu vascularisées, mais dont le tissu environnant est irrigué par un réseau dense de capillaires. |
En cas de coupure, composer le 111 Le VEGF111 pourrait remplacer avantageusement les autres variants dans le traitement de diverses pathologies. C’est particulièrement vrai pour les ulcères veineux, l’infarctus du myocarde et l’accident vasculaire cérébral. Dans le premier cas, l’environnement de la plaie est riche en plasmine et en métalloprotéases matricielles et dégrade le VEGF165 [
5]. Un VEGF165 muté au site de clivage par la plasmine accroît la stabilité des structures vasculaires durant la cicatrisation des plaies chroniques chez les souris diabétiques [
6]. Sa résistance au clivage par des exsudats d’ulcères fait du VEGF111 une alternative séduisante, potentiellement plus efficace que le VEGF165 muté en raison de l’élimination du site de clivage par les métalloprotéases matricielles. Cette hypothèse est en cours d’étude dans notre laboratoire. Dans les deux autres cas, celui des maladies ischémiques, nombre de patients arrivant dans les services d’urgences reçoivent une injection d’activateur tissulaire du plasminogène, afin de transformer le plasminogène en plasmine capable de lyser le thrombus responsable de l’occlusion artérielle causative de la pathologie. Des travaux préliminaires suggèrent que le VEGF111, et dans une moindre mesure le VEGF165, réduisent le déficit de perfusion cardiaque consécutif à la ligature de l’artère coronaire gauche descendante, l’hypertrophie réactionnelle à l’ischémie et le remodelage du ventricule gauche chez la souris (Marie Delgaudine, Pierre Mineur et Charles Lambert). L’avantage du VEGF111 par rapport au VEGF165 est faible, mais pourrait devenir significatif si ce dernier est dégradé lors de l’injection d’activateur du plasminogène aux animaux.

À l’inverse, l’utilisation de thérapies anti-angiogènes pour combattre le cancer a été proposée dès 1971 par Judah Folkman (1933-2008) [
7]. Quelque trente ans plus tard, un anticorps humanisé capable de bloquer le VEGF (bevacizumab, Avastin®, Genentech, États-Unis) est le premier agent anti-angiogène accepté aux États-Unis par la Food and Drug Administration pour le traitement de cancers colorectaux en adjonction à la chimiothérapie [
8]. Certains effets secondaires, notamment des saignements, sont cependant à déplorer. L’expression de VEGF111 par des cellules tumorales humaines transplantées chez la souris, induite par l’injection intra-tumorale de camptothécine [4], suggère qu’il pourrait être exprimé par des patients traités par chimiothérapie. Si cette hypothèse est avérée, le VEGF111 pourrait progressivement devenir la forme majeure de VEGF en raison de la protéolyse souvent élevée dans l’environnement tumoral. Comme il ne semble pas indispensable à l’organisme, une thérapie ciblant spécifiquement le VEGF111 pourrait diminuer efficacement l’angiogenèse tumorale sans avoir les effets secondaires des traitements anti-VEGF actuels. Plusieurs stratégies sont envisageables : (1) inhibition de la liaison du VEGF111 aux récepteurs par des anticorps ou des aptamères spécifiques ; (2) inhibition spécifique de l’expression de VEGF111 par ARN interférentiel ; (3) inhibition du processus d’épissage impliqué dans la génération du VEGF111 ; La description de molécules capables de corriger l’épissage aberrant de certains gènes sans entraver l’épissage constitutif [8,
9] laisse entrevoir de nouvelles solutions thérapeutiques. |
1. Buysschaert I, Carmeliet P, Dewerchin M. Clinical and fundamental aspects of angiogenesis and anti-angiogenesis. Acta Clin Belg 2007; 62 : 162–9. 2. Keyt BA, Berleau LT, Nguyen HV, et al. The carboxyl-terminal domain (111-165) of vascular endothelial growth factor is critical for its mitogenic potency. J Biol Chem 1996; 271 : 7788–95. 3. Lee S, Jilani SM, Nikolova GV, et al. Processing of VEGF-A by matrix metalloproteinases regulates bioavailability and vascular patterning in tumors. J Cell Biol 2005; 169 : 681–91. 4. Mineur P, Colige AC, Deroanne CF, et al. Newly identified biologically active and proteolysis-resistant VEGF-A isoform VEGF111 is induced by genotoxic agents. J Cell Biol 2007; 179 : 1261–73. 5. Lauer G, Sollberg S, Cole M, et al. Expression and proteolysis of vascular endothelial growth factor is increased in chronic wounds. J Invest Dermatol 2000; 115 : 12–8. 6. Roth D, Piekarek M, Paulsson M, et al. Plasmin modulates vascular endothelial growth factor-A-mediated angiogenesis during wound repair. Am J Pathol 2006; 168 : 670–84. 7. Folkman J. Tumor angiogenesis: therapeutic implications. N Engl J Med 1971; 285 : 1182–6. 8. Corcos L, Solier S. Épissage alternatif, pathologie et thérapeutique moléculaire. Med Sci (Paris) 2005; 21 : 253–60. 9. Soret J, Gabut M, Tazi J. SR proteins as potential targets for therapy. Prog Mol Subcell Biol 2006; 44 : 65–87. |