| |
| Med Sci (Paris). 2008 June; 24(6-7): 570–571. Published online 2008 June 15. doi: 10.1051/medsci/20082467570.Carcinome à cellules de Merkel Première implication connue d’un polyomavirus dans la genèse d’un cancer humain Jean Kanitakis* Clinique Dermatologique, Hôpital Edouard Herriot, Pavillon R, 69437 Lyon Cedex 03, France MeSH keywords: Carcinome à cellules de Merkel, Humains, Infections à polyomavirus, Tumeurs cutanées |
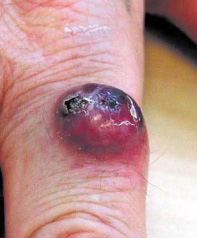
Carcinome à cellules de Merckel : caractéristiques cliniques Le carcinome à cellules de Merkel (CCM), connu également sous les noms de carcinome trabéculaire, tumeur à cellules de Merkel, carcinome neuroendocrine cutané primitif et APUDome cutané, est une tumeur neuroendocrine cutanée primitive maligne rare, initialement décrite par Toker en 1972. Il s’agit d’une tumeur agressive dont la mortalité peut atteindre 33 %. Cliniquement, le CCM se présente comme une tumeur cutanée rouge-brun ou violacée, asymptomatique, de croissance rapide, prédominant sur des zones photoexposées (visage, membres) de sujets âgés de plus de 50 ans dans 90 % des cas [
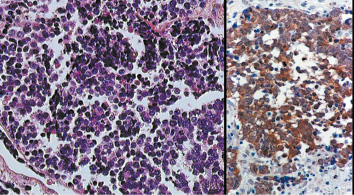
1] (Figure 1). Histologiquement elle est constituée de cellules basophiles, monomorphes, arrondies, à noyaux volumineux, hyperchromatiques, souvent mitotiques (Figure 2A). Ces cellules expriment un phénotype immunohistochimique particulier (kératine/énolase neuronale spécifique/chromogranine/synaptophysine/CD56+) (Figure 2B) qui souligne leur double différenciation épithéliale et neuroendocrine, et permet de différencier le CCM d’autres tumeurs cutanées de présentation histologique similaire. L’origine cellulaire du CCM n’est pas connue avec certitude, mais le candidat le plus probable est la cellule de Merkel, cellule neuroendocrine jouant probablement un rôle de mécanorécepteur, présente en faible nombre dans la couche basale de l’épiderme et des follicules pileux. Les nombreuses similitudes immunohistochimiques et ultrastructurales entre la cellule de Merkel et les cellules du CCM sont très en faveur de cette filiation histogénétique.
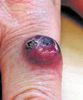 | Figure 1.
Carcinome à cellules de Merkel : tumeur violacée nodulaire de l’index d’une femme âgée.
|
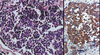 | Figure 2.
Aspect histologique du carcinome à cellules de Merkel. A. Prolifération monomorphe de cellules rondes basophiles (coloration hématoxyline-éosine-saffran). B. Expression cytoplasmique d’énolase neuronale spécifique dans un carcinome à cellules de Merkel (avidine-biotine-peroxydase). |
L’incidence exacte du CCM est mal connue ; aux États-Unis, elle est estimée à 0,34 cas/100 000 habitants [
2], et il semble qu’elle ait triplé entre 1986 et 2001 [
3]. L’étiopathogénie du CCM est longtemps restée inconnue. Cette tumeur semble favorisée par les rayons ultraviolets (UV), comme le suggère sa prédominance sur des zones photoexposées, l’association à d’autres cancers kératinocytaires cutanés (dont l’induction par les UV est bien documentée), l’apparition après PUVAthérapie1,, l’incidence élevée au sein d’une même ethnie sur les zones à plus fort ensoleillement [3], ainsi que l’existence d’anomalies génétiques partagées avec les carcinomes spinocellulaires, comme les mutations induites par les rayons UVB sur les gènes p53 et H-ras [
4]. Le déficit immunitaire semble constituer un facteur prédisposant important, comme en témoigne l’incidence élevée du CCM au cours d’états d’immunodépression iatrogène (traitements immunosuppresseurs pour des maladies auto-immunes ou allogreffes d’organe) [
5] ou non-iatrogène (Sida, leucémies/lymphomes). Dans une série de 420 cas de CCM, 14,5 % des patients recevaient un traitement immunosuppresseur [
6]. Le rôle favorisant de l’immunodépression sur le CCM est également suggéré par la régression de la tumeur après réduction ou arrêt du traitement immunosuppresseur [
7]. Le rôle favorisant de l’immunodépression sur l’apparition du CCM a fait suspecter l’intervention d’un virus oncogène, à l’instar du virus HHV-8 dans la maladie de Kaposi, du virus EBV dans certains lymphomes et probablement aussi des virus HPV dans les carcinomes épidermoïdes cutanés. Cette possibilité a motivé la recherche des virus HPV et EBV dans le CCM ; cependant ces recherches se sont révélées négatives [
8,
9]. |
Polyomavirus et carcinome de Merkel Très récemment, un nouveau polyomavirus a été détecté par une technique originale (soustraction digitale du transcriptome) dans 8/10 cas de CCM. Ce virus, appelé MCV ou MCPyV (Merkel cell virus ou Merkel cell polyoma virus) a été défini par deux transcrits (DTS 1 & 2) et contient un ADN génomique de 5 387 pb. Contrairement à sa fréquence élevée dans les CCM, le MCV n’a été détecté que dans cinq biopsies gastrointestinales, représentant 8 % du groupe de tissus contrôles (dont la peau), et dans 16 % de biopsies cutanées provenant de patients immunocompétents ou immunodéprimés sans CCM. Dans six cas (sur huit) de CCM où le MCV a été détecté, il était intégré dans le génome des cellules tumorales avant leur expansion clonale, ce qui suggère qu’il contribue au développement de la tumeur [
10]. Rappelons que les polyomavirus sont des virus de petite taille (environ 5 200 pb) à ADN double brin qui code pour une oncoprotéine T (T = tumeur) à épissage alternatif variable. Ils se distinguent génétiquement en trois groupes : (1) les polyomavirus aviaires : (2) les polyomavirus des mammifères proches du polyomavirus murin (MuPyV) ; (3) les polyomavirus des mammifères proches du virus simien SV40. Les quatre polyomavirus humains connus jusqu’à présent (BKV, JCV, KIV et WUV) appartiennent au sous-groupe du SV40, comme d’ailleurs le MCV nouvellement découvert. Le potentiel oncogène des polyomavirus était connu chez certains mammifères, dont la souris, et était suspecté chez l’homme mais pas encore démontré. Ainsi le CCM vient s’ajouter au groupe des tumeurs humaines viro-induites, auquel appartiennent également la maladie de Kaposi, due au virus HHV-8 (découvert en 1994 par Chang et Moore, les mêmes chercheurs qui viennent de découvrir le MCV), certains lymphomes dus au virus EBV et les carcinomes épidermoïdes (cutanés) associés aux virus HPV. L’effet tumorigène du MCV pourrait s’exercer par l’expression de l’antigène T, une mutagenèse insertionnelle, ou les deux mécanismes à la fois. La découverte de l’intégration clonale du virus MCV dans le CCM représente la première implication connue d’un polyomavirus dans la genèse d’un cancer chez l’homme, et constitue un progrès fondamental dans la compréhension de l’étiopathogénie de cette tumeur, expliquant ses rapports directs avec les états de déficit immunitaire. Il est permis d’espérer que la meilleure connaissance de la biologie du CCM conduira à une prise en charge préventive et surtout thérapeutique plus efficace de cette tumeur agressive. |
Footnotes |
1. Heath M, Jaimes N, Lemos B, et al. Clinical characteristics of Merkel cell carcinoma at diagnosis in 195 patients: the AEIOU features. J Am Acad Dermatol 2008; 58 : 375–81. 2. Agelli M, Clegg LX. Epidemiology of Merkel cell carcinoma in the United States. J Am Acad Dermatol 2003; 49 : 832–41. 3. Hodgson N. Merkel cell carcinoma: changing incidence trends. J Surg Oncol 2005; 89 : 1–4. 4. Popp S, Waltering S, Herbst C, et al. UV–B-type mutations and chromosomal imbalances indicate common pathways for the development of Merkel and skin squamous cell carcinomas. Int J Cancer 2002; 99 : 352–60. 5. Kanitakis J, Euvrard S, Chouvet B, et al. Merkel cell carcinoma in renal transplant recipients. Report of two new cases with unusual histological features and literature review. J Cutan Pathol 2006; 33 : 686–94. 6. Medina-Franco H, Urist M, Fiveash J, et al. Multimodality treatment of Merkel cell carcinoma: case series and literature review of 24 cases. Ann Surg Oncol 2001; 8 : 204–8. 7. Muirhead R, Ritchie D. Partial regression of Merkel cell carcinoma in response to withdrawal of azathioprine in an immunosuppression-induced case of metastatic Merkel cell carcinoma. Clin Oncol 2007; 19 : 96. 8. Kanitakis J, Joly MO, Chouvet B, et al. Merkel cell carcinomas in immunocompetent and organ-transplant recipients do not harbor HPV. Eur J Dermatol 2006; 16 : 445–6. 9. Shaw M, Warren S, Groben P, Gulley M. No evidence of Epstein-Barr virus in Merkel cell carcinoma. J Cutan Pathol 2006; 33 : 624–8. 10. Feng H, Shuda M, Chang Y, Moore P. Clonal integration of a polyomavirus in human Merkel cell carcinoma. Science 2008; 319 : 1096–100. |