| |
| Med Sci (Paris). 2008 June; 24(6-7): 564–566. Published online 2008 June 15. doi: 10.1051/medsci/20082467564.Rôle inattendu de l’arginine vasopressine comme inhibiteur de la réponse immunitaire Cécilia Chassin* and Alain Vandewalle Inserm U773, Centre de Recherche Biomédicale Bichat-Beaujon (CRB3), Université Paris 7-Denis Diderot, Faculté de Médecine Xavier Bichat, BP 416, 16, rue Henri Huchard, 75870 Paris Cedex 18, France MeSH keywords: Arginine vasopressine, Desmopressine, Infections à Escherichia coli, Humains, Immunité innée, Maladies du rein |
La réponse inflammatoire des cellules du tubule collecteur rénal Les infections du tractus urinaire et les pyélonéphrites, principalement celles qui sont dues aux Escherichia coli uropathogènes, sont parmi les causes d’infections bactériennes les plus fréquemment rencontrées. Le récepteur Toll-like 4 (TLR4), qui reconnaît le lipopolysaccharide (LPS) des bactéries à Gram-négatif, joue un rôle central dans l’initiation de la réponse inflammatoire par les cellules du tubule collecteur (TC) rénal, cibles privilégiées des infections à E. coli [
1,
2]. Ces cellules jouent un rôle clé dans le contrôle de la réabsorption hydrique et sodée par différentes hormones. Parmi elles, l’arginine vasopressine (AVP) se lie aux récepteurs V2 (RV2) pour induire une augmentation de l’AMPc et une stimulation de la protéine kinase A (PKA), conduisant à une augmentation de la perméabilité hydrique des cellules du tubule collecteur. L’AVP induit aussi une activation du canal épithélial sodique (ENaC) et du canal chlorure CFTR (cystic fibrosis transmembrane conductance regulator) sensible à l’AMPc [
3]. Des études antérieures ont montré qu’une augmentation de l’AMPc inhibe l’expression de molécules d’adhésion et de signalisation induite lors d’une stimulation par le TNFα, l’IL-1β ou le LPS [
4,
5]. Ces résultats ont suscité l’hypothèse d’un rôle de l’AVP, qui stimule l’AMPc des cellules du tubule collecteur, dans la modulation de la réponse inflammatoire induite par les bactéries uropathogènes et dans la modification de la clairance bactérienne rénale lors des infections du tractus urinaire. |
Un agoniste des récepteurs de l’AVP inhibe la réponse inflammatoire déclenchée par E. coli
Nous avons étudié les effets de la deamino-8-D-arginine vasopressine (dDAVP), un pur agoniste RV2, sur la réponse inflammatoire induite par le LPS dans la lignée mpkCCDcl4 de cellules de tubule collecteur et dans un modèle d’infection du tractus urinaire chez la souris [
6]. Nous avons fait plusieurs observations : (1) la dDAVP inhibe la réponse inflammatoire induite par le LPS via un mécanisme de déphosphorylation faisant intervenir la sérine/thréonine protéine phosphatase 2A (PP2A) et CFTR ; (2) la dDAVP favorise la colonisation bactérienne par les E. coli uropathogènes dans le rein en inhibant la réponse inflammatoire déclenchée par les cellules du tubule collecteur rénal. Ces résultats ont permis d’identifier une nouvelle voie de régulation impliquant la dDAVP, CFTR et la PP2A dans le contrôle de la réponse immunitaire innée induite par les E. coli uropathogènes. |
Mécanismes d’action de la dDAVP La dDAVP inhibe l’activation cellulaire induite par le LPS Les expériences de co-incubation des cellules mpkCCD cl4 avec du LPS et de la dDAVP ont montré que cette dernière inhibe de manière dose-dépendante la dégradation de IκB-α, la phosphorylation et l’activation du facteur de transcription NF-κB et la sécrétion de cytokines pro-inflammatoires (Figure 1). Des études antérieures ont montré que la dDAVP active la PP2A dans les cellules du tubule collecteur rénal [
7]. La PP2A, qui est couplée au canal chlorure CFTR [
8] est, de par son activité phosphatase, impliquée dans la régulation de nombreuses voies de signalisation [
9]. Il est apparu que des inhibiteurs de la PP2A (calyculine A et acide okadaïque) antagonisent l’action inhibitrice de la dDAVP sur la réponse inflammatoire. Le fait marquant est que des inhibiteurs de CFTR (tel que CFTR inh-172, l’inhibiteur le plus spécifique de CFTR) ou l’invalidation de CFTR, antagonisent l’action inhibitrice de la dDAVP sur l’activation cellulaire induite par le LPS. Ces résultats ont permis de démontrer que la dDAVP inhibe la réponse inflammatoire des cellules du tubule collecteur induite par le LPS par un mécanisme faisant intervenir la PP2A et un canal CFTR fonctionnel.
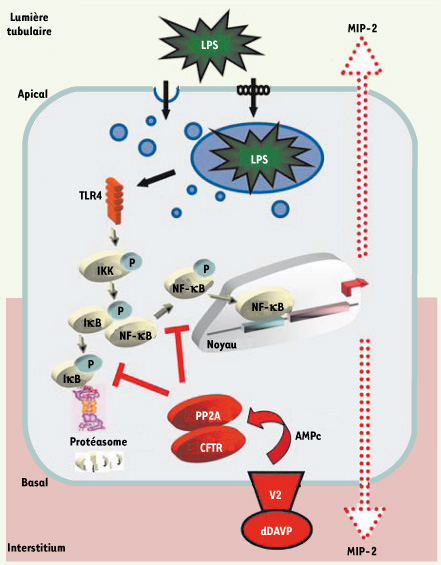
 | Figure 1.
Mécanisme d’inhibition par la dDAVP de la réponse inflammatoire dépendante de TLR4 dans les cellules du tubule collecteur rénal. La reconnaissance du LPS des E. coli uropathogènes par TLR4 exprimé dans les cellules du tube collecteur induit une cascade de signalisation responsable de la dégradation de IκB dans le protéasome et de la translocation nucléaire du facteur de transcription NF-κB conduisant à la sécrétion bidirectionnelle de cytokines, tel que MIP-2. La dDAVP, dont la production est augmentée dans les états de déshydratation, se fixe à son récepteur V2 présent dans les membranes basolatérales de cellules du tube collecteur. L’activation de la protéine phosphatase 2A (PP2A) couplée au canal chlorure CFTR va inhiber la dégradation d’IκB et la translocation de NF-κB, ayant pour effet de diminuer la production de médiateurs de l’inflammation. |
La dDAVP inhibe la réponse immunitaire dépendante de TLR4 Afin de tester si ce mécanisme inhibiteur de la dDVAP peut intervenir in vivo, les effets de la dDAVP ont été analysés chez la souris dans un modèle expérimental d’infection du tractus urinaire réalisé par inoculation dans la vessie (par voie transurétrale) des E. coli uropathogènes [ 1] (Figure 2). Des minipompes, délivrant de la dDAVP en continu, ont été insérées sous la peau de souris sauvages ( Lpsn
) et de souris déficientes en TLR4 ( Lpsd
), qui ont été ensuite inoculées avec une souche d’ E. coli uropathogènes. L’administration chronique de dDAVP à des souris sauvages a induit une diminution significative de l’expression des ARNm des médiateurs pro-inflammatoires, de la sécrétion de cytokines pro-inflammatoires ainsi que de l’influx de polynucléaires neutrophiles (PN), et une augmentation concomitante de la charge bactérienne intrarénale par rapport aux souris non traitées. En revanche, l’infusion de dDAVP n’a eu aucun effet sur les souris déficientes en TLR4, démontrant que l’action inhibitrice de la dDAVP agit spécifiquement sur la voie de signalisation de TLR4 [
11,
12].
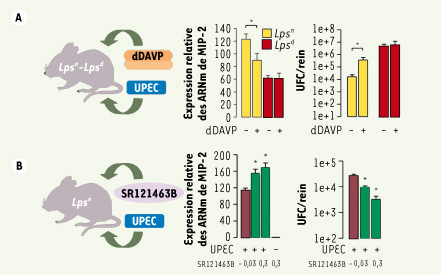
 | Figure 2.
Mécanismes d’action de la dDAVP. La dDAVP inhibe la réponse inflammatoire dépendante de TLR4 induite par les E. coli uropathogènes (UPEC) et favorise la colonisation des reins dans un modèle d’infection ascendante du tractus urinaire chez la souris. A. Des souris normales (Lpsn
) ou déficientes en TLR4 (Lpsd
) ont été inoculées par voie transurétrale avec des UPEC (108 bactéries) 48 heures après l’implantation sous-cutanée de minipompes osmotiques délivrant de la dDAVP en continu (1 ng/µl/h). Vingt-quatre heures après l’infection, les souris ont été sacrifiées et les analyses effectuées sur les reins ont montré une diminution de l’expression des ARNm des cytokines pro-inflammatoires comme MIP-2 (macrophage inhibitory protein), et une augmentation de la charge bactérienne dans les reins [exprimée en nombre d’unités formant colonie (UFC) par rein] des souris Lpsn
, mais pas des souris Lpsd
, démontrant ainsi que la dDAVP inhibe la réponse inflammatoire dépendante de TLR4. B.
A contrario, les analyses réalisées sur des reins de souris Lpsn
prétraitées avec un antagoniste du récepteur de la dDAVP, le SR121463B (0,03 ou 0,3 mg/kg), puis inoculées avec des UPEC, ont montré une augmentation de l’expression des ARNm de MIP-2 et une dimunition significative de la charge bactérienne (p < 0,05 entre les groupes). |
Nous avons ensuite testé si le blocage in vivo du RV2 pouvait prévenir l’inhibition qu’exerce la dDAVP sur la réponse inflammatoire induite par les bactéries. À l’inverse des effets qu’entraîne l’administration de dDAVP, un prétraitement - avant leur infection avec une souche d’E. coli uropathogènes - des souris sauvages avec le SR121463B, un antagoniste du RV2 appartenant à la famille des Vaptans et préconisé dans le traitement des hyponatrémies réfractaires, a induit l’augmentation de l’expression des ARNm de médiateurs pro-inflammatoires, de la sécrétion des cytokines et de l’influx de PN, et une diminution drastique de la charge bactérienne par rapport à des souris infectées non traitées par le SR121463B. |
L’ensemble de nos résultats montre que l’hormone antidiurétique, qui agit sur les cellules du tube collecteur rénal, la cible des E. coli uropathogènes, est également un puissant modulateur négatif de la réponse inflammatoire lors des infections du tractus urinaire. Cette étude a permis d’expliquer comment, dans ces infections, la déshydratation, outre le fait qu’elle diminue le flux urinaire, inhibe la réponse la réponse inflammatoire via l’AVP favorisant ainsi l’infection bactérienne [
10]. Des études complémentaires seront nécessaires afin d’envisager l’utilisation des Vaptans comme traitement complémentaire dans les infections du tractus urinaire récurrentes et les pyélonéphrites réfractaires résistantes aux antibiotiques. |
1. Chassin C, Goujon JM, Darche S, et al. Renal collecting duct epithelial cells react to pyelonephritis-associated Escherichia coli by activating distinct TLR4-dependent and -independent inflammatory pathways. J Immunol 2006; 177 : 4773–84. 2. Chassin C, Goujon JM, Le Bouguénec C, et al. Une nouvelle fonction pour les cellules intercalaires du tubule collecteur rénal : la lutte contre les Escherichia coli uropathogènes. Med Sci (Paris) 2007; 23 : 32–4. 3. Bens M, Van Huyen JP, Cluzeaud F, et al. CFTR disruption impairs cAMP-dependent Cl- secretion in primary cultures of mouse cortical collecting ducts. Am J Physiol Renal Physiol 2001; 281 : F434–42. 4. Panettieri RA Jr, Lazaar AL, Puré E, et al. Activation of cAMP-dependent pathways in human airway smooth muscle cells inhibits TNF-alpha-induced ICAM-1 and VCAM-1 expression and T lymphocyte adhesion. J Immunol 1995; 154 : 2358–65. 5. Aronoff DM, Canetti C, Serezani CH, et al. Cutting edge: macrophage inhibition by cyclic AMP (cAMP): differential roles of protein kinase A and exchange protein directly activated by cAMP-1. J Immunol 2005; 174 : 595–9. 6. Chassin C, Hornef MW, Bens M, et al. Hormonal control of the renal immune response and antibacterial host defense by arginine vasopressin. J Exp Med 2007; 204 : 2837–52. 7. Blot-Chabaud M, Coutry N, Laplace M, et al. Role of protein phosphatase in the regulation of Na+-K+-ATPase by vasopressin in the cortical collecting duct. J Membr Biol 1996; 153 : 233–9. 8. Thelin WR, Kesimer M, Tarran R, et al. The cystic fibrosis transmembrane conductance regulator is regulated by a direct interaction with the protein phosphatase 2A. J Biol Chem 2005; 280 : 41512–20. 9. Mumby MC, Walter G. Protein serine/threonine phosphatases: structure, regulation, and functions in cell growth. Physiol Rev 1993; 73 : 673–99. 10. Knepper MA, Star RA. Vasopressin: friend or foe ? Nat Med 2008; 14 : 14–6. 11. Delneste Y, Beauvillain C, Jeannin P. Immunité naturelle : structure et fonction des Toll-like receptors. Med Sci (Paris) 2007; 23 : 67–73. 12. Musette P, Auquit Auckbur I, Begon E. Immunité innée : expression cutanée et fonction des récepteurs Toll-like. Med Sci (Paris) 2006; 22 : 149–52. |