| |
| Med Sci (Paris). 2008 May; 24(5): 521–524. Published online 2008 May 15. doi: 10.1051/medsci/2008245521.IKDC Un nouveau costume pour les cellules NK activées Laure Coulombel1* and Armand Bensussan2* 1Médecine/Sciences et Inserm U602, Hôpital Paul Brousse, 94817 Villejuif Cedex, France 2Inserm U841, Université Paris XII, Faculté de Médecine de Créteil, 8, rue du Général Sarrail, 94010 Créteil, France |
Cellules dendritiques et natural killer : des phénotypes complexes La dissection du compartiment des cellules dites « nulles », CD3-CD4-CD8- c’est-à-dire dépourvues des molécules cardinales permettant de les classer comme lymphocyte T ou B, et qui comprend notamment les cellules natural killer (NK) [
1] et les cellules dendritiques (DC) [
2,
3], se heurte à plusieurs difficultés : l’absence de spécificité des marqueurs de surface utilisés pour les définir, l’appréciation souvent arbitraire de l’intensité d’expression de ces marqueurs, la variabilité d’expression de certains marqueurs selon les souches de souris, enfin, leur variabilité d’expression en fonction du degré d’activation ou de maturation cellulaire, imposant d’examiner les différents états fonctionnels des cellules dans une même population et de confronter l’analyse de multiples antigènes à l’analyse fonctionnelle. Parmi ces cellules « nulles », les cellules NK expriment NK1.1 (un alloantigène absent chez certaines souches de souris) et CD11c, mais classiquement n’expriment pas les molécules CMH-II, et, chez la souris n’exercent pas de fonction de cellule présentatrice d’antigène. Elles agissent spontanément en éliminant les cellules infectées ou tumorales par cytotoxicité soit directe soit dépendante d’anticorps et se comportent aussi comme de réels lymphocytes régulateurs en sécrétant des cytokines comme l’IFNγ (interféron γ) après activation. Les cellules dendritiques (DC) se partagent en trois branches : (1) les cellules de Langerhans épidermiques [
4] ; (2) les DC conventionnelles (cDC), productrices d’interleukine-12 (IL-12) ; et (3) les DC plasmacytoïdes (pDC), qui doivent leur nom à leur ressemblance morphologique avec les plasmocytes [3,
5]. Les pDC sont rares, présentes dans la circulation et les organes lymphoïdes (rate, ganglions), et se distinguent par une très importante sécrétion d’interféron de type I après stimulation par l’ADN ou l’ARN viral, ce qui contribue à activer secondairement les NK et les DC conventionnelles. En revanche, contrairement à ces dernières, elles n’ont qu’une faible capacité de présentation et d’apprêtement de l’antigène. Il n’y a pas de marqueur moléculaire caractéristique de ces populations cellulaires (voir plus loin), et leur phénotype (incluant le profil cytokinique) est encore incertain. Schématiquement, chez la souris, les cDC sont CD11c++B220− et les pDC sont CD11c±B220+Ly-6C+Ly-6G-CD11b −
1,. De plus, ces dernières expriment Siglec H2 et PDCA1, deux marqueurs caractéristiques. L’ensemble des DC expriment les antigènes CMH de classe II, mais n’expriment pas NK1.1. NK et DC coopèrent [
6] : l’IFNγ sécrété par les NK stimule les DC, qui, à leur tour, contribuent à l’activation des NK, notamment via les IL-12 et -15. Cette dernière cytokine est essentielle au développement des NK [1], mais aussi via les IFN de type I. Une des difficultés de cette caractérisation phénotypique vient de ce que la majorité de ces marqueurs sont communs à plusieurs populations lymphoïdes ou myéloïdes : CD11c (une chaîne α des intégrines) qui est exprimée en association avec CD18 (chaîne β2 des intégrines), est portée par les macrophages, les NK et les polynucléaires ; CD11b (une autre chaîne α des intégrines), toujours associée à CD18, est présente à la surface des cDC, des NK, et des cellules granulo-macrophagiques ; B220 (une isoforme de la phosphatase membranaire CD45, CD45R) est exprimée par les précurseurs B, les lymphocytes B, et les cellules NK matures, Ly-6C par la majorité des cellules myéloïdes. Il est donc extrêmement risqué d’essayer de classer une cellule dans un compartiment ou un autre sur l’analyse d’un petit nombre de marqueurs, et sans multiplier les analyses simultanées associant plusieurs fluorochromes dans des combinaisons différentes, qui sont aujourd’hui à notre disposition [
7]. |
Identification des IKDC : une population hybride NK et pDC peuvent donc être distinguées chez la souris, phénotypiquement et surtout fonctionnellement : or, en 2006 deux articles de Nature Medicine étonnent la communauté immunologique par leur description d’une population de cellules « hybrides » exprimant des caractéristiques phénotypiques et fonctionnelles de NK et de pDC d’où leur nom d’IKDC (IFN-producing killer D, IKDC) [
8–
10]. Les stratégies expérimentales et les modèles (murins) utilisés par les deux équipes sont différents : l’une cherchait à caractériser, dans un modèle murin de mélanome métastatique traité efficacement par l’association thérapeutique Glivec®
3, + interleukine-2 (IL-2), le phénotype des effecteurs immunitaires tumoricides, car ceux-ci différaient de NK classiques [8,
9]. L’autre étude cherchait à caractériser les interactions entre cellules NK et DC en analysant des populations issues de la rate et de ganglions de souris naïves C57BL/6 ou BalB/C [10]. Les deux équipes ont isolé une population coexprimant CD11c± et B220+, suggérant son appartenance au compartiment DC. Mais, plusieurs marqueurs caractéristiques, mais non exclusifs, de cellules NK étaient également exprimés : NK1.1+, CD49b+ (VLA-2), CD122 (la chaîne b du récepteur de l’IL-2 et de l’IL-15), et plusieurs récepteurs NK de types activateurs (dont NKG2D) et inhibiteurs. Ces IKDC pouvaient exercer, selon l’environnement, une fonction cytotoxique spontanée (fonction NK) ou de cellule présentatrice d’antigène (CPA) (fonction DC). Ainsi, elles tuaient des cellules tumorales B6F10 [8] via TRAIL et via leur production d’IFNγ, et des cibles NK classiques [8, 10]. Dans les ganglions, les IKDC exprimaient fortement les molécules CMH de classe II, CD86 et CD80 (molécules costimulatries présentes sur les DC matures) en réponse à une activation par les ODN CpG4, et il en était de même pour les IKDC présentes dans les tumeurs traitées par Glivec® et IL-2. Ces cellules se comportaient comme de véritables CPA capables d’activer et de faire proliférer des lymphocytes T naïfs, ce dont les cellules NK sont classiquement incapables, chez la souris. Néanmoins, la capture et la dégradation par les IKDC des antigènes utilisés par Chan et al. [10], ovalbumine entière in vitro ou Listeria monocytogenes in vivo étaient peu documentées et semblaient peu convaincantes [
11]. Quant à la synthèse d’IFN de type I par les IKDC, suggérée par les deux études, elle n’a pas été retrouvée par d’autres [
12]. Les IKDC représentaient la majorité des cellules CD11c+ au sein des tumeurs [8], et 20 % de celles de la rate chez les souris traitées, alors qu’elles ne représentent que 2-10 % des CD11c±B220+ de la rate de souris naïves. Cette population a suscité curiosité et intérêt, mais aussi un certain scepticisme [11]. Plusieurs éléments étaient troublants : (1) l’absence d’analyse simultanée des multiples marqueurs décrits, et l’absence d’analyse à l’échelon unicellulaire de ces cellules, que ce soit sur un plan phénotypique ou fonctionnel, deux contraintes que rendent indispensables la variabilité d’expression des marqueurs et leur absence de spécificité, évoquées ci-dessus ; (2) une sécrétion d’IFN de type I ; (3) la persistance de cellules IKDC dans des souris Rag2−/−il2rγ
-/-
, mais leur absence chez des souris il-2rβ
-/-
, ce qui était surprenant puisque les récepteurs de l’IL-2 et de l’IL-15 partagent les deux chaînes γ et β et diffèrent pour la chaîne α, et que, en l’absence de chaîne γ, ces deux récepteurs ne sont pas fonctionnels. |
Inclusion des IKDC dans la famille des NK activées Curieusement, le phénotype IKDC « hybride » décrit chez la souris rappelait celui des cellules NK activées humaines, qui expriment les CMH de classe II et des molécules costimulatrices présentes sur les DC matures, et peuvent acquérir une fonction de CPA. Trois équipes indépendantes, dont celles de J. Di Santo à l’Institut Pasteur [
13] et de M. Colonna [
14], qui font autorité dans le domaine de la biologie et de la différenciation des NK, ont approfondi l’analyse de cette population hybride chez la souris, et publient simultanément leurs résultats dans J Exp Med [13–
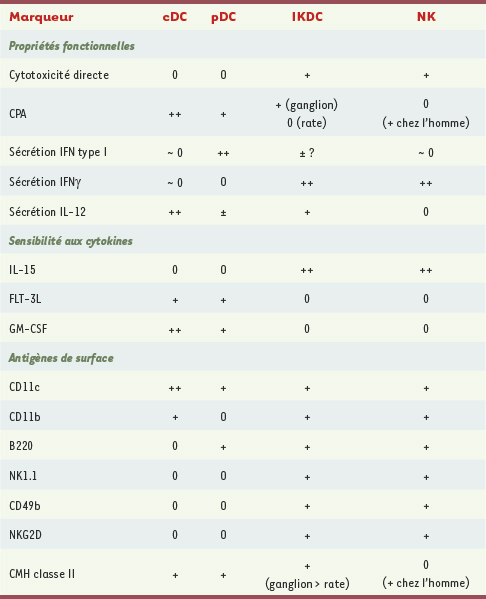
15] : toutes trois confirment l’existence d’une sous-population distincte CD11c±B220+NK1.1+ parmi les cellules B220+CD11c+ mais une analyse phénotypique et fonctionnelle rigoureuse les incite à considérer ces IKDC comme des cellules NK activées (Tableau I).  | Tableau I.
Résumé des marqueurs utilisés chez la souris pour différencier DC, pDC, IKDC et cellules NK. CPA : cellule présentatrice d’antigène ; IFN : interféron ; cDC : DC conventionnelles ; pDC : DC plasmacytoïdes ; IKDC : interferon producing killer dendritic cells ; NK : natural killer ; CMH : complexe majeur histocompatibilité ; GM-CSF : granulocyte macrophage colony-stimulating factor (d’après [ 8, 10, 13– 15]). |
Un premier argument est la sensibilité différente de ces populations aux cytokines : le développement des IKDC et des cellules NK, mais pas celui des cellules pDC, requiert une voie de signalisation IL-15 intacte. De très rares cellules NK1.1+ (<1% des B220+CD11c+NK1.1+) sont détectables dans les souris rag2−/−il2rγ−/−, ou rag2−/−il-2rβ−/−
(la détection d’IKDC dans les souris rag2−/− il2rγ−/−, de l’étude initiale restant inexpliquée [8]), elles sont absentes dans les souris IL-15−/−
, alors que les populations pDC ne sont pas affectées [13]. Au contraire, l’absence de Flt3-L prévient le développement des pDC et DC et affecte peu celui des IKDC ou des NK [14]. Les analyses in vitro confirment que l’ajout de Flt3-L ou de GM-CSF (granulocyte-macrophage colony-stimulating factor) (cytokines DC) aux cultures accroît sélectivement le compartiment des pDC, alors que les IKDC répondent à l’IL-15 et l’IL-18, comme le font les NK [15]. La production d’IKDC requiert l’inhibiteur transcriptionnel Id2, indispensable au développement NK [14], le gène NK-spécifique Ncr-1 (codant pour NKp46) [13], mais ni PU.1, ni Spi-B, une situation inverse de celle qui prévaut pour les DC et pDC [15]. La dissection de la hiérarchie hématopoïétique est un autre domaine très mouvant, soumis aux mêmes contraintes techniques que celle des sous-populations d’effecteurs immuns, et plusieurs scénarios d’émergence des populations de NK [1,
18] et pDC, et plus récemment IKDC, ont été proposés [5,
16]. Les travaux de J. Di Santo ont montré que les NK émergent dans le thymus via la différenciation de progéniteurs ELP (early lymphoid progenitor) et dans la moelle osseuse via les cellules souches hématopoïétiques (CSH) ; on sait encore peu de choses sur le mécanisme de la restriction de ces CSH en progéniteurs NK restreints (NKP), qui sont, eux, bien définis (notamment par l’expression de CD122) [
17, 18]. cDC et pDC émanent de la différenciation de multiples progéniteurs, myéloïdes (CMP, common myeloid progenitor) et lymphoïdes, exprimant le récepteur Flt3, et un progéniteur DC (cDC + pDC) restreint a été décrit [3, 5]. Quant aux IKDC, leur émergence se ferait précocement, au moment de la ségrégation des lignées lymphoïdes, et via un progéniteur qui serait différent de celui des NK, mais cette étude (unique) doit être confirmée [16]. Un second argument rapprochant IKDC et NK vient d’une analyse détaillée de l’hétérogénéité phénotypique et fonctionnelle des populations NK1.1+ ou B220+CD11c+ de la rate et de la moelle osseuse de souris normales par les équipes de J. Di Santo et M. Colonna [13, 14] (Tableau I). Il est indiscutable qu’une fraction des cellules NK1.1+CD49b+ dans la moelle osseuse, la rate et le sang périphérique co-expriment aussi B220 et CD11c, ainsi que CD27 et CD11b, mais la présence ou l’absence de ces marqueurs ne discrimine pas des sous-populations aux propriétés fonctionnelles différentes, même si la fraction B220+CD11c+ sécrète plus d’IFNγ et de TNFα [13, 14]. En revanche, les IKDC CD11c±B220+NK1.1+ n’expriment aucun des marqueurs typiques de pDC, Gr-1 ou siglec-H [14], et ne sécrètent pas d’IFN de type I [14]. L’expression spontanée des CMH-II varie selon les organes, rare dans la rate (1-5 %), plus marquée dans les ganglions, mais reste faible et rarement corrélée à celle de CD11c ou B220 [13, 14]. Une constante en revanche est la possibilité d’induire un phénotype IKDC complet et fort dans 30 %-50 % des cellules NK « conventionnelles » de la rate, de la moelle osseuse ou des ganglions, en présence de stimulus inflammatoires engageant les récepteurs TLR3 (ligand Poly : IC) ou TLR9 (ligand CpG oligonucléotides) [15]. L’IFNγ ne joue aucun rôle dans cette induction. L’inflammation associée au processus tumoral explique probablement l’abondance de cette population IKDC dans l’un des articles princeps [8]. Ces données, et l’expression connue de CD11c et de B220 sur les cellules NKT et les lymphocytes T CD8 activés, incitent à considérer ces marqueurs comme les stigmates d’une activation cytokinique récente dans une cellule cytotoxique quelle qu’elle soit, et le reflet d’une intense prolifération cellulaire [13]. Si phénotypiquement IKDC et pDC ont peu de marqueurs communs, la fonction CPA des IKDC est elle aussi très limitée, et reste très inférieure à celle de DC conventionnelles, et leur capacité à activer efficacement des lymphocytes T naïfs est très faible. Il n’est pas exclu que dans l’article de Chan et al., l’activité CPA soit due à une contamination par des DC CD49b+ [10]. En revanche, l’activité lytique spontanée et après activation des IKDC est comparable à celle de cellules NK. Conclusion L’histoire des « IKDC » est très instructive… Tout chercheur rêve de découvrir une « nouvelle » population, et les progrès de la cytométrie en flux et la multiplicité des marqueurs, offrent encore cette possibilité de démasquer les ramifications des populations cellulaires. Mais la sophistication du système immunitaire, le partage des marqueurs par les effecteurs, et l’extrême dextérité et rapidité avec lesquelles ces effecteurs adaptent leur phénotype à la situation, imposent, avant d’identifier une sous-population cellulaire jusque là non identifiée, des vérifications quasi obsessionnelles que souvent l’on rechigne à faire. La multiplication des combinaisons de marqueurs, et l’analyse unicellulaire restent des impératifs. Dans ce cas précis, les IKDC représentent peut-être l’équivalent des cellules NK activées humaines co-exprimant CMH-II, CD11c, et CD56. La dissection de la hiérarchie hématopoiétique, qui dure depuis plus d’un quart de siècle, et s’affine autant qu’elle se complique au fur et à mesure de la disponibilité de nouveaux marqueurs, partage les contraintes techniques et les aléas de l’analyse immunologique décrits ici, et nous a appris que la technologie, aussi précise soit-elle, n’a toujours pas remplacé l’analyse fonctionnelle unicellulaire, parce que peut-être il n’existe pas deux cellules phénotypiquement identiques… [ 18]. |
Nous remercions James Di Santo de sa relecture attentive et critique de ce manuscrit.
|
Footnotes |
1. Huntington ND, Vosshenrich CA, Di Santo JP. Developmental pathways that generate natural-killer-cell diversity in mice and humans. Nat Rev Immunol 2007; 7 : 703–14. 2. Banchereau J, Briere F, Caux C, et al. Immunobiology of dendritic cells. Annu Rev Immunol 2000; 18 : 767–811. 3. Yong-Jun Liu. IPC: professional type 1 interferon-producing cells and plasmacytoid dendritic cell precursors. Annu Rev Immunol 2005; 23 : 275–306. 4. Valladeau J. Les cellules de Langerhans. Med Sci (Paris) 2006; 22 : 144–8. 5. Colonna M, Trinchieri G, Liu YJ. Plasmacytoid dendritic cells in immunity. Nat Immunol 2004; 5 : 1219–26. 6. Walzer T, Dalod M, Robbins SH, et al. Natural-killer cells and dendritic cells: «l’union fait la force ». Blood 2005; 106 : 2252–8. 7. Spits H, Lanier LL. Natural killer or dendritic: what’s in a name ? Immunity 2007; 26 : 11–6. 8. Taieb J, Chaput N, Menard C, et al. A novel dendritic cell subset involved in tumor immunosurveillance. Nat Med 2006; 12 : 214–9. 9. Chaput N, Taieb J, Ullrich E, Zitvogel L. Une nouvelle cellule dendritique impliquée dans l’immunité anti-tumorale. Med Sci (Paris) 2006; 22 : 567–8. 10. Chan CW, Crafton E, Fan HN, et al. Interferon-producing killer dendritic cells provide a link between innate and adaptive immunity. Nat Med 2006; 12 : 207–13. 11. Shortman K, Villadangos JA. Is it a DC, is it an NK ? No, it’s an IKDC. Nat Med 20006; 12 : 167–8. 12. Vremec D, O’Keeffe M, Hochrein H, et al. Production of interferons by dendritic cells, plasmacytoid cells, natural killer cells, and interferon-producing killer dendritic cells. Blood 2007; 109 : 1165–73. 13. Vosshenrich CAJ, Lesjean-Pottier S, Hasan M, et al. CD11cloB220+ interferon-producing killer dendritic cells are activated natural killer cells. J Exp Med 2007; 204 : 2569–78. 14. Blasius AL, Barchet W, Cella M, Colonna M. Development and function of murine B220+CD11c+NK1.1+ cells identify them as a subset of NK cells. J Exp Med 2007; 204 : 2561–8. 15. Caminschi I, Ahmet F, Heger K, et al. Putative IKDCs are functionally and developmentally similar to natural killer cells, but not to dendritic cells. J Exp Med 2007; 204 : 2579–90. 16. Welner RS, R. Pelayo KP, Garrett X, et al. Interferon-producing killer dendritic cells (IKDC) arise via a unique differentiation pathway from primitive c-kitHiCD62L+ lymphoid progenitors. Blood 2007; 109 : 4825–31. 17. Di Santo JP. Natural killer cell developmental pathways: a question of balance. Annu Rev Immunol 2006; 24 : 257–86. 18. Vosshenrich CA, García-Ojeda ME, Samson-Villéger SI, et al. A thymic pathway of mouse natural killer cell development characterized by expression of GATA-3 and CD127. Nat Immunol 2006; 7 : 1217–24. 19. Buza-Vidas N, Luc S, Jacobsen SE. Delineation of the earliest lineage commitment steps of haematopoietic stem cells: new developments, controversies and major challenges. Curr Opin Hematol 2007; 14 : 315–21. |