| |
| Med Sci (Paris). 2008 April; 24(4): 365–367. Published online 2008 April 15. doi: 10.1051/medsci/2008244365.La cellule microgliale rétinienne Un suspect inattendu dans la dégénérescence maculaire liée à l’âge Florian Sennlaub1,2,3 and Christophe Combadière2,4,5* 1Inserm, UMRS 872, Centre de Recherche des Cordeliers, 75005 Paris, France. 2UPMC, Université Paris 06, UMRS 872, 75005 Paris, France. 3Université Paris Descartes, UMRS 872, 75005 Paris, France 4Inserm U543, Laboratoire d’Immunologie Cellulaire, 75005 Paris, France. 5AP-HP, Service d’Immunologie, Groupe Hospitalier Pitié-Salpêtrière, Faculté de Médecine, 91, boulevard de l’Hôpital, 75013 Paris, France MeSH keywords: Vieillissement, Humains, Dégénérescence maculaire, Microglie, Nerf optique, Récepteurs aux chimiokines |
La dégénérescence maculaire liée à l’âge ou DMLA est la première cause de cécité dans le monde industrialisé et la prévalence de cette maladie risque encore d’augmenter dans les prochaines années à cause du vieillissement de la population occidentale [
1]. Le premier signe de DMLA est l’apparition d’une tache sombre au centre du champ de vision. Ce premier symptôme est souvent précédé par la présence de taches blanches sous-rétiniennes révélées seulement lors d’un examen du fond de l’oeil. Appelées « Drusen », elles résulteraient de l’accumulation extracellulaire de matériels lipoprotéiques, mais leur origine reste mal connue. Les symptômes de la DMLA sont les conséquences d’une dégénérescence de la partie centrale de la rétine, la macula, où se concentrent les cônes qui sont responsables de la vision fine et des couleurs. Ce phénomène est aggravé par la formation de nouveaux vaisseaux sanguins au niveau de la choroïde en dessous de la rétine qui, à terme, peuvent provoquer des hémorragies sous-rétiniennes et accélérer l’évolution vers la cécité. Les recherches et les traitements actuels s’efforcent d’inhiber cette néovascularisation [
2] en négligeant les aspects initiaux de dégénérescence cellulaire. |
Facteurs de risque de DMLA Les causes de la DMLA sont encore peu connues mais l’âge, le tabac et l’histoire familiale sont les principaux facteurs de prédisposition à la DMLA [1,
3]. Quelques gènes de susceptibilité ont été identifiés et notamment des variations dans le gène codant pour le facteur H (FCH)1 qui pourraient rendre compte de 20 à 50% des cas de DMLA [
4,
5]. La détermination précise de ces gènes pourrait permettre d’améliorer le dépistage des personnes à risque et de proposer de nouveaux axes thérapeutiques. Récemment, le polymorphisme du gène d’un récepteur de chimiokine, le CX3CR1, a été associé au développement de la maladie [
6,
7]. Ainsi, le risque de DMLA est environ 2 à 2,5 fois supérieur chez les individus homozygotes porteurs de l’allèle rare de CX3CR1 (nommé CX3CR1 M280). Ce récepteur est connu pour permettre le recrutement de certaines cellules immunitaires de la circulation sanguine vers un tissu en réponse à une inflammation [
8–
10]. En cas de dysfonctionnement, comme chez les individus porteurs des allèles variants de CX3CR1, le recrutement des cellules immunitaires est limité, modifiant ainsi la susceptibilité du sujet porteur à certains phénomènes inflammatoires périphériques comme cela a déjà été décrit dans l’athérosclérose [
11]. À l’inverse, dans la rétine des patients, les cellules immunitaires spécifiques de la rétine - les cellules microgliales (CM) - s’accumulent au niveau de l’espace sousrétinien au contact de la barrière rétino-épithéliale où se trouvent les photorécepteurs (Figures 1A et 1B).
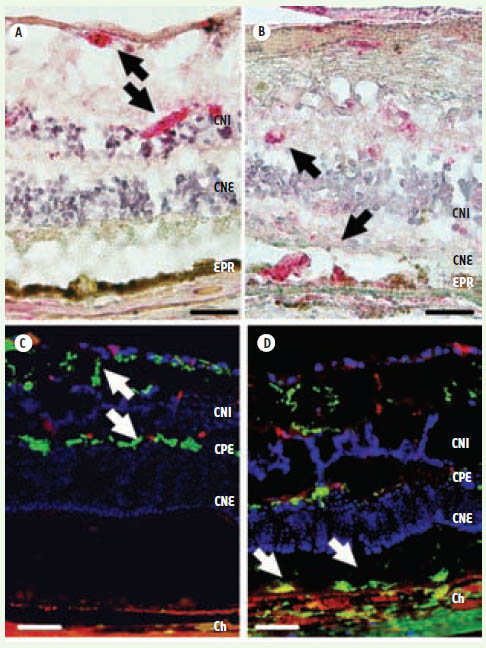
 | Figure 1.
Expression de CX3CR1 dans la rétine. Donneur sain (A), patient atteint de DMLA (B), souris âgée témoin (C) et souris âgée CX3CR1GFP/GFP
(D). En A et B, CX3CR1 (en rouge) est révélé par immunohistochimie et coloré au Fast red (flèches noires). En C et D, CX3CR1 (en vert) est révélé par un marquage intrinsèque par la GFP (flèches blanches). CNI : couche nucléaire interne ; CPE : couche plexiforme externe ; CNE : couche nucléaire externe ; EPR : épithélium pigmentaire rétinien ; Ch : choroïde (échelle : 50 μm). |
Les CM ectopiques se situent donc à proximité des lésions rétiniennes et elles y adoptent parfois un aspect ballonné qui ressemble aux Drusen, ces dépôts lipoprotéiques caractéristiques de la DMLA. |
Le phénotype rétinien des souris CX3CR1−/−
Une souche de souris déficiente pour le gène codant pour le CX3CR1 (CX3CR1−/−
) a été utilisée pour simuler ce dysfonctionnement chez l’animal. Comme chez les malades, une accumulation de CM est observée dans la couche des photorécepteurs au cours du vieillissement (dès 12 mois) et dans des conditions de stress comme celle que provoque une lésion déclenchée par un laser ou une lumière ambiante chez des souris albinos (Figures 1C et 1D). Après une phagocytose excessive des photorécepteurs, les CM gonflent, s’agrègent et finalement, lors de l’examen du fond d’oeil, apparaissent comme des taches blanches très similaires aux « Drusen » observés chez les patients. Plus étonnant encore, ces CM détruisent la rétine externe et provoquent une véritable dégénérescence. Ainsi, la couche de photorécepteurs est réduite de 50 % en 18 mois chez les souris CX3CR1−/−
pigmentées et elle disparaît en 4 mois chez les souris CX3CR1−/−
albinos. Ces dernières, plus sensibles à la lumière ambiante du fait de l’absence de pigments, ne souffrent d’aucune dégénérescence si elles sont élevées à l’abri de la lumière. Pour compléter ce tableau clinique, l’accumulation des CM sousrétiniennes chez les souris CX3CR1−/−
favorise le développement de nouveaux vaisseaux grâce notamment à la production excessive de VEGF, un facteur de croissance des cellules endothéliales. |
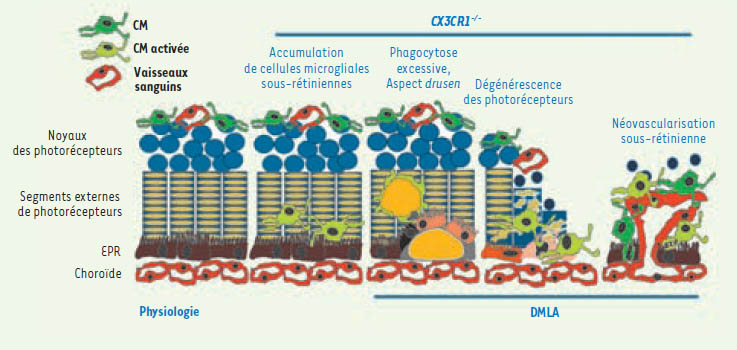
CX3CR1 servirait à nettoyer l’espace sous-rétinien des cellules microgliales L’athérogenèse repose sur une infiltration des lésions vasculaires par des macrophages issus de la circulation sanguine en réponse à des chimiokines. Ici, au contraire, ces travaux révèlent un rôle des chimiokines dans l’activation des cellules macrophagiques rétiniennes résidentes. Nous proposons que, dans les conditions physiologiques, les CM migrent dans l’espace sous-rétinien, phagocytent les photorécepteurs à la suite d’un stress oxydant (comme la lumière, le tabac ou d’autres facteurs déclenchants) et sont éliminées par un mécanisme dépendant de CX3CR1 (et impliquant sans doute d’autres couples chimiokines/récepteurs). Dans le cas d’une perte des fonctions associées à CX3CR1, les CM s’accumulent dans l’espace sous-rétinien. Leur nombre élevé s’accompagnerait : (1) d’une phagocytose excessive des photorécepteurs et de leur transformation morphologique en cellules « spumeuses », responsables de l’aspect drusen chez la souris ; (2) d’une sécrétion de facteurs neurotoxiques responsables de la dégénérescence des photorécepteurs ; et (3) d’une production de facteurs angiogéniques (le VEGF notamment) participant à la néovascularisation sous-rétinienne. Cette hypothèse assigne donc un nouveau rôle pour le CX3CR1 et la CM dans le processus pathogénique de la DMLA. Nous proposons que des mécanismes similaires participent au développement de la DMLA chez l’humain (Figure 2).  | Figure 2.
Rôle des CM dans la DMLA. Dans la rétine normale, les CM se situent au niveau de la rétine interne et n’interviennent qu’occasionnellement dans le recyclage et l’élimination journalière des segments externes des photorécepteurs. Dans le cas d’un recrutement de CM, dont la mobilité en réponse au ligand de CX3CR1 est altérée, les CM s’accumulent, se gorgent de débris cellulaires, s’agrègent et finalement apparaissent comme des taches blanches très similaires aux drusens. Ces CM détruisent la rétine externe (photorécepteurs et cellules de l’épithélium pigmentaire, EPR) provoquant une véritable dégénérescence. Ils favorisent enfin le développement de nouveaux vaisseaux. |
En conclusion, ces résultats mettent en évidence le rôle central d’une cellule jusqu’ici peu soupçonnée dans le développement de la DMLA : la cellule microgliale rétinienne. Cette découverte ouvre ainsi de nouvelles possibilités thérapeutiques visant à inhiber l’accumulation des cellules microgliales, et ce pour la principale maladie responsable de cécité en France. |
Footnotes |
1. Friedman DS, O’Colmain BJ, Munoz B, et al. Prevalence of age-related macular degeneration in the United States. Arch Ophthalmol 2004; 122 : 564–72. 2. Behar-Cohen F, Sennlaub F, Berdugo M. Espoirs thérapeutiques dans la dégénérescence maculaire liée à l’âge. Med Sci (Paris) 2007; 23 : 127–9. 3. Bird AC, Bressler NM, Bressler SB, et al. An international classification and grading system for age-related maculopathy and age-related macular degeneration. The international ARM epidemiological study group. Surv Ophthalmol 1995; 39 : 367–74. 4. Haines JL, Hauser MA, Schmidt S, et al. Complement factor H variant increases the risk of age-related macular degeneration. Science 2005; 308 : 419–21. 5. Edwards AO, Ritter R 3rd, Abel KJ, et al. Complement factor H polymorphism and age-related macular degeneration. Science 2005; 308 : 421–4. 6. Tuo J, Smith BC, Bojanowski CM, et al. The involvement of sequence variation and expression of CX3CR1 in the pathogenesis of age-related macular degeneration. Faseb J 2004; 18 : 1297–9. 7. Combadiere C, Feumi C, Raoul W, et al. CX3CR1- dependent subretinal microglia cell accumulation is associated with cardinal features of age-related macular degeneration. J Clin Invest 2007; 117 : 2920–8. 8. Combadiere C, Salzwedel K, Smith ED, et al. Identification of CX3CR1. A chemotactic receptor for the human CX3C chemokine fractalkine and a fusion coreceptor for HIV-1. J Biol Chem 1998; 273 : 23799–804. 9. Geissmann F, Jung S, Littman DR. Blood monocytes consist of two principal subsets with distinct migratory properties. Immunity 2003; 19 : 71–82. 10. Combadière B, Combadière C, Deterre P. Les chimiokines : un réseau sophistiqué de guidage cellulaire. Med Sci (Paris) 2007; 23 : 173–9. 11. Moatti D, Faure S, Fumeron F, et al. Polymorphism in the fractalkine receptor CX3CR1 as a genetic risk factor for coronary artery disease. Blood 2001; 97 : 1925–8. |