| |
| Med Sci (Paris). 2008 March; 24(3): 242–243. Published online 2008 March 15. doi: 10.1051/medsci/2008243242.Mutation dans le gène STAT3 chez des patients avec un syndrome Hyper-IgE Capucine Picard** Centre d’étude des déficits immunitaires, Hôpital Necker-Enfants Malades, APHP, 149, rue de Sèvres, 75015 Paris, France Génétique Humaine des Maladies Infectieuses, Inserm U550, Faculté Necker, 156, rue de Vaugirard, 75015 Paris, France Université Paris Descartes, Faculté de Médecine Necker-Enfants Malades, 156, rue de Vaugirard, 75015 Paris, France MeSH keywords: Humains, Interleukine-10, Interleukine-6, - traduction non trouvée, Modèles biologiques, Phosphorylation, Maturation post-traductionnelle des protéines, Structure tertiaire des protéines, Protein-tyrosine kinases, Facteur de transcription STAT-3, Transduction du signal |
Le syndrome hyper-IgE (HIES) est un déficit immunitaire héréditaire de transmission autosomique dominante qui a été initialement décrit en 1966 [
1]. Il est également appelé syndrome de Job ou de Buckley [
2]. Il se caractérise, sur le plan infectieux, par la survenue d’abcès « froids » cutanés récurrents à staphylocoques, de pneumopathies bactériennes et fongiques, et par une augmentation importante des immunoglobulines E (IgE) [2]. Les autres manifestations cliniques associées à ce déficit immunitaire sont un eczéma, une ostéopénie, une hyperlaxité ligamentaire, un retard à la chute des dents lactéales, ainsi qu’une dysmorphie [2]. Un très beau travail de Minegishi et al., récemment publié dans la revue Nature, a permis d’identifier un gène responsable de ce syndrome hyper-IgE autosomique dominant (HIES-AD) [
3]. Ces mêmes auteurs avaient précédemment identifié une mutation homozygote dans le gène TYK2 chez un patient avec un syndrome hyper-IgE autosomique récessif [
4]. Ce gène TYK2 code pour une enzyme à activité tyrosine kinase, la tyrosine kinase 2 (Tyk2), appartenant à la famille des Janus kinases (Jak) (Figure 1). Le patient porteur de cette mutation présente une susceptibilité infectieuse plus large que celle des patients atteints d’un HIES-AD (infections bactériennes à S. aureus, à Salmonella et BCGite, Candidose, Molluscum contagiosum et infections herpétiques) [4]. Le phénotype cellulaire de ce patient, outre l’élévation des IgE, était marqué par un défaut de réponse cellulaire à l’IL-6/IL-10 et à IL-12/23 [4]. La molécule Tyk2 intervenant dans la signalisation des cytokines IL-6/IL-10 et IL-12/23, le phénotype clinique et immunologique de ce patient a incité Minegishi et ses collaborateurs à rechercher un défaut de réponse à l’IL-6 et à l’IL-10 chez les patients HIES-AD.
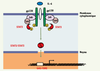 | Figure 1.
Rôle de STAT3 dans la transduction du signal cytokinique. L’IL-10 et les cytokines reconnues par le récepteur gp-130 (IL-6 ; IL-11, IL-27, IL-31, OSM, CNTF et CT-1) en se fixant sur leurs récepteurs recrutent des facteurs cytoplasmiques transactivateurs, et en particulier les molécules STAT3. STAT3 (représenté en rouge) est un facteur activateur de transcription qui est phosphorylé par Tyk2 et Jak, puis forme un homodimère qui va migrer dans le noyau et se fixer sur un motif GAS (gamma activated site) dans la région promotrice de gènes impliqués entre autres dans la réponse immunitaire. |
|
Défaut de réponse cellulaire aux interleukines-6 et -10 et mutations de STAT-3 Un défaut de réponse à l’IL-6 a été identifié dans les lymphocytes B de patients HIES-AD, ainsi qu’un défaut de réponse à l’IL-10 de leurs macrophages [3]. Ce phénotype immunologique a conduit les auteurs à séquencer les molécules communes impliquées dans la signalisation de ces deux cytokines. Ce travail a permis d’identifier des mutations hétérozygotes dominantes négatives dans le gène STAT3
(signal transducer and activator of transcription 3) chez 8 patients avec un HIES-AD [3]. Une équipe américaine a secondairement confirmé ces données en décrivant des mutations hétérozygotes du gène STAT3 chez 50 patients présentant un HIES-AD, dont 17 cas familiaux [
5]. STAT3 est un facteur activateur de transcription qui est phosphorylé par Tyk2 (Figure 1). Il est impliqué dans la signalisation de nombreuses cytokines telles que l’IL-10 et l’IL-6, mais aussi les cytokines reconnues par le récepteur de l’IL-6, la gp-130 (IL-6 ; IL-11, IL-27, IL-31, OSM [oncostatine M], CNTF [ciliary neurotrophic factor] et CT-1 [cardiotrophine 1]) [
6]. Les mutations identifiées chez les patients sont localisées dans deux régions de la molécule STAT3, le domaine de liaison à l’ADN et le domaine SH21, [3, 5]. Ces travaux permettent un début de compréhension de la physiopathologie de ce déficit immunitaire héréditaire. Les voies de signalisation de l’IL-6 et de l’IL-10 sont donc importantes pour la réponse immunitaire en particulier vis-à-vis des staphylocoques, mais semblent redondantes avec celles de l’immunité protectrice vis-à-vis de la plupart des autres agents pathogènes. Cette identification moléculaire va permettre un diagnostic plus précoce et une meilleure prise en charge des patients atteints de HIES-AD. |
Footnotes |
1. Davis SD, Schaller J, Wedgwood RJ. Job’s syndrome. Recurrent, « cold », staphylococcal abscesses. Lancet 1966; 1 : 1013–5. 2. Grimbacher B, Holland SM, Gallin JI, et al. Hyper-IgE syndrome with recurrent infections--an autosomal dominant multisystem disorder. N Engl J Med 1999; 340 : 692–702. 3. Minegishi Y, Saito M, Tsuchiya S, et al. Dominant-negative mutations in the DNA-binding domain of STAT3 cause hyper-IgE syndrome. Nature 2007; 448 : 1058–62. 4. Minegishi Y, Saito M, Morio T, et al., Human tyrosine kinase 2 deficiency reveals its requisite roles in multiple cytokine signals involved in innate and acquired immunity. Immunity 2006; 25 : 745–55. 5. Holland SM, DeLeo FR, Elloumi HZ, et al. STAT3 mutations in the hyper-IgE syndrome. N Engl J Med 2007; 357 : 1608–19. 6. Akira S. Roles of STAT3 defined by tissue-specific gene targeting. Oncogene 2000; 19 : 2607–11. |