| |
| Med Sci (Paris). 2008 March; 24(3): 238–240. Published online 2008 March 15. doi: 10.1051/medsci/2008243238.Les gènes Snail et les maladies rénales Les leçons de l’organogenèse Agnès Boutet1* and M. Angela Nieto2* 1Inserm U636, Faculté des Sciences, Université de Nice, 06108 Nice Cedex 2, France 2Instituto de Neurociencias de Alicante, CSIC-UMH, Apartado de correo 18, 03550 Sant Joan d’Alacant, Espagne |
Snail déclenche la transition épithélium-mésenchyme (TEM) Au cours de l’embryogenèse, le modelage des tissus implique des changements dynamiques de la morphologie des cellules. Le passage de l’état épithélial à l’état mésenchymateux et vice-versa est un processus de plasticité cellulaire particulièrement important dans la formation de nombreux tissus et structures. La transition mésenchyme-epithélium (TME) s’observe au cours de la formation des somites, du développement du rein et des gonades mâles. Sa réciproque, la transition épithélium-mésenchyme (TEM), quant à elle, a lieu lors de la délamination des cellules des crêtes neurales ou au cours de l’ingression du mésoderme chez les amniotes. Lors de la TEM, les cellules épithéliales perdent leur polarité apico-basale, se désolidarisent de leurs voisines et modifient leurs contacts avec les molécules de la matrice extracellulaire. La perte d’expression de certaines molécules d’adhésion comme la cadhérine E, une cadhérine pan-épithéliale, ainsi que la réorganisation du cytosquelette de l’actine confèrent aux cellules ayant subi la TEM des propriétés migratoires et invasives. Les facteurs de transcription de la superfamille Snail sont impliqués dans le déclenchement du processus de TEM [
1,
2] (Figure 1). Dans cette famille, les gènes Snail1 et Snail2 sont issus de la duplication d’un gène Snail ancestral comme l’ont montré des analyses phylogénétiques [
3].
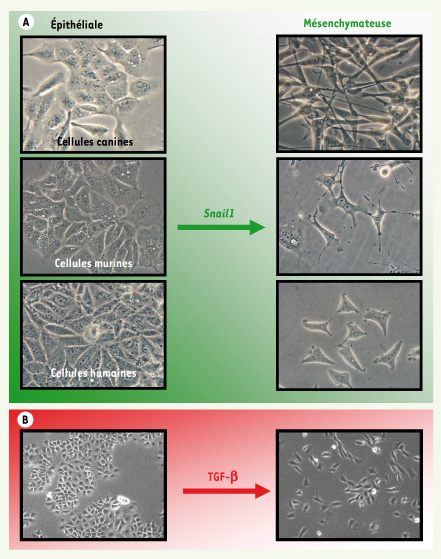
 | Figure 1.
Modèles cellulaires d’induction de la transition épithelium-mésenchyme (TEM). A. Différentes lignées cellulaires épithéliales (canines : MDCK [photos : Sonia Vega] ; murine : NMuMG ; humaine : MCF7) subissent la TEM après transfection avec L’ADNc de Snail1. B. Induction de la TEM après 48 heures de traitement avec le TGF-β (2 ng/ml). |
Outre son rôle majeur dans l’embryogenèse, la TEM est impliquée dans des événements pathologiques comme l’acquisition du caractère de malignité des carcinomes (tumeurs d’origine épithéliale), au cours desquels la perte de la cadhérine E est considérée comme un facteur de pronostic défavorable pour les patients [
4]. En 2000, il a été montré que Snail1 est un répresseur direct de la transcription du gène cadhérine-E établissant pour la première fois un lien entre la TEM induite par Snail1 et la progression tumorale [1, 2]. |
Snail contrôle l’expression des cadhérines épithéliales rénales La cadhérine-16, spécifiquement exprimée dans les cellules épithéliales des tubules rénaux, est une autre cible de Snail1 et Snail2 [
5]. Au cours du développement rénal, les cellules épithéliales se différencient à partir du mésoderme selon un processus de TME et cette différenciation s’accompagne de l’extinction de l’expression de Snail1 et Snail2 (Figure 2). Ce patron d’expression est maintenu chez l’adulte indiquant que l’homéostasie de l’épithélium rénal fonctionne sans les produits des gènes Snail. L’expression pathologique de Snail1 a été décrite dans des carcinomes de diverses origines où elle est corrélée à la perte de la cadhérine-E (pour revue, voir [
6]). Tout récemment, nous avons montré que des carcinomes sporadiques rénaux ré-expriment Snail2 dans les zones dé-différenciées de la tumeur, et que cela s’accompagne d’une perte d’expression de la cadhérine-16 [
7]. Contrairement à ce qui a été rapporté dans nombre de carcinomes humains [6], le gène réactivé n’était pas Snail1 mais Snail2, qui est majoritairement exprimé dans les cellules mésodermales donnant naissance aux cellules épithéliales des tubules rénaux au cours de l’ontogenèse [5]. Le rôle de Snail2 dans la progression des mélanomes [
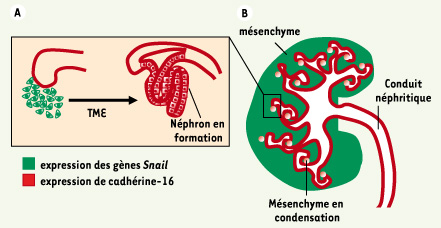
8] est un autre exemple de réactivation, dans les lésions néoplasiques, d’un programme génétique mis en place au cours de l’embryogenèse. Rappelons que Snail2 est un facteur de spécification des mélanocytes et gouverne les propriétés migratoires des crêtes neurales dont ces cellules sont issues.  | Figure 2.
Morphogenèse du rein. A. Au cours de la morphogenèse du rein, le bourgeon urétéral progresse et se ramifie dans le mésenchyme adjacent pour former le système collecteur. L’extrémité des branches induit la condensation et la différenciation du mésenchyme en structures tubulaires, les néphrons, qui constituent les unités de filtration du rein. B. Les gènes Snail sont exprimés dans le mésenchyme, mais cette expression disparaît quand les cellules se différencient en cellules épithéliales selon un processus de transition mésenchymo-épithélial (TME). La cadhérine-16, quant à elle, est exprimée dans les cellules épithéliales après la différenciation. |
|
Interaction TGF-β/snail dans la fibrose rénale Une TEM s’observe également dans des pathologies autres que le cancer comme la fibrose. Dans le rein, les lésions fibrotiques apparaissent comme la conséquence de néphropathies chroniques et consistent en une accumulation de myofibroblastes, locaux ou issus des cellules épithéliales rénales ayant subi une TEM. Ces myofibroblastes produisent un excès de matrice extracellulaire conduisant à une modification drastique de l’architecture du parenchyme rénal à l’origine du dysfonctionnement rénal et pouvant évoluer vers l’insuffisance rénale. Jusqu’alors, les stratégies thérapeutiques visant à prévenir la fibrose rénale ont consisté à inhiber l’activité de cytokines comme le TGF-β (transforming growth factor-b), inducteur de la TEM (Figure 1) et activateur de Snail1. En effet, l’administration de BMP-7 (bone morphogenetic protein), un antagoniste naturel de TGF-β, à des souris ayant subi une ligature de l’uretère expérimentale1 atténue la formation des lésions fibrotiques [
9]. Dans un modèle de souris transgénique, la simple réactivation de Snail1 est capable de produire des altérations histologiques, moléculaires et biochimiques caractéristiques de la fibrose rénale [5]. De plus, les tissus rénaux humains fibrotiques présentent des niveaux élevés de Snail1 confirmant l’importance de ce gène dans le processus de fibrose [5] et suggérant que l’expression de Snail1 pourrait être un marqueur diagnostique et également une cible de thérapie anti-fibrotique. L’angiotensine II (Ang II) est également un facteur fibrosant par son action pro-inflammatoire responsable de la synthèse de TGF-β [
10,
11] et par son effet vasoconstricteur conduisant à une élévation de la pression capillaire dans les glomérules. En clinique les inhibiteurs de l’enzyme de conversion (ICE), enzyme responsable de la synthèse d’Ang II, sont utilisés pour améliorer la filtration glomérulaire et prévenir la progression des lésions fibrotiques. L’Ang II semble affecter la perméabilité de la membrane glomérulaire comme l’indique la perte d’expression de néphrine observée dans les podocytes humains traités avec l’Ang II [
12]. De manière intéressante, il a récemment été montré que Snail1 inhibe la transcription de la néphrine [
13] suggérant que le mécanisme d’action de l’Ang II pourrait faire intervenir l’induction de Snail1 dans les podocytes. Reste à savoir si l’expression ciblée de Snail1 dans les podocytes est capable d’induire des altérations du glomérule comme le fait la re-expression de Pax2 [
14], un marqueur précoce de la lignée néphrogénique [
15]. Le rôle de Snail1 dans l’induction de la fibrose rénale ainsi que la re-expression de Snail2 dans les carcinomes rénaux indiquent que la réversion du processus de différenciation cellulaire qui a lieu au cours de l’ontogenèse rénale est une composante du mécanisme de pathogénie. |
Footnotes |
1. Cano A, Perez-Moreno MA, Rodrigo I, et al. The transcription factor snail controls epithelial-mesenchymal transitions by repressing E-cadherin expression. Nat Cell Biol 2000; 2 : 76–83. 2. Batlle E, Sancho E, Francí C, et al. The transcription factor snail is a repressor of E-cadherin gene expression in epithelial tumour cells. Nat Cell Biol 2000; 2 : 84–9. 3. Manzanares M, Locascio A, Nieto MA. The increasing complexity of the Snail gene superfamily in metazoan evolution. Trends Genet 2001; 17 : 178–81. 4. Perl AK, Wilgenbus P, Dahl U, et al. A causal role for E-cadherin in the transition from adenoma to carcinoma. Nature 1998; 392 : 190–3. 5. Boutet A, De Frutos CA, Maxwell PH, et al. Snail activation disrupts tissue homeostasis and induces fibrosis in the adult kidney. EMBO J 2006; 25 : 5603–13. 6. Barrallo-Gimeno A, Nieto MA. The Snail genes as inducers of cell movement and survival: implications in development and cancer. Development 2005; 132 : 3151–61. 7. Boutet A, Esteban MA, Maxwell PH, Nieto MA. Reactivation of Snail genes in renal fibrosis and carcinomas: a process of reversed embryogenesis ? Cell Cycle 2007; 6 : 638–42. 8. Gupta PB, Kuperwasser C, Brunet JP, et al. The melanocyte differentiation program predisposes to metastasis after neoplastic transformation. Nat Genet 2005; 37 : 1047–54. 9. Zeisberg M, Hanai J, Sugimoto H, et al. BMP-7 counteracts TGF-beta1-induced epithelial-to-mesenchymal transition and reverses chronic renal injury. Nat Med 2003; 9 : 964–8. 10. Weigert C, Brodbeck K, Klopfer K, et al. Angiotensin II induces human TGF-beta 1 promoter activation: similarity to hyperglycaemia. Diabetologia 2002; 45 : 890–8. 11. Buléon M, Mehrenberger M, Pécher C, et al. Bradykinine et néphroprotection : pourquoi ? Comment ? Perspectives. Med Sci (Paris) 2007; 23 : 1141–7. 12. Doublier S, Salvidio G, Lupia E, et al. Nephrin expression is reduced in human diabetic nephropathy: evidence for a distinct role for glycated albumin and angiotensin II. Diabetes 2003; 52 : 1023–30. 13. Matsui I, Ito T, Kurihara H, et al. Snail, a transcriptional regulator, represses nephrin expression in glomerular epithelial cells of nephrotic rats. Lab Invest 2007; 87 : 273–83. 14. Wagner KD, Wagner N, Guo JK, et al. An inducible mouse model for PAX2-dependent glomerular disease: insights into a complex pathogenesis. Curr Biol 2006; 16 : 793–800. 15. Bouchard M. Les gènes Pax et la spécification cellulaire. Med Sci (Paris) 2003; 19 : 535–7. |