| |
| Med Sci (Paris). 2008 March; 24(3): 235–237. Published online 2008 March 15. doi: 10.1051/medsci/2008243235.Du mollusque à l’homme YKL-40, un nouveau médiateur de l’asthme sévère ? Marina Pretolani* Inserm U700 et Université Paris 7, Faculté de Médecine Denis Diderot, Site Bichat, 16, rue Henri Huchard, 75018, Paris, France MeSH keywords: Adipokines, Animaux, Antiasthmatiques, Asthme, Bronches, Chitine, Cytokines, Évolution de la maladie, Cellules épithéliales, Protéines de la matrice extracellulaire, Fibroblastes, Régulation de l'expression des gènes, Glycoprotéines, Humains, Invertébrés, Lectines, Macrophages, Granulocytes neutrophiles, Polyosides, Spécificité d'espèce |
La glycoprotéine du cartilage 39, YKL-40 (appelée également HCgp-39 ou chitinase 3-like 1) fait partie de la famille des homologues des chitinases, des endo-β-1,4-N-acétylglucosaminidases qui dégradent la chitine, un polysaccharide constituant la paroi de certains insectes, crustacés et nématodes [
1]. Ces organismes produisent les chitinases afin de remodeler la chitine lors de leur morphogenèse. Les chitinases sont également produites par certaines bactéries et plantes et ce phénomène constitue un mécanisme de défense lors de leur invasion par les organismes contenant la chitine. Malgré l’absence de chitine chez les mammifères, deux chitinases, la chitotriosidase (ChTRase), et la chitinase acide (AMCase), ainsi que leur homologue, YKL-40, ont été clonées chez l’homme. Contrairement aux ChTRase et AMCase, YKL-40 ne possède pas, dans sa structure chimique, le domaine de liaison à la chitine caractérisé par la présence de six résidus cystéines et n’exerce donc pas d’activité catalytique [1]. Les analyses génomiques réalisées sur des cellules et tissus pathologiques, les dosages immunoenzymatiques dans des milieux biologiques et l’utilisation d’anticorps spécifiques ont permis de montrer une surexpression de YKL-40 et de son ARN messager lors de différentes maladies inflammatoires chroniques caractérisées par un remodelage tissulaire. Ces maladies incluent l’athérosclérose, l’arthrite rhumatoïde, la maladie de Crohn, la fibrose hépatique, et certains cancers solides, dont le cancer du sein, du côlon, de l’ovaire et les cancers pulmonaires à petites cellules [
2–
4]. Le plus souvent, YKL-40 était localisée au niveau de sites qui étaient le siège d’une fibrogenèse active et de remaniements de la matrice extracellulaire. Ces observations, accompagnées d’études réalisées à l’aide de modèles cellulaires, ont identifié les chondrocytes, les hépatocytes, les cellules synoviales et musculaires lisses vasculaires, les macrophages différenciés et les polynucléaires neutrophiles, comme étant les sources principales de YKL-40. Dans la plupart de ces cellules, l’expression de YKL-40 augmente lors de la stimulation par des cytokines pro-inflammatoires, comme le TNF (tumor-necrosis factor), ou le GM-CSF (granulocyte-macrophage colony stimulating factor), par l’exposition à des facteurs de stress, dont l’hypoxie, l’irradiation, les lésions mécaniques, l’appauvrissement du milieu de culture en sérum, et lors de la différenciation. Si les facteurs environnementaux responsables d’une élévation des taux de YKL-40 ont été, en grande partie, identifiés, les cibles cellulaires et les effets biologiques de cette glycoprotéine ont été très peu étudiés. Cette carence d’informations est liée, en partie, à l’absence d’une source commerciale de YKL-40 recombinante humaine, les travaux réalisés jusqu’à présent ayant fait appel essentiellement à la glycoprotéine purifiée à partir de surnageants de chondrocytes humains stimulés, ou à l’utilisation de son homologue exprimé de façon constitutive par certains invertébrés, comme les mollusques [
5]. À l’aide de ces préparations, il a été montré que YKL-40 agissait principalement sur les cellules mésenchymateuses, en particulier les chondrocytes, les cellules synoviales et les fibroblastes d’origine cutanée ou pulmonaire, dans lesquelles elle induit la croissance, la prolifération et la synthèse de protéines de la matrice extracellulaire.
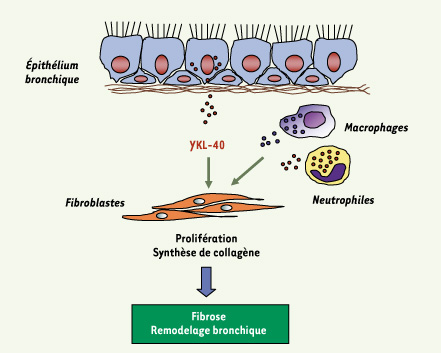
 | Figure 1.
Rôle possible de YKL-40 dans le développement de la fibrose sous-épithéliale. YKL-40, produite dans les voies aériennes par l’épithélium et les cellules inflammatoires (macrophages et polynucléaires neutrophiles), contribue au développement de la fibrose sous-épithéliale, l’une des caractéristiques du remodelage bronchique dans l’asthme sévère, en induisant la prolifération et la synthèse de collagène par les fibroblastes. |
|
Un homologue des chitinases biomarqueur du remodelage bronchique dans l’asthme sévère Une accumulation de fibroblastes et de myofibroblastes dans la région sous-épithéliale et un épaississement de la membrane basale, résultant d’un dépôt excessif des protéines de la matrice extracellulaire, sont des stigmates du remodelage bronchique dans l’asthme sévère, une pathologie invalidante pour laquelle aucune approche thérapeutique préventive ou curative n’est actuellement satisfaisante [
6,
7]. Ces phénomènes s’accompagnent d’une augmentation de la masse musculaire, secondaire à une prolifération excessive des cellules musculaires lisses bronchiques, et d’une angiogenèse [7–
10]. Un afflux de polynucléaires neutrophiles dans la muqueuse et la lumière bronchiques est fréquemment observé. Certains éléments du remodelage bronchique seraient peu ou pas sensibles aux traitements instaurés, notamment à base de corticostéroïdes et ils pourraient contribuer à la survenue d’une obstruction bronchique irréversible, source de handicap fonctionnel parfois sévère [7]. Ainsi, l’identification, au niveau ou à distance du poumon, de biomarqueurs du remodelage bronchique en mesure de caractériser spécifiquement les patients asthmatiques sévères peut aider à mieux comprendre les mécanismes conduisant au développement de cette maladie, mais aussi à en envisager le dépistage précoce et le suivi des patients lors d’un traitement, et à développer de cibles thérapeutiques innovantes. Le remodelage bronchique dans l’asthme sévère mettant en jeu des anomalies de la structure et la fonction de divers types cellulaires, cibles ou sources potentielles ou avérées de YKL-40, notre équipe a exploré récemment la possibilité que cette glycoprotéine soit un de ces nouveaux biomarqueurs [
11]. Pour cela, les taux circulants de YKL-40 ont été mesurés chez 59 sujets sains et 194 patients atteints de maladie asthmatique de sévérité variable émanant de trois différentes cohortes (deux aux Etats-Unis et une en France), et ils ont été reliés à différents paramètres cliniques reflétant la sévérité de l’asthme, ainsi qu’au remodelage bronchique. Les données obtenues font état d’une élévation significative des taux sériques et du nombre de cellules exprimant YKL-40 (principalement des neutrophiles, des macrophages et des cellules épithéliales) dans les biopsies bronchiques de patients asthmatiques sévères, comparativement aux patients atteints d’asthme modéré et aux sujets sains. Ces paramètres corrèlent avec l’obstruction bronchique et avec le recours aux corticoïdes, la fréquence et la dose de corticoïdes administrés par voie orale, autant d’éléments qui définissent la sévérité de l’asthme. De plus, quel que soit le compartiment étudié, la circulation périphérique ou la paroi bronchique, l’expression de YKL-40 corrèle avec l’épaisseur de la membrane basale, utilisé comme marqueur du remodelage bronchique. L’ensemble de ces résultats suggère qu’une élévation de l’expression de YKL-40, dans la circulation ou les voies aériennes, traduit la sévérité de l’asthme et le degré du remodelage bronchique. Ces données représentent autant de pistes de réflexion pour des recherches futures. Tout d’abord, les observations montrant une surexpression de YKL-40 dans de nombreux états pathologiques, incitent à déterminer si les taux de cette protéine s’élèvent uniquement dans l’asthme sévère, ou également lors d’autres maladies respiratoires chroniques caractérisées par une inflammation et un remodelage bronchique, comme c’est le cas, par exemple, de la bronchopneumopathie bronchique obstructive [
12]. Cela permettra de définir si YKL-40 peut être considéré comme un véritable biomarqueur d’asthme sévère. De plus, nos observations histopathologiques [
9] montrent pour la première fois une localisation de YKL-40 dans l’épithélium bronchique humain. Ce résultat est à mettre en rapport avec une étude réalisée chez la souris où l’induction d’une colite inflammatoire s’accompagne d’une surexpression de l’homologue murin de YKL-40 dans l’épithélium intestinal [
13]. La signification de cette capacité des épithéliums pathologiques à synthétiser YKL-40 n’est pas élucidée, mais elle pourrait refléter un état d’activation anormale, secondaire à une réparation incomplète ou anarchique. Ce point est d’une importance majeure dans le cas de l’asthme, où des anomalies de la réparation épithéliale participent au développement de la fibrose sous-épithéliale [
14]. Par ailleurs, si les effets prolifératif et inducteur de la synthèse de collagène par les fibroblastes ont été établis, la capacité de YKL-40 à altérer les fonctions d’autres types cellulaires qui concourrent au remodelage bronchique dans l’asthme, comme les cellules endothéliales et musculaires lisses, demeure inconnue. |
Dans l’ensemble, nous proposons que YKL-40 fait partie d’une nouvelle classe de molécules surexprimées dans l’asthme sévère, où elles pourraient jouer un rôle dans la genèse du remodelage tissulaire. Un nouveau chapitre de la recherche de la physiopathologie de l’asthme sévère s’ouvre ainsi. Des études mécanistiques plus approfondies nous apporteront certainement les éléments d’information nécessaires à définir si YKL-40 représente un réel espoir thérapeutique. |
1. Bleau G, Massicotte F, Merlen Y, Boisvert C. Mammalian chitinase-like proteins. EXS 1999; 87 : 211–21. 2. Boot GR, van Achterberg AE, van Aken BE, et al. Strong induction of members of the chitinase family of proteins in atherosclerosis. Arterioscler Thromb Vasc Biol 1999; 19 : 687–94. 3. Johansen JS, Chrisoffersen P, Moller S, et al. Serum YKL-40 is increased in patients with hepatic fibrosis. J Hepatol 2006; 32 : 911–20. 4. Johansen JS, Jensen BV, Roslind A, et al. Serum YKL-40, a new prognostic biomarker in cancer patients ? Cancer Epidem Biomarkers Prev 2006; 15 : 194–202. 5. Badariotti F, Kypriotou M, Lelong C, et al. The phylogenetically conserved molluscan chitinase-like protein 1 (Cg-Clp1), homologue of human HC-gp39, stimulates proliferation and regulates synthesis of extracellular matrix components of mammalian chondrocytes. J Biol Chem 2006; 281 : 29583–96. 6. Wenzel SE. Severe asthma in adults. Am J Respir Crit Care Med 2005 : 172 : 149–60. 7. Bousquet J, Jeffery P, Busse WW, et al. Asthma. From bronchoconstriction to airways inflammation and remodeling. Am J Respir Crit Care Med 2000; 161 : 1720–45. 8. Benayoun L, Druilhe A, Dombret MC, et al. Airway structural alterations selectively associated with severe asthma. Am J Respir Crit Care Med 2003; 167 : 1360–8. 9. Benayoun L, Pretolani M. Le remodelage bronchique dans l’asthme : mécanismes et enjeux thérapeutiques. Med Sci (Paris) 2003; 19 : 319–26. 10. Coraux C, Hajj R, Lesimple P, Puchelle E. Réparation et régénération de l’épithélium respiratoire. Med Sci (Paris) 2005; 21 : 1063–9. 11. Chupp GL, Lee CG, Jarjour N, et al. A chitinase-like protein in the lung and circulation of patients with severe asthma. N Engl J Med 2007; 357 : 2016–27. 12. Barnes PJ. Chronic obstructive pulmonary disease. N Engl J Med 2000; 343 : 269–80. 13. Mizoguchi E. Chitinase 3-like-1 exacerbates intestinal inflammation by enhancing bacterial adhesion and invasion in colonic epithelial cells. Gastroenterology 2006; 130 : 398–411. 14. Knight DA, Lane CL, Stick SM. Does aberrant activation of the epithelial-mesenchymal trophic unit play a key role in asthma or is it an unimportant sideshow ? Curr Opin Pharmacol 2004; 4 : 251–6. |