| |
| Med Sci (Paris). 2008 December; 24(12): 1089–1091. Published online 2008 December 15. doi: 10.1051/medsci/200824121089.Conflits et maladies infectieuses émergentes Dominique Labie* Département de génétique, développement et pathologie moléculaire, Institut Cochin, 24, rue du Faubourg Saint-Jacques, 75014 Paris, France MeSH keywords: Afrique, Animaux, Désordres civils, Maladies transmissibles émergentes, Flambées de maladies, Réservoirs d'agents pathogènes, Vecteurs de maladie, Services de santé, Accessibilité des services de santé, Humains, Lutte contre l'infection, Malnutrition, Préparations pharmaceutiques, Rats, Réfugiés, Conditions sociales, Vaccins, Guerre |
Qu’est-ce qu’une maladie infectieuse émergente ? Ce peut être l’apparition d’une infection jusqu’alors inconnue, ce peut aussi être la réémergence brutale, souvent massive, dans une population, d’un pathogène connu. Les causes sont diverses, environnementales, écologiques, industrielles, démographiques… L’existence de conflits internationaux ou de guerres civiles, l’insécurité prolongée qui en est la conséquence, ont multiplié ces explosions de maladies infectieuses. Les causes en sont évidentes ; des populations déplacées ont vécu dans des conditions d’hygiène précaire, d’alimentation insuffisante, ont manqué d’eau potable ; les services de santé désorganisés ont été privés d’approvisionnement et de vaccins, il y a eu rupture de la chaîne du froid, réutilisation de matériel contaminé par un personnel plus ou moins compétent. Or l’existence de ces conflits remplit nos journaux ; et les épidémies de maladies infectieuses souvent graves se sont multipliées ces dernières années. L’équipe de l’OMS à Genève (Suisse), responsable des maladies infectieuses, a fait une étude approfondie de l’incidence des conflits sur les épidémies [
1]. Aux différents facteurs évoqués on a pu rattacher des constatations épidémiologiques dans des pays en conflit. Il est clair qu’une classification reste artificielle. Plusieurs causes peuvent interagir pour provoquer une épidémie, des causes similaires auront des conséquences différentes selon le pays. Nous citerons les différents facteurs qui ont été recensés, en donnant pour chacun des exemples. |
Les déplacements de populations Des populations ont été déplacées, quelquefois par millions. Au Tadjikistan le paludisme, pratiquement éliminé, est réapparu au retour de réfugiés que la guerre civile avait fait fuir vers l’Afghanistan (sans doute ~ 200 000 cas). Il serait de nouveau en voie de contrôle [
2]. La fièvre de Lassa est une fièvre hémorragique grave transmise par les rongeurs. Elle n’existait plus en Afrique de l’Ouest. Dans les années 1980 elle a de nouveau été endémique en Sierra Leone et au Libéria (~ 200 000 cas, 3 000 à 5 000 décès), puis s’est étendue en Guinée du fait de la prolifération des rongeurs, liée sans doute aux conditions désastreuses de stockage des céréales de l’OMS, qui a au total recensé plus de 2 millions de sujets atteints [
3]. On peut attribuer à un mécanisme similaire, prolifération des rats, les cas de tularémie observés au Kosovo et vérifiés par sérologie en 1999/2000. |
Interruption complète des contrôles Les ruptures brutales d’accès aux soins ont amplifié les incidences de fièvres hémorragiques virales graves [
4]. Cette catégorie regroupe les cas de fièvre d’Ebola en République Démocratique du Congo (RDC) en 1976, au Soudan en 1976 et 1979, puis de nouveau en RDC en 1995 (315 cas, et une mortalité de 81 %) et en Ouganda en 2000 [
5]. A joué ici, pour l’amplification du virus, l’insuffisance des possibilités d’isolement, le manque de stérilisation, d’eau purifiée, l’élimination non contrôlée des déchets. Mais aussi l’insuffisance de formation du personnel, d’où les nombreuses infections nosocomiales et l’atteinte fréquente du personnel de santé. On peut ajouter les conditions d’obsèques et l’hygiène défectueuse des maisons. Ce sont des conditions comparables qui expliquent la maladie de Marburg en Angola (374 cas, mortalité de 89 %) [
6]. Le rôle du personnel de soins est là particulièrement évident, par l’usage multiple des mêmes aiguilles et seringues avec des ampoules multi-doses. Ces pratiques d’emploi de matériel contaminé se retrouvent également comme un des paramètres de l’épidémie de fièvre de Lassa en Sierra Leone [
7]. |
Contrôles insuffisants et collapsus des services de santé Les difficultés logistiques dans les zones de conflit comportent souvent une pénurie ou une pauvreté en matière de laboratoire, un manque de personnel qualifié pour en interpréter les données, des retards dans la transmission des résultats. C’est ce qui explique une résurgence du paludisme en Afghanistan depuis la guerre civile de 1978, le nombre de cas diminuant actuellement grâce à l’emploi thérapeutique de l’artémisine [
8]. Ce sont les mêmes causes qui expliquent la recrudescence de trypanosomiases dans plusieurs pays d’Afrique, Angola, sud du Soudan, RDC. Les chiffres concernant la maladie du sommeil sont particulièrement parlants dans ce dernier cas : En 1933 on avait enregistré plus de 33 000 cas, incidence ramenée par contrôle à environ 1 000 cas par an. L’interruption de ce contrôle s’est traduite par environ 150 000 cas de 1989 à 1996, avec à nouveau une diminution par son rétablissement [
9]. |
Retards dans les diagnostics ou dans les mesures de réponse Les conflits créent toujours des difficultés de transmission et aussi un manque de personnel qualifié, et ces difficultés logistiques favorisent le développement des pathologies. Les difficultés d’accès expliquent le délai de plusieurs mois - et le décès du médecin responsable -, avant que l’épidémie de fièvre hémorragique de Marburg dans le nord-ouest de la RDC, à l’automne 1999 (154 cas, mortalité de 83 %), n’entraîne l’arrivée d’une équipe internationale, alors que l’épidémie était déjà sur son déclin [
10]. Un travail international récent a montré dans ce cas le rôle des chauve-souris comme réservoir du virus [
11]. Nous pouvons en rapprocher les plus de 400 000 cas d’une fièvre non identifiée, entraînant 2 000 décès, signalés en 1998 au Soudan, alors qu’une explosion similaire en 2000 a été contrôlée en l’espace de deux semaines [
12]. |
Difficultés d’accès aux populations concernées L’insécurité qui domine les régions de conflit entrave évidemment l’arrivée des secours médicaux et humanitaires. Cette explication est retenue pour une épidémie de peste pulmonaire en 2004 dans un campement de travailleurs de mine dans le nord-est de la RDC (134 cas, mortalité 43 %) [
13]. L’absence d’une chaîne du froid a empêché la livraison de vaccins et explique la résurgence en 2005 de poliomyélites en Somalie (215 cas), où aucun cas n’avait été observé depuis 2002, ainsi qu’au Soudan (154 cas). La récurrence de la fièvre jaune dans plusieurs pays d’Afrique est aussi en rapport avec l’interruption forcée d’une immunisation systématique [
14]. L’épidémie a débuté en 1990 au Cameroun ; on la signale ultérieurement en Angola, en Sierra Leone, en Côte-d’Ivoire, en Guinée, au Soudan, avec globalement une mortalité de 25 %. |
Développement de résistance au traitement Des diagnostics incomplets, des traitements insuffisants, l’usage de produits périmés sont malheureusement fréquents en zones de conflit, ainsi que le défaut de compliance ou l’impossibilité pour les patients d’acheter les drogues nécessaires. À cela il faut sans doute ajouter que les circonstances suscitent des prescripteurs ou des pharmaciens qui ne sont pas toujours fiables. Des traitements trop courts sont aussi responsables d’une résistance à la tuberculose élevée chez des réfugiés au Kenya ainsi qu’en Somalie. |
Mouvements des réfugiés et des équipe d’aide internationale Les déplacements incessants des hommes, du bétail, mais aussi des personnels d’assistance, ont favorisé la dissémination des pathogènes. S’expliquent ainsi les milliers de cas d’hépatite E dans les camps du Darfour au Soudan, et la diffusion du virus au Tchad [
16]. La reconstruction des pays de l’Ouest africain a coïncidé avec une épidémie de fièvre de Lassa et explique l’importation de cette maladie vers des pays industrialisés. On a signalé des cas importés de Sierra Leone en Allemagne, du Libéria aux États-Unis, mais aussi chez des militaires de Sierra Leone à leur retour en Grande-Bretagne ou aux Pays-Bas. |
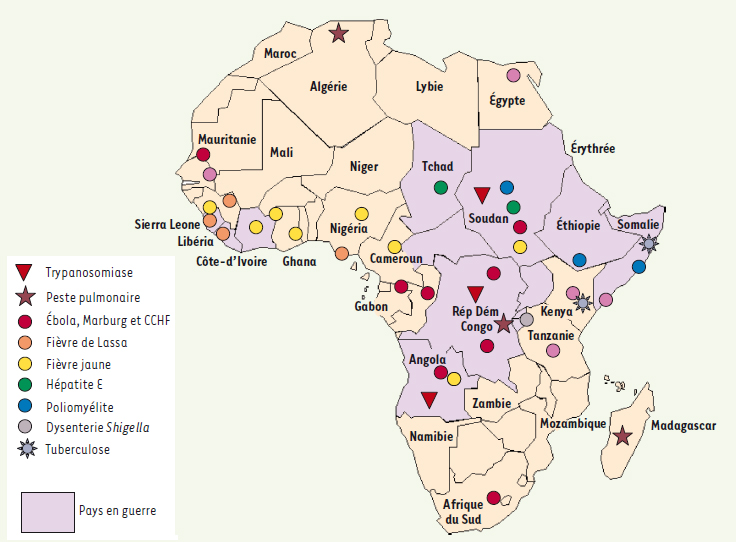
Cet article n’est sûrement pas exhaustif. Il montre cependant la coïncidence évidente entre les zones de conflit et celles où se sont déclarées des épidémies de maladies émergentes. Il montre aussi l’impressionnante concentration sur les pays d’Afrique dans lesquels règne, ou a régné, l’insécurité : Angola, RDC, Rwanda, Ouganda en Afrique Équatoriale, Sierra Leone, Libéria en Afrique de l’Ouest, Soudan, et d’autres… (Figure 1). Elle indique a contrario les mesures à prendre au moins théoriquement, même si ce n’est pas toujours possible. L’observation montre que, partout où on a pu rétablir des conditions sanitaires suffisantes, il y a eu rapidement des résultats souvent chiffrables : régression du paludisme en Asie Centrale, de la trypanosomiase en Afrique au moins partiellement, contrôle des grandes fièvres hémorragiques à mortalité élevée. Les guerres, internationale ou civile, tuent en tant que guerres, mais aussi en faisant subir aux populations de terribles conditions sanitaires.  | Figure 1.
Coïncidence entre zones de conflit et zones où se sont déclarées des épidémies de maladies émergentes.
|
|
1. Gayer M, Legros D, Formenty P, Connolly MA. Conflict and emerging infectious diseases. Emerg Infect Dis 2007; 13 : 1625–31. 2. Allev S, Saparova N. Current malaria situation and its control in Tadjikistan Med Parzitol (Mosk) 2001; 1 : 35–7. 3. Center for Disease Control and Prevention. Fact sheet 25 août 2004. 4. Fisher-Hoch SP. Lessons from nosocomial viral haemorrhagic fever outbreaks. Br Med Bull 2005; 73-74 : 123–37. 5. World Health Organization. Ebola outbreak chronology. Geneva : WHO, 20 février 2007. 6. Ndayimirijen, Kindhauser MK. Marburg hemorrhagic fever in Angola: fighhting fear and a lethal pathogen. N Engl J Med 2005; 352 : 2155–7. 7. World Health Organization. Update on Lassa fever in West Africa. Wkly Epidemiol Rec 2005; 80 : 85–92. 8. World Health Organization. Malaria control programme annual report 2005. Geneva : WHO, 12 avril 2007. 9. Van Nieuwenhove S, Betu-Ku-Mesu VK, Diabakana PM, et al. Sleeping sickness resurgence in the DRC: the past decade. Trop Med Int Health 2001; 6 : 335–41. 10. Bausch DG, Nichol ST, Muyembe-Tarnfurn JJ, et al. for the International Scientific and Technical Committee for Marburg hemorrhagic fever control in the Democratic Republic of the Congo. Marburg hemorrahgic fever associated with multiple genetic lineages of virus. N Engl J Med 2006; 355 : 909–19. 11. Swanepoel R, Smit SB, Rollin PE, et al. and Technical committee for Marburg hemorrhagic fever control in the Democratic Republic of the Congo. Studies of reservoir hosts for Marburg virus. Emerg Infect Dis 2007; 13 : 1807–9. 12. World Health Organization. Early warning and response network (EWARN), southern Sudan. Wkly Epidemiol Rec 2002; 77 : 26–7. 13. Bertherat E, Lamine KM, Formenty P, et al. Major pulmonary plague outbreakin a mining camp in the Democratic Republic of Congo: brutal awakening of an old scourge. Med Trop 2005; 65 : 511–4. 14. World Health Organization. The yellow fever situation in Africa and South America in 2004. Wkly Epidemiol Rec 2005; 80 : 250–6. 15. Paquet C, Leborgne P, Sasse A, Varaine F. Une épidémie de dysenterie à Shigella dysenteriae type 1 dans un camp de réfugiés au Rwanda. Santé 1995; 5 : 181–4. 16. Guthmann JP, Klovstad H, Boccia D, et al. A large outbreak of hepatitis E among a displaced population in Darfur, Sudan, 2004: the role of water treatment methods. Clin Infect Dis 2006; 42 : 1685–91. |