| |
| Med Sci (Paris). 2008 November; 24(11): 916–918. Published online 2008 November 15. doi: 10.1051/medsci/20082411916.Amiante et inflammation, rôle de l’inflammasome Catherine Dostert* and Virginie Pétrilli Département de Biochimie, Université de Lausanne, Chemin des Boveresses 155, 1066 Epalinges, Suisse MeSH keywords: Animaux, Amiante, Protéines de transport, Modèles animaux de maladie humaine, Inflammation, Souris |
L’amiante comprend un ensemble de substances minérales (silicate de calcium ou de magnésium) de texture fibreuse dont la principale caractéristique est de résister au feu, et de posséder des propriétés isolantes. L’exposition répétée aux fibres d’amiante entraîne communément une fibrose pulmonaire ou asbestose, ainsi que l’apparition de tumeurs spécifiques de la plèvre, du péritoine ou du péricarde, les mésothéliomes. Les mésothéliomes se développent après 30 à 40 ans d’exposition aux poussières d’amiante. L’amiante favorise également l’apparition de tumeurs broncho-pulmonaires, deux à cinq fois plus fréquentes que chez des personnes non exposées, après seulement 10 à 20 ans d’exposition [
1]. Des complications similaires sont liées à la silicose, déclenchée par l’inhalation répétée des particules de silice. Dans les deux cas, asbestose et silicose, le développement de la maladie se traduit par une étape initiale d’inflammation. Bien que de nombreuses études épidémiologiques aient démontré la relation causale entre l’amiante et l’apparition de fibroses pulmonaires et de mésothéliomes, les mécanismes biologiques aboutissant à l’inflammation pulmonaire après exposition à l’amiante ou au silice sont à ce jour très peu connus. |
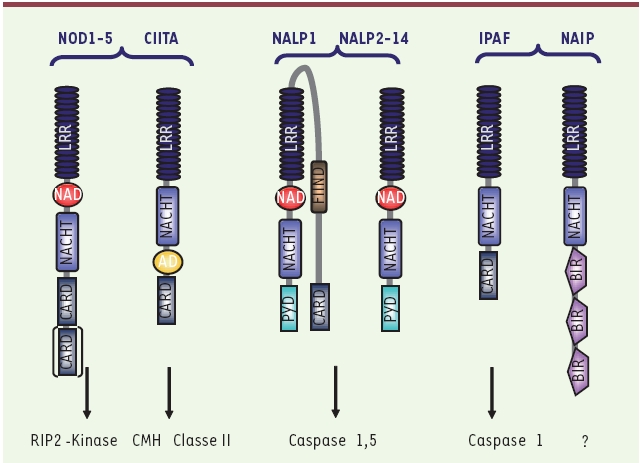
Le récepteur NOD-like Nalp3 des macrophages, un composant de l’inflammasome Les macrophages pulmonaires jouent un rôle primordial dans l’élimination des pathogènes et des corps étrangers au niveau du poumon en ingérant ces composés pour ensuite les détruire. Le contact qui s’établit entre les macrophages et les corps étrangers active des récepteurs cellulaires de l’immunité innée et induit la sécrétion de médiateurs inflammatoires, dont une cytokine pro-inflammatoire essentielle l’interleukine-1β (IL-1β). Un certain nombre de récepteurs cellulaires capables de déclencher une réponse inflammatoire sont exprimés par les macrophages, parmi eux les Toll-like receptors (TLR) [
11] et les NOD-like receptors (NLR) reconnaissent des signatures moléculaires de pathogènes (PAMP) ou des signaux de danger (DAMP, damage associated molecular pattern molecules) comme HMGB1 (high mobility group box 1), ou encore les protéines S100 ou l’ADN [
2] (Figure 1). Un de ces NLR, Nalp3, joue un rôle capital au niveau des macrophages dans la détection d’une variété de PAMP et de DAMP, en induisant notamment la production d’IL-1β [
3].
 | Figure 1.
Récepteurs intracellulaires du système immunitaire inné.Les Nod-like receptors (NLR) font partie de la famille des récepteurs intracellulaires de l’immunité innée. La famille des NLR comprend 22 membres dont les NALP (NACHT, LRR and PYD containing protein), les NOD (nucleotide oligomerisation domain), IPAF (ICE protease activating factor), NAIP (neuronal apoptosis inhibitory protein) et le facteur de transcription CIITA. Chaque sous-famille active des voies de signalisation différentes. LRR : leucine-rich repeat ; NAD : NACHT associated domain ; NACHT : domain present in neuronal apoptosis inhibitory protein (NAIP), the major histocompatibility complex (MHC) class II transactivator (CIITA), HET-E and TP1 ; PYD : Pyrin domain ; CARD : caspase recruitment domain ; BIR : baculovirus inhibitor of apoptosis (IAP) repeat. |
Le récepteur Nalp 3 agit au sein d’un complexe moléculaire appelé « l’inflammasome ». De façon schématique, ce complexe est formé par différentes protéines, le récepteur Nalp3, les adaptateurs, ASC et Cardinal, et la caspase-1, enzyme responsable de la maturation du précurseur proIL-1β en IL-1β active [
4]. Des mutations de Nalp3 sont associées à trois maladies auto-inflammatoires de transmission autosomique dominante – le syndrome de Muckle Wells1, le familial cold auto-inflammatory syndrome (FCAS) et le syndrome chronic infantile neurological cutaneous and articular (CINCA) – qui se caractérisent par des périodes récurrentes de fièvre sans infection associée, accompagnées d’une sécrétion d’IL-1β élevée [
5]. |
La « phagocytose frustrée » des fibres d’amiante Nalp3 est capable de détecter différents signaux associés à des pathogènes, mais également des signaux de danger, comme l’ATP ou les cristaux d’urate monosodique (MSU), qui sont à l’origine d’une maladie inflammatoire fréquente, la goutte [
6]. L’amiante étant également une structure cristalline, nous avons voulu analyser ses capacités à activer l’inflammasome. Après exposition aux fibres d’amiante, les macrophages humains et murins produisent de fortes quantités d’IL-1β et ceci sous le contrôle de l’inflammasome Nalp3 [
7]. De façon similaire aux cristaux de MSU, les fibres d’amiante déclenchent un efflux de potassium de la cellule, nécessaire à l’activation de Nalp3 par un mécanisme qui reste cependant encore inconnu (Figure 2). Les cristaux d’urate, de même que les fibres d’amiante, vont être phagocytés par les macrophages, ou du moins, les macrophages vont essayer de phagocyter ces particules sans toutefois parvenir à les ingérer complètement ni à les éliminer, un phénomène connu sous le nom de « phagocytose frustrée ». La déstabilisation du cytosquelette d’actine (responsable de la phagocytose) par la cytochalasine D empêche l’activation de l’inflammasome par l’amiante et la production d’IL-1β, démontrant le rôle essentiel de la phagocytose dans l’activation de l’inflammasome Nalp3. L’amiante est également capable d’induire la production des espèces réactives de l’oxygène dans la cellule et le traitement des cellules avec des antioxydants empêche la production d’IL-1β en réponse aux activateurs de l’inflammasome. La source de ces dérivés réactifs de l’oxygène durant la phagocytose pourrait être l’activation d’un complexe membranaire appelé NADPH oxydase, une enzyme activée par la phagocytose des bactéries [
12]. L’inhibition pharmacologique de la NADPH oxydase (par le diphénylène iodonium) et son inactivation par réduction de l’expression de la sous-unité p22phox par ARN interférence, diminuent fortement la production d’IL-1β mature en réponse à l’amiante. Enfin, la réduction de l’expression d’une protéine cellulaire impliquée dans la détoxification des dérivés réactifs de l’oxygène, la thiorédoxine, aboutit, à l’inverse, à une production accrue d’IL-1β en réponse à l’amiante et à la silice.
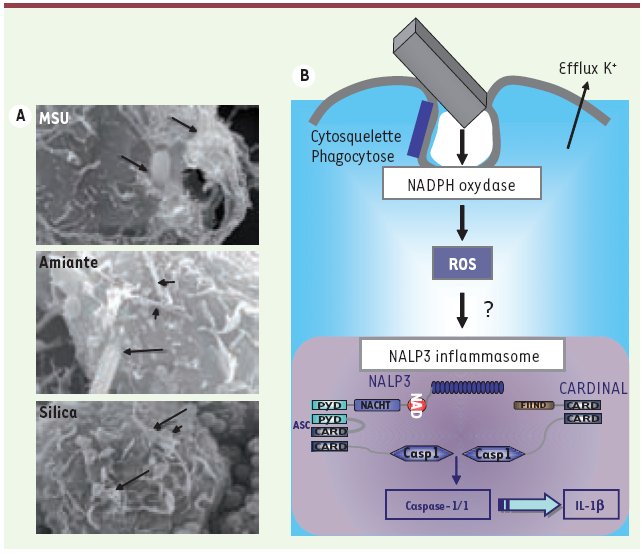
 | Figure 2.
Activation de l’inflammasome Nalp 3 par l’amiante. A.Macrophages humains exposés à des particules de MSU, d’amiante ou de silice. Les flèches indiquent les particules entrant dans la cellule. B. L’amiante est phagocytée par les macrophages, induisant l’activation de la NADPH oxydase et la production de dérivés réactifs d’oxygène (ROS). Ces événements activent l’inflammasome Nalp3, ce qui résulte dans la production d’interleukine-1β (IL-1β) pro-inflammatoire. |
|
Modèle in vivo d’exposition à l’amiante Afin d’étudier les conséquences sur l’asbestose de l’inactivation de Nalp3 in vivo, nous avons utilisé un modèle murin d’inhalation de fibres d’amiante. L’exposition à l’amiante de souris de génotype sauvage induit un recrutement de cellules inflammatoires dans les poumons, indiquant une réaction inflammatoire. En revanche, dans les poumons des souris déficientes en Nalp3, ce recrutement de cellules inflammatoires est fortement réduit, de même que la production d’un certain nombre de cytokines, soulignant l’importance de l’inflammasome Nalp3 dans cette pathologie. |
Inhiber l’IL-1, une perspective thérapeutique ? L’ensemble de ces résultats démontrent que la phase inflammatoire induite par l’inhalation de fibres d’amiante est relayée par l’inflammasome Nalp3 et dépendante de la production d’IL-1β. Des travaux similaires ont démontré le rôle capital de l’inflammasome dans le développement de la silicose [
8]. L’usage d’un inhibiteur naturel de l’IL-1, antagonisant le récepteur de l’IL-1, l’Anakinra, pourrait se révéler extrêmement efficace dans le cadre du traitement de l’asbestose et de la silicose. Cet inhibiteur est déjà utilisé efficacement dans le traitement d’autres maladies associées à Nalp3, comme la goutte [
9] et les maladies auto-inflammatoires tel le syndrome de Muckle-Wells [
10]. Nalp3 s’avère être une cible intéressante pour le développement de nouveaux médicaments visant à traiter les pathologies inflammatoires. |
Footnotes |
1. Mossman BT, Churg A. Mechanisms in the pathogenesis of asbestosis and silicosis. Am J Respir Crit Care Med 1998; 157 : 1666–80. 2. Fritz JH, Ferrero RL, Philpott DJ, Girardin SE. Nod-like proteins in immunity, inflammation and disease. Nat Immunol 2006; 7 : 1250–7. 3. Petrilli V, Dostert C, Muruve DA, Tschopp J. The inflammasome : a danger sensing complex triggering innate immunity. Curr Opin Immunol 2007; 19 : 615–22. 4. Martinon F, Burns K, Tschopp J. The inflammasome : a molecular platform triggering activation of inflammatory caspases and processing of proIL-beta. Mol Cell 2002; 10: 417–26. 5. Stojanov S, Kastner DL. Familial autoinflammatory diseases : genetics, pathogenesis and treatment. Curr Opin Rheumatol 2005; 17 : 586–99. 6. Martinon F, Petrilli V, Mayor A, et al. Gout-associated uric acid crystals activate the NALP3 inflammasome. Nature 2006; 440 : 237–41. 7. Dostert C, Petrilli V, Van Bruggen R, et al. Innate immune activation through Nalp3 inflammasome sensing of asbestos and silica. Science 2008; 320 : 674–7. 8. Cassel SL, Eisenbarth SC, Iyer SS, et al. The Nalp3 inflammasome is essential for the development of silicosis. Proc Natl Acad Sci USA 2008; 105 : 9035–40. 9. So A, De Smedt T, Revaz S, Tschopp J. A pilot study of IL-1 inhibition by anakinra in acute gout. Arthritis Res Ther 2007; 9 : R28. 10. Hawkins PN, Lachmann HJ, McDermott MF. Interleukin-1-receptor antagonist in the Muckle-Wells syndrome. N Engl J Med 2003; 348 : 2583–4. 11. Delneste Y, Beauvillain C, Jeannin P. Immunité naturelle : structure et fonction des Toll-like receptors. Med Sci (Paris) 2007; 23 : 67–73. 12. Guichard C, Pedruzzi E, Fay M, et al. Les Nox/Duox : une nouvelle famille de NADPH oxydases. Med Sci (Paris) 2006; 22 : 953–9. |