| |
| Med Sci (Paris). 2008 October; 24(10): 828–832. Published online 2008 October 15. doi: 10.1051/medsci/20082410828.Survivine, la petite reine du complexe passager Chek-up pour son dixième anniversaire Marlène Delacour-Larose,* Thi My Nhung Hoang, and Annie Molla* Inserm U823, Institut Albert Bonniot, Université Joseph Fourier, Domaine de la Merci, 38706 La Tronche Cedex, France |
Survivine a été décrite pour la première fois il y a dix ans [
1]. Son nom découle de la fonction première qui lui a été attribuée, celle d’une protéine inhibitrice de l’apoptose (pour revue, voir [
2]). Plus récemment, D. Skoufias et ses collaborateurs ont montré que Survivine était l’une des composantes du complexe passager [
3]. |
Le complexe passager est composé des protéines INCENP, Boréaline, Aurora B et Survivine [
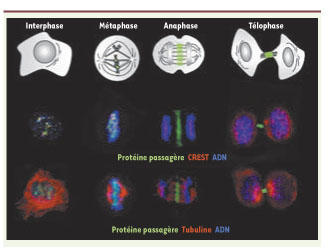
4]. Son expression est restreinte à la mitose et sa localisation est tout à fait singulière. Il voyage des chromosomes vers le cytosquelette (Figure 1). En effet on repère ses composants sur la chromatine péricentromérique en phase G2, puis sur les chromosomes en prophase. Rapidement il se concentre sur les centromères en métaphase. Lors de la transition métaphase/anaphase, il est transféré sur le réseau microtubulaire où il séjourne jusqu’en fin de mitose. En cytodiérèse, il décore le corps intermédiaire qui relie les deux cellules filles puis il disparaît. La particularité du complexe est son interdépendance ; l’invalidation d’un de ses membres conduit à une perte de fonction et à la dégradation des autres composants. L’invalidation de la Survivine ou de la kinase Aurora B par ARN interférence induit des défauts mitotiques majeurs : non-alignement sur la plaque métaphasique, problème de ségrégation équitable des chromosomes et augmentation de la ploïdie cellulaire (Figure 2). Ces expériences confirment le rôle clé de Survivine et de ses partenaires au cours de la mitose. 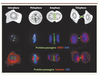 | Figure 1.
Localisation des protéines passagères au cours du cycle cellulaire. Deux expériences de microscopie de fluorescence sont représentées. Les protéines passagères sont visualisées en vert et l’ADN en bleu. Dans la partie supérieure, la chromatine péri-centromérique puis les centromères sont repérés par un auto-anticorps humain CREST fluorescent en rouge. Dans la partie inférieure, le réseau de microtubules est visible en rouge. La localisation des protéines passagères est rappelée en vert sur le schéma des différentes phases de la mitose (en haut). En interphase, les passagères sont faiblement exprimées et on les devine dans la chromatine peri-centromérique. Au cours de la métaphase, les protéines passagères se localisent sur les centromères puis elles sont transférées sur le réseau de microtubules. |
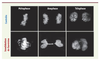 | Figure 2.
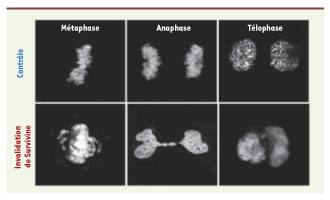
Effet de l’invalidation de Survivine. L’invalidation de Survivine par ARN interférence crée des défauts mitotiques majeurs : mauvais alignement des chromosomes sur la plaque métaphasique en métaphase, ADN présent dans le sillon de division en anaphase et télophase. L’ADN de cellules contrôles et de cellules déficientes en Survivine est visualisé en fluorescence. |
|
Caractéristiques des composants de ce complexe INCENP (inner centromere protein antigens 135/155kDa) est l’ancêtre des protéines passagères, cette protéine ancre le complexe dans ses diverses destinations [
5] ; Boréaline est la petite dernière, identifiée en 2004 [
6]. Aurora B est le seul membre à activité enzymatique; c’est une kinase mitotique membre de la famille des Aurora kinases [
7]. Survivine est la plus petite protéine du complexe [
8,
9]. Elle est très conservée au cours de l’évolution avec 90 % d’identité chez les mammifères. Survivine a un poids moléculaire apparent d’environ 17 KDa et un pI de 5,7 ; sa structure est singulière car elle possède un domaine à doigt de zinc de type BIR (BIR pour Baculoviral IAP repeat) qui s’étend entre les acides aminés 15 et 87 et une longue hélice alpha dans sa partie carboxy-terminale (Figure 3). Un motif de localisation nucléaire fonctionnel (NES) a été décrit récemment, suggérant un transport nucléaire actif via le récepteur d’export nucléaire Exportine [
10]. Survivine est le siège de nombreuses modifications post-traductionnelles (Figure 3) : phosphorylations sur les résidus S20, T34 et T117, ubiquitinylation en K48 et K63 ; certaines modifications sont essentielles pour l’activité du complexe passager comme nous le verrons par la suite [
11]. TD60, un membre de la famille des facteurs d’échange du GTP, est quelquefois inclus dans le complexe passager. TD60 partage la même localisation que les protéines passagères au cours de la mitose mais n’a pas d’interaction forte avec les autres membres [
12]. Par sa présence TD60 participe à l’activation de la kinase Aurora B [
13]. 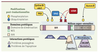 | Figure 3.
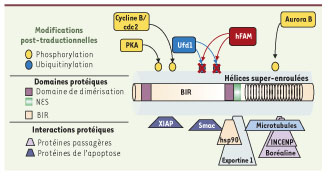
Description de la protéine Survivine. Sur une vue schématique de la protéine Survivine sont indiqués les domaines protéiques identifiés, les interactions protéiques décrites ainsi que les modifications post-traductionnelles. Survivine est phosphorylée sur la sérine 20 par la protéine kinase A, par Cdc2/Cycline B sur la thréonine 34 et sur la thréonine 117 par Aurora B. Les principaux sites d’ubiquitinylation par le complexe p97-NP14-Ufd1 sont les lysines 48 et 63 ; la désubiquitinylation est assurée par hFAM. L’ubiquitinylation de K48 est liée à la dégradation de Survivine tandis que l’ubiquitinylation de K63 est importante pour sa localisation. Nous n’avons pas indiqué l’interaction de Survivine avec Aurora B car il n’y a pas de consensus. |
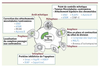 | Figure 4.
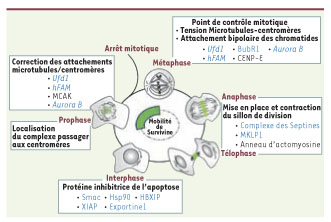
Fonctions et propriétés de Survivine. Les schémas des cellules au cours de la division cellulaire rappellent la localisation particulière de Survivine (en vert). Les fonctions des protéines passagères sont indiquées pour chaque étape. Survivine s’échange rapidement au sein du complexe passager et ce jusqu’à la transition métaphase/anaphase. Cette mobilité propre à Survivine est indiquée au centre du schéma. Les moteurs importants pour chaque étape sont répertoriés et les protéines directement liées à Survivine ou à son action sont en bleu et les enzymes la modifiant en italique. |
|
Les partenaires de Survivine au sein du complexe passager Au sein du complexe, Survivine participe à l’activation de la kinase Aurora B. La partie carboxy-terminale de Survivine recrute les autres partenaires : INCENP et Boréaline (Figure 3). Tous deux interagissent, par leur domaine amino-terminal, directement avec la protéine Survivine. La stabilité de ce complexe a été étudiée par des expériences de microscopie en cellules vivantes : le FRAP (recouvrement de fluorescence après photoblanchiement) [
14,
15]. Les protéines INCENP, Aurora B et Boréaline sont ancrées sur les chromosomes puis sur les microtubules et ne présentent pas de mobilité apparente [15]. La protéine Survivine est fortement mobile en métaphase et perd cette capacité lors du transfert sur les microtubules. Ces données suggèrent d’une part qu’un changement de conformation du complexe passager a lieu lors de sa relocalisation et d’autre part que Survivine joue un rôle pivot au sein du complexe. Survivine pourrait réguler l’avancement de la mitose. |
Les fonctions de Survivine Localisation du complexe Les questions des mécanismes de la localisation et du recrutement du complexe passager sur les centromères sont ouvertes. Il a été décrit qu’une protéine chimérique Survivine-INCENPt (INCENPt : INCENP tronquée de son domaine de liaison aux centromères) était correctement localisée et recrutait Aurora B même en l’absence de Boréaline [
16]. Survivine participe au ciblage du complexe sur les centromères et ses modifications post-traductionnelles influencent sa localisation. Survivine subit un cycle d’ubiquitinylation/désubiquitinylation sur K63 au voisinage des centromères ; de plus elle est phosphorylée en T117 par Aurora B et la forme phosphorylée a une faible affinité pour les centromères. Cette phosphorylation sur T117 est nécessaire au déclenchement de l’anaphase. L’hypothèse a été émise selon laquelle la désubiquitynylation de K63 et la phosphorylation de T117 auraient un rôle dans la dissociation de la protéine Survivine des centromères [
17]. Mise en place du fuseau mitotique La formation du fuseau mitotique et l’interaction microtubules / kinétochores qui conduit à l’attachement de chaque chromatide-sœur à un pôle opposé du fuseau sont des processus dynamiques et hautement contrôlés [
18]. La cellule déclenche l’anaphase lorsque la tension du fuseau est suffisante. L’activité de la kinase Aurora B est requise pour assurer la dépolymérisation des microtubules au voisinage des attachements syntéliques (deux chromatides sœurs liées au même pôle du fuseau) tandis que le couple INCENP/Survivine assurerait la connexion entre le centromère et les microtubules [
19]. INCENP/Survivine aurait un rôle mécanique et serait un senseur de la tension du fuseau [
20]. Il est à noter que ces données ont été obtenues chez la levure bourgeonnante où la protéine Bir1p (homologue de Survivine) est de grande taille et pourrait combiner les activités de Survivine et de Boréaline. De plus, Altieri et ses collaborateurs suggèrent l’existence d’une fraction de Survivine libre, non liée au complexe passager, qui se localise sur les microtubules et participe à la formation du fuseau [ 9]. Toutefois cette fraction n’est pas détectable en microscopie de fluorescence, il est probable qu’elle soit minoritaire. Activateur du point de contrôle du fuseau Au cours de la division cellulaire, la cellule doit traverser un point de contrôle qui valide la poursuite de la mitose. Ce contrôle précède la transition métaphase/anaphase. À cette étape, la cellule doit satisfaire deux contrôles qualité : la tension entre le fuseau et les centromères doit être suffisante et les chromatides sœurs doivent être liées à deux pôles opposés. Lorsque ces deux critères sont remplis, le point de contrôle est éteint, induisant l’activation du cyclosome ou complexe de dégradation encore nommé APC ( anaphase promoting complex) et l’anaphase est déclenchée [
21,
22]. On note le départ des protéines BubR1 et Mad2 des kinétochores et l’effondrement du taux de cycline B. Toute invalidation d’une protéine passagère conduit à un défaut d’activation du point de contrôle et à un échappement mitotique sans ségrégation des chromosomes. Survivine participe à l’activation du point de contrôle en maintenant BubR1 sur les kinétochores [
23,
24]. La gestion du point de contrôle du fuseau est l’action majeure du complexe passager en mitose car c’est la dernière possibilité pour faire avorter une division cellulaire anormale. Cytodiérèse Dès le début de l’anaphase un réseau d’acto-myosine circulaire se met en place. En connexion avec les microtubules, ce réseau constitue une matrice cytosquelettique appelé anneau contractile qui délimite la future zone de clivage entre les deux cellules filles. Les protéines Septines, famille de protéines liant le GTP, assurent la régionalisation de la membrane plasmique et concentrent la machinerie nécessaire à la scission. Chez la levure bourgeonnante, il a été montré que Bir1p, homologue de Survivine, participait à l’organisation des Septines et donc à la mise en place de cette barrière membranaire [
25]. Au cours de la télophase, Survivine est phosphorylée sur la thréonine 117 et ces formes phosphorylées se concentrent en périphérie du corps intermédiaire [
26]. De façon intéressante, dans cette région distale du corps résiduel, coexistent la phospho-Survivine et MKPL-1, un moteur moléculaire microtubulaire. MKPL-1, composant de la matrice cytosquelettique du corps intermédiaire, est un substrat de la kinase Aurora B [ 25]. Les mutants ponctuels de Survivine, T34A, DD7071AA et T117E, présentent une délocalisation de MKPL1 et des défauts de scission suggérant un rôle clé de Survivine au cours de la cytodiérèse [ 25,
27]. Au cours de la mitose Survivine a des fonctions particulières, mais son action est interconnectée à celle des autres membres du complexe passager et est tout particulièrement dépendante de l’activité kinase d’Aurora B. Il est probable que Survivine n’interagit pas directement avec la kinase Aurora B. Des données sur l’agencement du complexe émergent des études de cristallographie. La cristallisation de Survivine en présence d’ions zinc et en l’absence de ses partenaires suggérait l’existence d’un homo-dimère [27] ; des données biochimiques et de microscopie in cellulo sont compatibles avec cette forme dimérique. Très récemment de nouvelles données cristallographiques ont été publiées [
28] ; les auteurs ont cristallisé Survivine en présence des parties amino-terminales de Boréaline et d’INCENP et décrivent un chœur de trois hélices alpha parallèles. Dans cette configuration, Survivine interagit avec INCENP et Boréaline par sa longue hélice super-enroulée. Elle se retrouve encadrée par ses partenaires et il est actuellement difficile d’expliquer, dans un tel agencement, comment Survivine peut être mobile. Il est toutefois probable qu’il existe plusieurs conformations du complexe passager au cours de la mitose. Au cours de la transition métaphase/anaphase, la cellule traverse un point de contrôle et c’est une étape irréversible. À ce stade Survivine perd sa mobilité et l’on peut envisager que cela corresponde à un changement conformationnel du complexe passager. Cette transition nécessite l’activité maximale de la kinase Aurora B, activité dépendante de la présence de ses partenaires Survivine et INCENP. L’échappement mitotique observé lors de l’inhibition de la kinase, ou en l’absence d’un partenaire, est compatible avec cette hypothèse d’un changement de conformation lorsque l’activité kinase est maximale. |
Survivine est une protéine aux multiples facettes ; elle a une activité anti-apoptotique, participe via Hsp90 à la réponse au stress et est un régulateur mitotique de tout premier plan. L’activité mitotique semble prépondérante sur l’activité anti-apoptotique. Survivine appartient au complexe passager. Au sein de ce complexe elle assure la connexion entre les centromères et les microtubules et participe à l’alignement des chromosomes sur la plaque métaphasique. Par sa possible fonction de senseur de la tension du fuseau, elle maintient allumé le point de contrôle mitotique et joue un rôle prépondérant dans le déclenchement de l’anaphase. Cette transition métaphase/anaphase s’accompagne à la fois d’un changement de localisation du complexe passager et d’une modification conformationnelle mise en évidence par la perte de mobilité de Survivine. Au cours de la cytodiérèse, Survivine relie le complexe mitotique à la machinerie de scission. Survivine au chœur du complexe passager est donc la protéine reine de ce régulateur mitotique. |
Nous sommes reconnaissants à La ligue Contre le Cancer (équipe Dimitrov labellisée) et l’Agence Nationale de la Recherche (R05075CC), la cancéropôle Rhône-Alpes CLARA (programme EPIPRO), l’Université Joseph Fourier et l’INSERM pour leur soutien. Nous remercions nos collègues de la plateforme de microscopie de l’IAB pour leur disponibilité et la qualité des équipements et le Dr Stéfan Dimitrov pour ses encouragements. TMNH est bénéficiaire d’une bourse ARC.
|
Footnotes |
1. Ambrosini G, Adida C, Altieri DC. A novel anti-apoptosis gene, survivin, expressed in cancer and lymphoma. Nat Med 1997; 3 : 917–21. 2. Romagnoli M SC, Bataille R Barillé-Nion S. Survivine, la petite reine du complexe passager : chek-up pour son dixième anniversaire. Med Sci (Paris) 2008; 24 : 821–7. 3. Skoufias DA, Mollinari C, Lacroix FB, et al. Human survivin is a kinetochore-associated passenger protein. J Cell Biol 2000; 151 : 1575–82. 4. Ruchaud S, Carmena M, Earnshaw WC. Chromosomal passengers: conducting cell division. Nat Rev Mol Cell Biol 2007; 8 : 798–812. 5. Cooke CA, Heck MM, Earnshaw WC. The inner centromere protein (INCENP) antigens: movement from inner centromere to midbody during mitosis.J Cell Biol 1987; 105 : 2053–67. 6. Gassmann R, Carvalho A, Henzing AJ, et al. Borealin: a novel chromosomal passenger required for stability of the bipolar mitotic spindle. J Cell Biol 2004; 166 : 179–91. 7. Carmena M, Earnshaw WC. The cellular geography of aurora kinases. Nat Rev Mol Cell Biol 2003; 4 : 842–54. 8. Lens SM, Vader G, Medema RH. The case for Survivin as mitotic regulator. Curr Opin Cell Biol 2006; 18 : 616–22. 9. Altieri DC. The case for survivin as a regulator of microtubule dynamics and cell-death decisions. Curr Opin Cell Biol 2006; 18 : 609–15. 10. Knauer SK, Bier C, Habtemichael N, et al. The Survivin-Crm1 interaction is essential for chromosomal passenger complex localization and function. EMBO Rep 2006; 7 : 1259–65. 11. Bolton MA, Lan W, Powers SE, et al. Aurora B kinase exists in a complex with survivin and INCENP and its kinase activity is stimulated by survivin binding and phosphorylation. Mol Biol Cell 2002; 13 : 3064–77. 12. Mollinari C, Reynaud C, Martineau-Thuillier S, et al. The mammalian passenger protein TD-60 is an RCC1 family member with an essential role in prometaphase to metaphase progression. Dev Cell 2003; 5 : 295–307. 13. Rosasco-Nitcher SE, Lan W, Khorasanizadeh S, et al. Centromeric Aurora-B activation requires TD-60, microtubules, and substrate priming phosphorylation. Science 2008; 319 : 469–72. 14. Delacour-Larose M, Molla A, Skoufias DA, et al. Distinct dynamics of Aurora B and Survivin during mitosis. Cell Cycle 2004; 3 : 1418–26. 15. Delacour-Larose M, Thi MN, Dimitrov S, et al. Role of survivin phosphorylation by aurora B in mitosis. Cell Cycle 2007; 6 : 1878–85. 16. Vader G, Medema RH, Lens SM. The chromosomal passenger complex: guiding Aurora-B through mitosis. J Cell Biol 2006; 173 : 833–7. 17. Vong QP, Cao K, Li HY, et al. Chromosome alignment and segregation regulated by ubiquitination of survivin. Science 2005; 310 : 1499–504. 18. Kotwaliwale C, Biggins S. Microtubule capture: a concerted effort. Cell 2006; 127 : 1105–8. 19. Lampson MA, Renduchitala K, Khodjakov A, et al. Correcting improper chromosome -spindle attachments during cell division. Nat Cell Biol 2004; 6 : 232–7. 20. Sandall S, Severin F, McLeod IX, et al. A Bir1-Sli15 complex connects centromeres to microtubules and is required to sense kinetochore tension. Cell 2006; 127 : 1179–91. 21. Bornens M. Mitose: entrée, sortie et issues de secours. Med Sci (Paris) 2003; 19 : 259–61. 22. Castro A, Vigneron S, Lorca T, et al. La mitose sous surveillance. Med Sci (Paris) 2003; 19 : 309–17. 23. Lens SM, Wolthuis RM, Klompmaker R, et al. Survivin is required for a sustained spindle checkpoint arrest in response to lack of tension. EMBO J 2003; 22 : 2934–47. 24. Lens SM, Medema RH. The survivin/Aurora B complex: its role in coordinating tension and attachment. Cell Cycle 2003; 2 : 507–10. 25. Thomas S, Kaplan KB. A Bir1p Sli15p kinetochore passenger complex regulates septin organization during anaphase. Mol Biol Cell 2007; 18 : 3820–34. 26. Wheatley SP, Barrett RM, Andrews PD, et al. Phosphorylation by aurora-B negatively regulates survivin function during mitosis. Cell Cycle 2007; 6 : 1220–30. 27. Chantalat L, Skoufias DA, Kleman JP, et al. Crystal structure of human survivin reveals a bow tie-shaped dimer with two unusual alpha-helical extensions. Mol Cell 2000; 6 : 183–9. 28. Jeyaprakash AA, Klein UR, Lindner D, et al. Structure of a Survivin-Borealin-INCENP core complex reveals how chromosomal passengers travel together. Cell 2007; 131 : 271–85. |