| |
| Med Sci (Paris). 2008 January; 24(1): 61–64. Published online 2008 January 15. doi: 10.1051/medsci/200824161.
Scrib, un gène suppresseur de tumeurs impliqué dans la polarité cellulaire Naël Osmani and Sandrine Etienne-Manneville* Groupe Polarité et Migration Cellulaires, Institut Pasteur, 25, rue du Docteur Roux, 75724 Paris Cedex15, France |
Polarité cellulaire et développement tumoral Les cellules tumorales sont généralement caractérisées par leur forte capacité à proliférer. Cependant une autre caractéristique essentielle des cellules tumorales est la perte de polarité, particulièrement évidente dans les tumeurs d’origine épithéliale. En effet, les cellules épithéliales présentent normalement un axe de polarité apico-basal selon lequel l’ensemble de la machinerie cellulaire (cytosquelette, trafic membranaire…) est organisé, et qui est indispensable à la fonction de barrière des épithéliums. L’importance de la polarité cellulaire ne se limite pas aux seules cellules épithéliales ; c’est un aspect essentiel de la biologie de tous les types cellulaires chez les organismes uni- ou pluricellulaires, que ce soit au cours du développement ou chez l’adulte. La polarité joue, en particulier, un rôle fondamental au cours de la migration et de la division cellulaire. Pour se déplacer, une cellule doit présenter une organisation polarisée avec une zone protrusive qui définit l’avant de la cellule, et une région en rétraction correspondant à l’arrière. Dans le cas de la division cellulaire, le fuseau mitotique définit un axe de polarité qui est déterminé par l’adhérence des cellules au substrat. La formation du fuseau et son positionnement correct permettent une répartition équitable du matériel génétique entre les deux cellules filles. Ainsi, le dérèglement de la polarité pourrait jouer un rôle clé dans le développement et l’évolution des tumeurs malignes en affectant le contrôle de la migration et de la division cellulaires et, indirectement, celui de la stabilité génétique. La perte d’expression de certains gènes, appelés gènes suppresseurs de tumeurs, est responsable du développement de tumeurs et de la formation de métastases. De nombreuses études ont démontré le rôle de ces gènes suppresseurs de tumeur dans le contrôle du cycle cellulaire, permettant ainsi d’expliquer la prolifération exacerbée des cellules tumorales. Plus récemment, les gènes suppresseurs de tumeurs ont aussi été impliqués dans le contrôle de la polarité cellulaire [
1–
12]. Parmi ceux-ci, Scribble a initialement été identifié comme gène suppresseur de tumeur chez la drosophile et joue un rôle clé dans la polarité des cellules épithéliales [
13]. Récemment, Scrib, son orthologue chez les mammifères, a été impliqué dans le contrôle de la polarité des cellules épithéliales et des astrocytes en migration [
14,
15]. Ces travaux ont aussi permis de mieux caractériser le rôle de Scrib en le reliant à la petite protéine G Cdc42, acteur central du contrôle de la polarité cellulaire. |
Scribble : de la drosophile à la migration astrocytaire Chez la drosophile, les mutations nulles de Scribble induisent une croissance anarchique et une désorganisation des tissus épithéliaux comme l’épiderme, les follicules ovariens ou les disques imaginaux, et définissent donc ce gène comme suppresseur de tumeurs [
16]. La protéine Scribble est localisée sur les membranes baso-latérales du coté basal des jonctions des cellules épithéliales de drosophile et contribue à délimiter les domaines apicaux et baso-latéraux et la position des jonctions cellulaires [
17]. Outre son rôle dans la polarité des cellules épithéliales, Scribble est nécessaire à la différenciation des neuroblastes et au fonctionnement des synapses [
4]. La comparaison des séquences montre que Scribble est fortement conservée au cours de l’évolution, et des études récentes indiquent que sa fonction de suppresseur de tumeurs serait aussi conservée chez les mammifères [13]. Scrib a été impliquée dans le contrôle de la polarité planaire chez la souris [
18,
19]. Puis son rôle dans le contrôle de la polarité baso-apicale des cellules épithéliales a été étudié. Scrib est localisée au niveau des membranes latérales, et son inhibition altère les jonctions adhérentes des cellules épithéliales MDCK sans perturber significativement la polarité baso-apicale de ces cellules [
20]. Cependant, en l’absence de Scrib, les cellules acquièrent une apparence de cellules mésenchymateuses, migrent plus rapidement et de manière aléatoire. Le rôle de Scrib dans le contrôle de la polarité au cours de la migration cellulaire a été confirmé dans un autre type cellulaire, les astrocytes [14]. Scrib, normalement localisée au niveau des jonctions cellulaires, est recrutée dès l’initiation de la migration au front de migration des cellules épithéliales et des astrocytes [14, 15] (Figure 1). La déplétion de la protéine endogène par une approche d’interférence ARN inhibe la réorientation du centrosome et de l’appareil de Golgi vers le front de migration démontrant le rôle de Scrib dans la polarisation des cellules. La surexpression ou la délocalisation de Scrib perturbe aussi l’orientation des cellules et induit la formation de multiples régions protrusives [14]. Cela suggère que la localisation de Scrib est un aspect essentiel de sa régulation lors de la polarisation cellulaire. L’ensemble des résultats obtenus démontre que Scrib est une molécule fonctionnellement conservée contrôlant la polarité cellulaire. Ce suppresseur de tumeurs a une fonction essentielle dans le contrôle de la polarité cellulaire et la perte de cette fonction pourrait contribuer au développement tumoral. Alors que les études menées chez D. melanogaster n’ont pas encore permis d’élucider les bases moléculaires du rôle de Scribble dans la polarité cellulaire, le modèle in vitro de migration dirigée des astrocytes [
21] nous a permis d’étudier en détail la fonction de Scrib dans le contrôle de la polarité cellulaire.  | Figure 1.
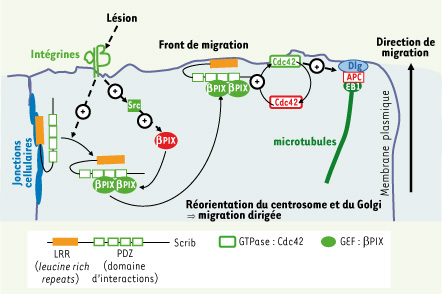
Scrib et βPIX contrôlent la polarité cellulaire au cours de la migration astrocytaire. Représentation de la cascade de signalisation induite à l’avant des cellules qui bordent la lésion. La lésion de la monocouche induit l’activation des intégrines à la membrane plasmique bordant la lésion. L’activation des intégrines conduit d’une part au recrutement de Scrib au front de migration et d’autre part à l’activation de la tyrosine kinase Src. Scrib contribue avec Src au recrutement et à l’activation du facteur d’échange βPIX. βPIX actif permet alors le recrutement et l’activation de Cdc42 ce qui détermine une région protrusive qui devient l’« avant » de la cellule en migration. L’activation de Cdc42 induit également la localisation d’APC aux extrémités « plus » des microtubules et de Dlg à la membrane plasmique. L’interaction entre APC et Dlg au niveau du front de migration conduit à la polarisation des cellules : réorientation des microtubules, du centrosome, de l’appareil de Golgi dans la direction de la migration (les protéines inactives sont en rouge ; les protéines actives sont en vert ; ⊕ indique l’activation d’une protéine.) |
|
L’interaction cruciale de Scrib avec le facteur d’échange βPIX
Scrib code une protéine d’échafaudage moléculaire associée à la membrane plasmique, et contient notamment un domaine LRR, essentiel à la localisation correcte de la protéine [
22,
23]. Ce domaine permet, entre autres, son interaction avec Lgl [
24], l’orthologue de Lethal giant larvae, un autre suppresseur de tumeurs génétiquement lié à Scribble chez la drosophile. Scrib possède aussi quatre domaines PDZ (post synaptic disc-large zona ou zonula occludens)
1, [16,
25]. La délétion du domaine LRR entraîne la délocalisation de Scrib et perturbe la polarisation cellulaire. De même les domaines PDZ semblent absolument nécessaires à la fonction de Scrib car leur suppression ou leur surexpression bloque totalement la polarisation des astrocytes en migration [14]. Les domaines PDZ permettent la liaison de nombreux partenaires parmi lesquels la protéine βPIX [
26]. Dans les astrocytes, Scrib interagit de manière constitutive avec βPIX et cette interaction augmente au cours de la polarisation des cellules. Les deux protéines colocalisent à la membrane plasmique au niveau du front de migration et Scrib est nécessaire au recrutement et au maintien de βPIX à la membrane plasmique (Figure 1). L’interaction entre Scrib et βPIX est essentielle à la polarisation astrocytaire. Ainsi, l’expression d’une forme tronquée de βPIX de laquelle est absent le domaine d’interaction avec Scrib, inhibe complètement la réorientation du MTOC (microtubule-organizing center) et la protrusion cellulaire. Enfin, l’inhibition de l’expression de βPIX par interférence ARN induit un phénotype tout à fait similaire à celui causé par la suppression de Scrib. βPIX a été identifiée comme partenaire de PAK (p21-activated kinase), une kinase effectrice des petites protéines G Cdc42 et Rac [
27]. Ces petites protéines G existent sous une forme active liée au GTP et une forme inactive liée au GDP. Leur activation peut être induite par des facteurs d’échange (GEF) qui catalysent l’échange du GDP par du GTP. βPIX a été initialement décrite comme potentiel facteur d’échange à la fois pour Rac et Cdc42, et son activité est régulée par phosphorylation et semble être plus spécifiquement dirigée vers Cdc42 [
28]. Nous avons pu mettre en évidence, grâce à l’utilisation de mutants catalytiquement inactifs, que l’activité GEF de βPIX était absolument nécessaire à sa fonction dans le contrôle de la polarité des astrocytes en migration [14]. Ces résultats font écho à des observations démontrant le rôle de αPIX, une GEF de Cdc42 apparentée à βPIX et impliquée dans la polarisation des neutrophiles en réponse à un gradient de chimioattractant [
8]. Par ailleurs, il est intéressant de noter que d’autres protéines, dont le rôle dans le contrôle de la polarité est conservé, s’associent à des facteurs d’échange des petites protéines G de la famille Rho. C’est en particulier le cas de Par3 qui interagit avec Tiam, un facteur d’échange pour Rac [
29]. |
Scrib contrôle la localisation et l’activité de Cdc42, un acteur central de la polarité cellulaire Cdc42 est, aussi bien chez la levure que chez les vertébrés, un régulateur central de la polarité cellulaire au cours de la division cellulaire et de la différenciation des cellules polarisées (cellules épithéliales, neurones…). La fonction de Cdc42 dans la mise en place de la polarité passe avant tout par une activation très localisée au site de polarisation [
30,
31]. Au cours de la polarisation des astrocytes, Cdc42 est activée et localisée spécifiquement au niveau du front de migration [
32,
33] (Figure 2). L’expression d’un mutant dominant négatif de Cdc42, comme la délocalisation d’une forme active de la protéine, inhibent la polarisation des cellules [32]. Cdc42 assure ses fonctions en recrutant et en activant le complexe Par6-aPKC au front de migration [33], ce qui conduit au recrutement des protéines APC (adenomatous polyposis coli) et Dlg1 à l’avant des cellules en migration [1,
2]. La quantification biochimique de l’activité de Cdc42 dans ces cellules révèle qu’une diminution de l’expression de Scrib ou de βPIX inhibe l’activation de Cdc42 au cours de la polarisation astrocytaire. Le rôle de Scrib et βPIX dans le contrôle de l’activité de Cdc42 est confirmé par le fait que la suppression de ces protéines affecte la voie de signalisation en aval de Cdc42 et en particulier le recrutement d’APC et de Dlg1 au front de migration (Figure 1).  | Figure 2.
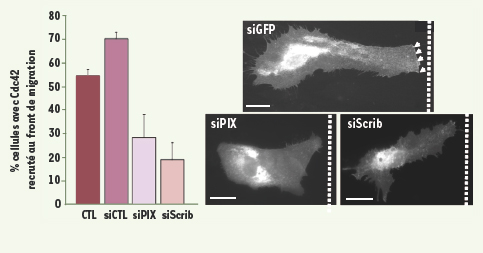
Scrib et β PIX sont nécessaires au recrutement polarisé de Cdc42 au cours de la migration astrocytaire. Des astrocytes primaires ont été transfectés par des siARN soit contre Scrib (siScrib) soit contre βPIX (siPIX). La monocouche cellulaire est rayée pour induire la migration des cellules qui bordent la lésion. Les cellules qui bordent la rayure ont été micro-injectées avec l’ADN codant pour GFP-Cdc42. Les cellules ont été fixées après 8h de migration et le recrutement de GFP-Cdc42 à la membrane du front de migration a été quantifié. Échelle : 20 µm, la barre pointillée indique la position de la rayure. |
La présence de Scrib et de βPIX à l’avant des cellules est indispensable à la localisation correcte de Cdc42 (Figure 2). Au cours de la migration astrocytaire, la polarité cellulaire est contrôlée de manière très précise grâce à une régulation spatio-temporelle très fine de l’activité de Cdc42. Le recrutement de Scrib au front de migration permet, par l’intermédiaire du facteur d’échange βPIX, de réguler l’activité et la localisation de Cdc42. Cette double régulation conduit à la formation du front de migration et permet ensuite d’assurer une migration persistante des cellules vers l’espace vide de la lésion (Figure 1). |
Le suppresseur de tumeur Scrib régule la prolifération et contrôle également polarité des cellules [
34]. La fonction de Scrib dans le contrôle de la polarité cellulaire est conservée non seulement au cours de l’évolution mais aussi dans des processus cellulaires très différents comme la différenciation ou la migration cellulaires. Scrib, comme les produits d’autres gènes suppresseurs de tumeurs (APC, PTEN…), intervient dans trois processus cellulaires essentiels : la prolifération, la polarité et la migration. Capables de connecter ces trois fonctions cellulaires primordiales, ces gènes sont des acteurs centraux au cours de la vie des cellules. Il n’est pas étonnant que la perte de l’un d’eux soit à l’origine de tumeurs, avec tous les dérèglements cellulaires qui lui sont associés, et notamment la perte de la polarité qui constitue un événement crucial au cours de la tumorigenèse. Dans le cas d’une tumeur d’origine épithéliale, une mutation touchant de tels gènes peut, non seulement être à l’origine de l’augmentation anormale de la prolifération cellulaire, mais également conduire à la perte de la polarité apico-basale associée à une perturbation des jonctions cellulaires et entraîner un changement du type de migration : d’un comportement épithélial vers une migration mésenchymateuse, beaucoup plus rapide. Enfin, la perte de la polarité des cellules en migration pourrait être responsable d’une migration désorganisée, caractéristique des cellules tumorales. |
Footnotes |
1. Etienne-Manneville S, Manneville JB, Nicholls S, et al. Cdc42 and Par6-PKCz regulate the spatially localized association of Dlg1 and APC to control cell polarization. J Cell Biol 2005; 170 : 895–901. 2. Etienne-Manneville S, Hall A. Cdc42 regulates GSK3 and adenomatous polyposis coli (APC) to control cell polarity. Nature 2003; 421 : 753–6. 3. Forcet C, Etienne-Manneville S, Gaude H, et al. Functional analysis of Peutz-Jeghers mutations reveals that the LKB1 C-terminal region exerts a crucial role in regulating both the AMPK pathway and the cell polarity. Hum Mol Genet 2005; 14 : 1283–92. 4. Peng CY, Manning L, Albertson R, Doe CQ. The tumour-suppressor genes lgl and dlg regulate basal protein targeting in Drosophila neuroblasts. Nature 2000; 408 : 596–600. 5. Woods DF, Hough C, Peel D, et al. Dlg protein is required for junction structure, cell polarity, and proliferation control in Drosophila epithelia. J Cell Biol 1996; 134 : 1469–82. 6. Boudeau J, Sapkota G, Alessi DR. LKB1, a protein kinase regulating cell proliferation and polarity. FEBS Lett 2003; 546 : 159–65. 7. Martin SG, St Johnston D. A role for Drosophila LKB1 in anterior-posterior axis formation and epithelial polarity. Nature 2003; 421 : 379–84. 8. Li Z, Hannigan M, Mo Z, et al. Directional sensing requires G beta gamma-mediated PAK1 and PIX alpha-dependent activation of Cdc42. Cell 2003; 114 : 215–27. 9. Iijima M, Devreotes P. Tumor suppressor PTEN mediates sensing of chemoattractant gradients. Cell 2002; 109 : 599–610. 10. Polakis P. Wnt signaling and cancer. Genes Dev 2000; 14 : 1837–51. 11. Avizienyte E, Loukola A, Roth S, et al. LKB1 somatic mutations in sporadic tumors. Am J Pathol 1999; 154 : 677–81. 12. Nezu J, Oku A, Shimane M. Loss of cytoplasmic retention ability of mutant LKB1 found in Peutz-Jeghers syndrome patients. Biochem Biophys Res Commun 1999; 261 : 750–5. 13. Dow LE, Brumby AM, Muratore R, et al. hScrib is a functional homologue of the Drosophila tumour suppressor Scribble. Oncogene 2003; 22 : 9225–30. 14. Osmani N, Vitale N, Borg JP, Etienne-Manneville S. Scrib controls Cdc42 localization and activity to promote cell polarization during astrocyte migration. Curr Biol 2006; 16 : 2395–405. 15. Dow LE, Kauffman JS, Caddy J, et al. The tumour-suppressor Scribble dictates cell polarity during directed epithelial migration: regulation of Rho GTPase recruitment to the leading edge. Oncogene 2007; 26 : 2272–82. 16. Bilder D, Li M, Perrimon N. Cooperative regulation of cell polarity and growth by Drosophila tumor suppressors. Science 2000; 289 : 113–6. 17. Bilder D, Schober M, Perrimon N. Integrated activity of PDZ complexes regulates epithelial polarity. Nat Cell Biol 2003; 5 : 53–8. 18. Murdoch JN, Henderson DJ, Doudney K, et al. Disruption of Scribble (Scrib1) causes severe neural tube defects in the circletail mouse. Hum Mol Genet 2003; 12 : 87–98. 19. Zarbalis K, May SR, Shen Y, et al. A focused and efficient genetic screening strategy in the mouse: identification of mutations that disrupt cortical development. PLoS Biol 2004; 2 : E219. 20. Qin Y, Capaldo C, Gumbiner BM, Macara IG. The mammalian Scribble polarity protein regulates epithelial cell adhesion and migration through E-cadherin. J Cell Biol 2005; 171 : 1061–71. 21. Etienne-Manneville S. Les molécules qui dirigent la migration des astrocytes. Med Sci (Paris) 2002; 18 : 142–4. 22. Zeitler J, Hsu CP, Dionne H, Bilder D. Domains controlling cell polarity and proliferation in the Drosophila tumor suppressor Scribble. J Cell Biol 2004; 167 : 1137–46. 23. Legouis R, Jaulin-Bastard F, Schott S, et al. Basolateral targeting by leucine rich repeat domains in epithelial cells. EMBO Rep 2003; 4 : 1096–100. 24. Kallay LM, McNickle A, Brennwald PJ, et al. Scribble associates with two polarity proteins, Lfl2 and Vangl2, via distinct molecular domains. J Cell Biochem 2006; 99 : 647–64. 25. Hatem S, Godreau D, Neyroud N, Vranckx R. Les MAGUK : au-delà de l’accrochage des canaux ioniques. Med Sci (Paris) 2004; 20 : 84–8. 26. Audebert S, Navarro C, Nourry C, et al. Mammalian Scribble forms a tight complex with the betaPIX exchange factor. Curr Biol 2004; 14 : 987–95. 27. Manser E, Loo TH, Koh CG, et al. PAK kinases are directly coupled to the PIX family of nucleotide exchange factors. Mol Cell 1998; 1 : 183–92. 28. Feng Q, Baird D, Peng X, et al. Cool-1 functions as an essential regulatory node for EGFreceptor- and Src-mediated cell growth. Nat Cell Biol 2006; 8 : 945–56. 29. Mertens AE, Rygiel TP, Olivo C, et al. The Rac activator Tiam1 controls tight junction biogenesis in keratinocytes through binding to and activation of the Par polarity complex. J Cell Biol 2005; 170 : 1029–37. 30. Adams AEM, Johnson DJ, Longnecker RM, et al. CDC42 and CDC43, two additional genes involved in budding and establishment of cell polarity in the yeast Saccharomyces cerevisiae. J Cell Biol 1990; 111 : 131–42. 31. Caviston JP, Tcheperegine SE, Bi E. Singularity in budding: a role for the evolutionarily conserved small GTPase Cdc42p. Proc Natl Acad Sci USA 2002; 99 : 12185–90. 32. Etienne-Manneville S. Des mécanismes moléculaires conservés contrôlent la polarité cellulaire. Med Sci (Paris) 2003; 19 : 1063. 33. Etienne-Manneville S, Hall A. Integrin-mediated Cdc42 activation controls cell polarity in migrating astrocytes through PKCz. Cell 2001; 106 : 489–98. 34. Nagasaka K, Nakagawa S, Yano T, et al. Human homolog of Drosophila tumor suppressor Scribble negatively regulates cell-cycle progression from G1 to S phase by localizing at the basolateral membrane in epithelial cells. Cancer Sci 2006; 97 : 1217–25. |