| |
| Med Sci (Paris). 2008 January; 24(1): 34–36. Published online 2008 January 15. doi: 10.1051/medsci/200824134.Que faire de la membrane plasmique d’une cellule pendant la mitose ? Emmanuel Boucrot* Département de Biologie Cellulaire, École de Médecine de Harvard, Boston, États-Unis. Nouvelle adresse : Institut Gurdon, Cancer Research UK, Université de Cambridge, Royaume-Uni MeSH keywords: Animaux, Membrane cellulaire, Phénomènes physiologiques cellulaires, Interphase, Cinétique, Métaphase, Mitose, Prophase, Télophase |
Les cellules eucaryotes non protégées par une paroi cellulaire, comme par exemple les cellules humaines, ont la particularité de se rassembler sur elles-mêmes pendant la première phase de la division cellulaire (ou mitose). Elles forment alors chacune une boule compacte lors de la métaphase, que ce soit dans des conditions de culture cellulaire ou dans les tissus vivants [
1–
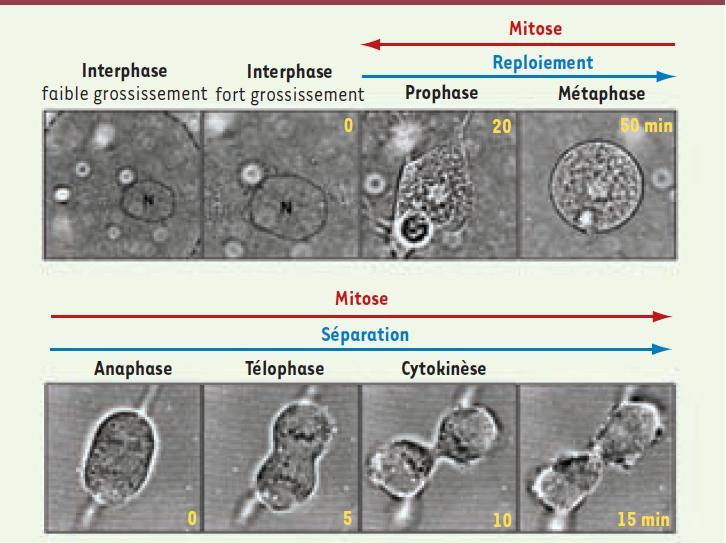
4]. Puis, au cours de l’anaphase et de la cytokinèse, les deux cellules filles en formation reprennent leurs formes étalées (Figure 1). Le changement de forme des cellules en une sphère peut être vu comme un moyen d’établir un environnement favorable à l’établissement du fuseau mitotique, disposé de façon symétrique autour des deux copies des chromosomes alignés en métaphase. Il permet aussi probablement d’assurer le partage équitable de tous les autres composants et organites cellulaires distribués de façon aléatoire lors de la formation des deux cellules filles. Ces changements de forme des cellules s’effectuent rapidement : une heure pour s’arrondir, puis 30-40 minutes pour que s’individualisent les deux cellules filles lors de la télophase et au début de la cytokinèse (même si la séparation, ou abscission, survient parfois plus d’une heure après).  | Figure 1.
Les différentes étapes de la mitose. Photos en contraste de phase d’un film suivant une cellule épithéliale en train de se diviser. La cellule mère étalée et plate en interphase (deux images de gauche, faible et fort grossissement ; N : noyau) se regroupe dès la première phase de la mitose, la prophase. Elle prend ensuite une forme sphérique lors de la métaphase, lorsque les chromosomes sont alignés par paires à la plaque équatoriale. Les chromosomes se séparent ensuite lors de l’anaphase et migrent pendant la télophase aux extrémités des deux cellules filles en formation, lorsque le sillon de clivage se forme. Puis, lors de la cytokinèse (deux dernières images en bas à droite), les deux cellules filles encore connectées sont clairement formées. La formation de l’enveloppe des deux cellules filles s’effectue en 10-15 minutes et donc impose de grands changements de forme de la membrane plasmique dans un laps de temps réduit (d’après [
10]). |
On peut donc poser une question simple : d’où provient la membrane plasmique nécessaire à la création de l’enveloppe des deux cellules filles à partir de la cellule parentale ? Comme l’appareil de Golgi, essentiel à la sécrétion des lipides nouvellement formés, est démantelé pendant la mitose [
5,
6], on ne peut pas envisager la formation de la nouvelle membrane par synthèse de novo pendant cette période. La membrane plasmique doit donc provenir entièrement de la cellule mère. Toutefois, de simples considérations géométriques de base indiquent que la sphère est la forme géométrique qui nécessite le minimum de surface pour un volume donné. Ainsi, lors de la transition d’une cellule étalée (en interphase) à une cel-lule ronde (en métaphase) deux possibilités se présentent pour expliquer la réduction de surface de la membrane : soit la surface totale de la membrane plasmique reste la même, mais elle forme de nombreux plis et villosités, soit elle diminue, par rapport à la surface observée lors de l’interphase, mais alors la membrane doit être stockée quelque part. |
Source de membrane plasmique lors de la mitose : plis ou trafic ? Pendant très longtemps c’est la première possibilité qui a prévalu au sein de la communauté des biologistes travaillant sur la mitose. Il y a plus de 30 ans des images par microscopie électronique à balayage, prises de la surface de cellules synchronisées dans une phase du cycle, ont montré une augmentation du nombre de microvilli et de villosités entre les phases G1 et G2 du cycle cellulaire (donc pendant la phase M, la mitose) et un doublement apparent de la surface de la membrane pendant ce laps de temps [
7–
9]. De ces observations l’on avait déduit conclu que la cytokinèse est un processus d’étirement ou de déploiement physique de la membrane tel qu’une quantité nécessaire à la formation de l’enveloppe des deux cellules filles est obtenue [
8]. Il est à noter toutefois que ces études pionnières n’excluaient pas qu’une réorganisation rapide de la quantité de membrane plasmique par endocytose et recyclage pouvait aussi être impliquée dans le contrôle de la gestion de la quantité de membrane de surface disponible lors de la mitose [9]. Néanmoins, c’est cette théorie du repliement de la membrane et de la formation de plis lors de la métaphase, puis de dépliement lors de la cytokinèse, qui a été adoptée puis acceptée comme un fait avéré. L’alternative est que la surface de membrane plasmique varie, diminuant au début de la mitose quand les cellules s’arrondissent et augmentant de nouveau au cours de la formation des cellules filles. Mais, si cela est le cas, il faut que le trafic membranaire entre la surface et l’intérieur de la cellule soit régulé pendant la mitose, car dans les conditions d’équilibre, la quantité de membranes internalisées par endocytose est compensée par celles qui sont redéposées à la surface par le recyclage. |
La surface de membrane plasmique varie pendant la mitose L’utilisation de nouvelles techniques, telles que la vidéo-microscopie confocale à 3 dimensions, pour examiner les cellules vivantes a récemment permis de mesurer la surface de la membrane plasmique cellulaire pendant la mitose [10]. Cette méthode permet de suivre des cellules vivantes individuelles à différents stades de la mitose sans avoir à les fixer ou à les synchroniser dans le cycle cellulaire en les exposant à des réactifs chimiques (blocage par la thymidine ou le nocodazole), limitant ainsi les perturbations. Les résultats montrent une réduction (d’un facteur 2 à 6 selon le type cellulaire) de la surface de la membrane pour les cellules en métaphase (donc sphériques) et une récupération démarrant pendant l’anaphase puis se poursuivant jusqu’à la cytokinèse [10]. Ainsi, avant l’abscission, la récupération est complète et la somme de la surface membranaire des deux cellules filles (encore connectées) est la même que celle de la cellule mère originelle. |
Le trafic membranaire gouverne les changements de surface des cellules en mitose Beaucoup de travaux de recherche ont exploré le trafic membranaire pendant la division cellulaire et tous se sont focalisés sur le dépôt et la récupération de membrane au niveau du sillon de clivage pendant la cytokinèse (voir [
11] pour une revue récente). De nombreuses protéines essentielles au processus de cytokinèse ont des fonctions bien établies dans les processus d’endocytose, d’exocytose et de recyclage. Mais l’on avait alors surtout interprété ces résultats et les rôles de l’exocytose et du recyclage dans le contexte de la formation du sillon mitotique, et de l’abscission, l’événement de séparation finale des deux cellules filles et tout dernier stage de la mitose. Mais pour les stades mitotiques précédant la cytokinèse, l’on pensait depuis plus de 25 ans que tout trafic membranaire cessait [
12–
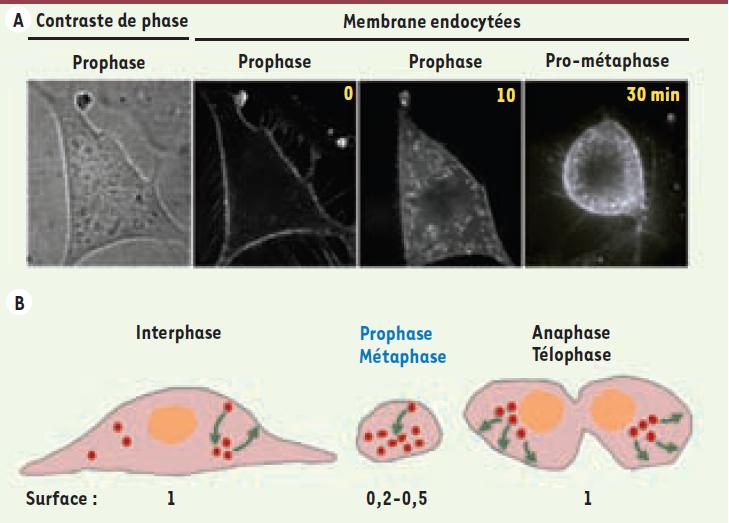
15], non seulement en raison du désassemblage de l’appareil de Golgi évoqué plus haut, mais aussi par arrêt pendant la mitose de l’endocytose via les vésicules de clathrine et par pinocytose, ainsi que de la voie de recyclage. Comment alors expliquer ces changements mesurés de surface de membrane plasmique pendant la mitose [10] si tout trafic membranaire est bloqué jusqu’à la cytokinèse, stade où les deux cellules filles sont déjà formées ? De façon surprenante, on sait maintenant que l’endocytose reste en fait active à des niveaux normaux pendant la mitose [10] et l’on a pu proposer une explication aux conclusions erronées des études pionnières des années 1980. Mais si l’endocytose reste active, les membranes internalisées ne sont plus recyclées en revanche à la surface cellulaire, et ce dès le début de la mitose, quand la cellule prend sa forme sphérique. Le déséquilibre qui s’installe alors entre l’endocytose et l’absence de recyclage entraîne la formation d’un réservoir de membrane dans la cellule ronde métaphasique, sous la forme de nombreuses vésicules (Figure 2A). Dès le début de l’anaphase, la voie de recyclage redémarre et toutes les vésicules stockées fusionnent brutalement avec la surface. Cela entraîne la ré-augmentation de surface, nécessaire à la création de l’enveloppe des deux cellules en formation. Ce processus (résumé dans la Figure 2B) a non seulement été visualisé de façon directe et détecté de façon indirecte, mais a aussi été testé par l’utilisation de perturbations génétiques (interférence ARN ou expression de dominants négatifs) ou chimiques pour bloquer l’endocytose ou le recyclage [10]. La perturbation de chacune de ces deux voies entraîne des défaillances de la division cellulaire et provoque la formation de cellules multinucléées, caractéristiques de nombreux cancers.  | Figure 2.
La formation d’un réservoir de membrane fournit la surface nécessaire à la formation des deux cellules filles lors de la mitose. A. Visualisation de la formation du réservoir de membrane lors du repliement des cellules traversant la première phase de la mitose. Une cellule en prophase (image de gauche, contraste de phase) est incubée avec la molécule FM 1-43 qui ne devient fluorescente que lorsqu’elle se lie à la surface de la membrane plasmique, la cellule est alors analysée périodiquement par microscopie confocale à 3-dimensions. Au fur et à mesure que la cellule se replie et s’arrondit, les membranes internalisées marquées par le FM 1-43 s’accumulent dans le cytosol de la cellule. La dernière acquisition (image de droite) correspond à la cellule en pro-métaphase, stade intermédiaire précédant la métaphase, et pendant lequel elle n’est donc pas encore totalement ronde, mais le réservoir de membrane accumulée depuis la prophase est clairement visible (d’après [ 10]). B. Changements d’équilibre des échanges de membranes entre les voies d’endocytose et de recyclage pendant la mitose. Ces deux voies sont en équilibre lors de l’interphase, garantissant la constance de la surface de membrane plasmique. Lors du repliement des cellules qui survient lors de la prophase et métaphase, la quantité de membrane plasmique diminue. Cela est dû à un déséquilibre dans le trafic membranaire induit par une endocytose normale combinée par l’arrêt des voies de sécrétion et recyclage ; un réservoir de membrane interne est ainsi créé. Puis, lors de l’anaphase, télophase et au début de la cytokinèse, la surface de la membrane plasmique augmente rapidement par fusion rapide avec la surface cellulaire des vésicules précédemment stockées (d’après [ 10]). |
La future découverte des mécanismes moléculaires qui contrôlent l’activité de la voie de recyclage pendant la mitose permettra alors peut-être d’expliquer le développement de certaines tumeurs, et offrira potentiellement de nouvelles cibles pour l’élaboration d’une nouvelle génération de médicaments anticancéreux. |
Je remercie Dr Tomas Kirchhausen (École de Médecine de Harvard, Boston, États-Unis) pour son support, ainsi que pour m’avoir donné l’opportunité de développer cette nouvelle thématique. Je remercie Mlle Wendy Tsang Man Pun pour la relecture de cette nouvelle. Je remercie enfin l’organisation Human Frontier Science Program Organization pour le soutien qu’elle continue de m’accorder.
|
1. Seery JP, Watt FM. Asymmetric stem-cell divisions define the architecture of human oesophageal epithelium. Curr Biol 2000; 10 : 1447–50. 2. Gong Y, Mo C, Fraser SE. Planar cell polarity signalling controls cell division orientation during zebrafish gastrulation. Nature 2004; 430 : 689–93. 3. Lechler T, Fuchs E. Asymmetric cell divisions promote stratification and differentiation of mammalian skin. Nature 2005; 437 : 275–80. 4. Gibson MC, Patel AB, Nagpal R, Perrimon N. The emergence of geometric order in proliferating metazoan epithelia. Nature 2006; 442 : 1038–41. 5. Warren G, Featherstone C, Griffiths G, Burke B. Newly synthesized G protein of vesicular stomatitis virus is not transported to the cell surface during mitosis. J Cell Biol 1983; 97 : 1623–8. 6. Lucocq JM, Warren G. Fragmentation and partitioning of the Golgi apparatus during mitosis in HeLa cells. EMBO J 1987; 6 : 3239–46. 7. Porter K, Prescott D, Frye J. Changes in surface morphology of Chinese hamster ovary cells during the cell cycle. J Cell Biol 1973; 57 : 815–36. 8. Knutton S, Sumner MC, Pasternak CA. Role of microvilli in surface changes of synchronized P815Y mastocytoma cells. J Cell Biol 1975; 66 : 568–76. 9. Erickson CA, Trinkaus JP. Microvilli and blebs as sources of reserve surface membrane during cell spreading. Exp Cell Res 1976; 99 : 375–84. 10. Boucrot E, Kirchhausen T. Endosomal recycling controls plasma membrane area during mitosis. Proc Natl Acad Sci USA 2007; 104 : 7939–44. 11. Albertson R, Riggs B, Sullivan W. Membrane traffic: a driving force in cytokinesis. Trends Cell Biol 2005; 15 : 92–101. 12. Berlin RD, Oliver JM, Walter RJ. Surface functions during mitosis. I. Phagocytosis, pinocytosis and mobility of surface-bound ConA. Cell 1978; 15 : 327–41. 13. Berlin RD, Oliver JM. Surface functions during mitosis. II. Quantitation of pinocytosis and kinetic characterization of the mitotic cycle with a new fluorescence technique. J Cell Biol 1980; 85 : 660–71. 14. Sager PR, Brown PA, Berlin RD. Analysis of transferrin recycling in mitotic and interphase HeLa cells by quantitative fluorescence microscopy. Cell 1984; 39 : 275–82. 15. Warren G, Davoust J, Cockcroft A. Recycling of transferrin receptors in A431 cells is inhibited during mitosis. EMBO J 1984; 3 : 2217–25. |