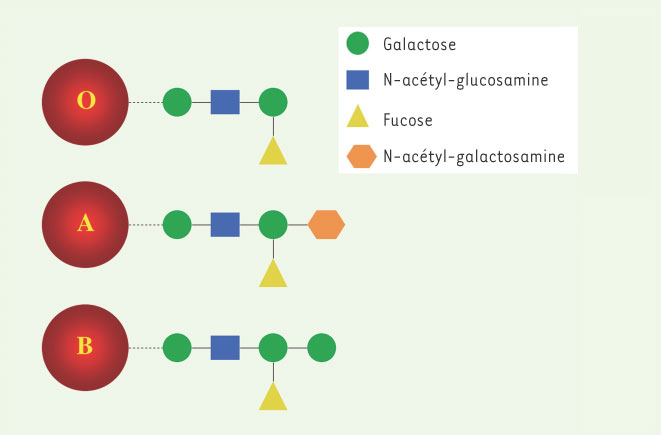
Le système ABO, découvert par Karl Landsteiner en 1900 [ 1], détermine les règles principales qui régissent la transfusion sanguine. Ce système met en jeu des chaînes d’oligosaccharides qui portent un sucre terminal immuno-déterminant, N-acétyl-galactosamine dans le cas de l’antigène A ou galactose dans le cas de l’antigène B, à la surface des érythrocytes (Figure 1). La surface des globules rouges du type AB est recouverte des deux antigènes, tandis que les chaînes oligosaccharidiques qui caractérisent le groupe O sont dépourvues de sucre immuno-déterminant. Lors d’une transfusion incompatible, les anticorps du receveur se fixent spécifiquement aux antigènes à la surface des globules rouges du donneur, provoquant ainsi l’agglutination et parfois l’hémolyse de ces derniers. C’est précisément en raison de l’absence de sucre antigénique que le groupe sanguin O est considéré universel et que les globules rouges O peuvent être transfusés à l’ensemble des individus des groupes A, B et AB1.
D’où l’idée visionnaire de Jack Goldstein, dans les années 1980, d’utiliser des enzymes pour enlever les sucres immuno-déterminants des antigènes A et B et engendrer ainsi des globules rouges du type O, soit du type donneur universel (appelés aussi cellules ECO, enzyme-converted type O) [ 2]. Goldstein a montré la faisabilité de l’approche en transformant des érythrocytes du type B en cellules B-ECO en utilisant une α-galactosidase extraite de grains de café. Malheureusement le processus s’est avéré à la fois trop coûteux et peu efficace, car il fallait plus d’un gramme d’enzyme pour convertir une unité d’érythrocytes (200 ml de sang). En outre l’enzyme provenant des grains de café possède un maximum d’activité à pH acide, peu propice à la survie des globules rouges. Pour la transformation d’érythrocytes de type A en A-ECO, d’autres travaux ont été rapportés, utilisant plusieurs α-N-acétylgalactosaminidases, mais aucune ne s’est révélée véritablement efficace [ 3– 5].
La raison de ces échecs tenait sans doute au fait que la recherche d’enzymes susceptibles d’éliminer le sucre immuno-déterminant avait été effectuée en utilisant des substrats du type para-nitro-phényl-galactose ou para-nitro-phényl-N-acétylgalactosamine. Ces substrats, couramment utilisés en enzymologie, ne ressemblent que très vaguement aux véritables molécules situées à la surface des érythrocytes et sont dépourvus en particulier de la chaîne complète d’oligosaccharides constituant les antigènes A et B. La solution fut trouvée par nos collaborateurs, les chercheurs de la société ZymeQuest, qui ont utilisé des dérivés amino-coumarine des tétrasaccharides complets correspondant aux antigènes A et B pour cribler des milliers d’extraits cellulaires bactériens et fongiques. C’est ainsi qu’ils ont découvert des souches bactériennes produisant des a-N-acétylgalactosidases et des α-galactosidases possédant une spécificité et une activité envers les antigènes du type A et B bien plus élevées que celles des enzymes connues jusqu’alors [ 6]. Ainsi pour transformer 200 ml de sang, il suffit de 15-60 mg de α-N-acétylgalactosidase pour le type A et 2 mg de α-galactosidase pour le type B. Les enzymes, qui peuvent êtres produites en grande quantité par expression recombinante dans des bactéries inoffensives, agissent à pH neutre et peuvent être facilement éliminées par simple dialyse une fois la conversion effectuée. Le traitement des cellules A-ECO et B-ECO avec des anticorps hautement spécifiques pour les antigènes A et B ne révèle aucune présence résiduelle de ces derniers, indiquant que la transformation peut être considérée comme complète. L’ensemble de ces propriétés rend les deux enzymes extrêmement intéressantes pour la transformation des groupes sanguins A, B et AB en O.
La séquence en acides aminés des deux enzymes ne présente aucune similitude avec les quelques 30 000 enzymes capables d’hydrolyser des sucres répertoriées dans la banque de données CAZy (http://www.cazy.org) créée et mise à jour dans notre laboratoire [ 7]. Dans cette base de données, les enzymes sont classées en familles tenant compte du mécanisme catalytique et de la structure tridimensionnelle. Cette classification permet d’établir des relations séquence-structure-fonction très précises. Les deux enzymes découvertes ont ainsi permis la définition de deux nouvelles familles de glycosidases, chacune regroupant exclusivement des enzymes d’origine bactérienne : la famille GH109 pour les α-N-acétylgalactosidases et la famille GH110 pour les α-galactosidases (pour une liste complète, consulter la base de données CAZy).
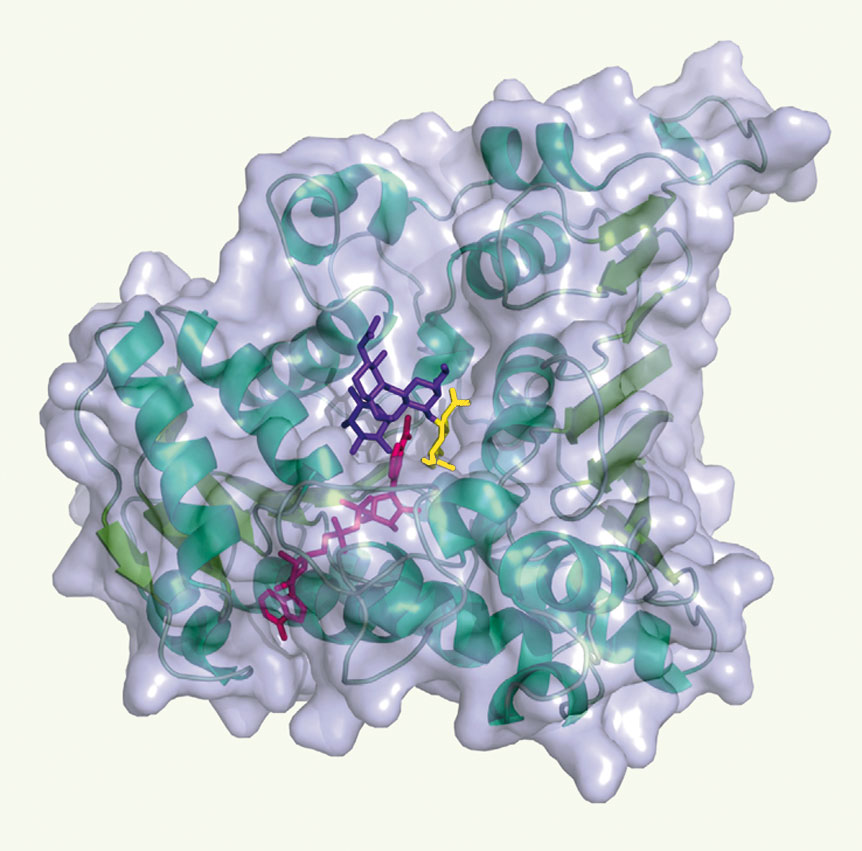
À notre grande surprise, l’analyse de la séquence en acides aminés de l’α-N-acétylgalactosaminidase de la bactérie Elizabethkingia meningosepticum, l’enzyme capable de cliver le sucre immuno-déterminant de l’antigène A, a indiqué que celles-ci présentait des similitudes avec des oxydoréductases! Pour éliminer tous les doutes sur la fonction exacte de l’enzyme, la résolution de la structure tridimensionnelle par cristallographie aux rayons X a été réalisée dans notre laboratoire. La technique permet de déterminer la position de chacun des dizaines de milliers d’atomes qui composent l’enzyme, et ainsi d’obtenir une image moléculaire dévoilant le mécanisme mis en oeuvre pour effectuer l’hydrolyse sélective observée. La structure tridimensionnelle que nous avons mise à jour (Figure 2) montre que l’enzyme possède une forte ressemblance structurale avec les oxydoréductases, en particulier par le repliement général de la chaîne polypeptidique, la présence du cofacteur nicotinamide-adénine-di-nucléotide, NAD+, et l’organisation spatiale des acides aminés formant le centre actif. Celui-ci révèle une similitude frappante avec celui des glycosidases de la famille GH4 en dépit de repliements globalement différents des chaînes polypeptidiques. Depuis les premiers travaux sur le mécanisme catalytique des glycosidases dans les années 1950 [ 8], et après les nombreux progrès fondamentaux en enzymologie mécanistique réalisés ces quinze dernières années, on pensait avoir compris le mode d’action des glycosidases dans le moindre détail : l’hydrolyse enzymatique des sucres faisant intervenir deux variantes d’un mécanisme catalytique du type acide-base [ 9]. Les travaux sur les enzymes de la famille GH4 ont montré très récemment que l’hydrolyse de la liaison glycosidique peut être catalysée également par un autre mécanisme comportant une succession d’étapes d’oxydation-élimination-addition-réduction [ 10]. La structure tridimensionnelle de l’α-N-acétylgalactosaminidase révèle qu’il s’agit du deuxième exemple connu de détournement de structure préexistante, en l’occurrence d’oxydoréductases, suivi d’une évolution vers une nouvelle fonction adaptée à des voies métaboliques différentes.
| Figure 2.
Vue générale de la structure moléculaire de l’a-N-acétylgalactosaminidase d’Elizabethkingia meningosepticum (vert) sous surface transparente (bleu clair) en complexe avec le cofacteur NAD+ (magenta) et l’antigène A (violet), présent à la surface des globules rouges du type A. La molécule d’α-N-acétylgalactosamine, qui est reconnue et hydrolysée par l’enzyme, est colorée en jaune. |
Le travail de recherche fondamentale n’est pas terminé. Bien que très performante, l’enzyme de conversion des antigènes A n’a pas encore l’efficacité de celle assurant la conversion des antigènes B. Il existe plusieurs approches (ingénierie rationnelle, évolution moléculaire dirigée) qui peuvent à présent être mises en œuvre pour améliorer les paramètres cinétiques de l’enzyme. Par ailleurs, il nous reste à déterminer la structure tridimensionnelle de l’α-galactosidase de Bacteroides fragilis, l’enzyme qui élimine le sucre immuno-déterminant de l’antigène B. Ces travaux sont nécessaires pour comprendre l’efficacité remarquable de cette enzyme.