| |
| Med Sci (Paris). 2007 August; 23(8-9): 701–702. Published online 2007 August 15. doi: 10.1051/medsci/20072389701.Dioxine et œstradiol L’amour vache ou une histoire de « complexes » Xavier Coumoul* Inserm UMR-S 747, Pharmacologie, Toxicologie et Signalisation Cellulaire, Université Paris Descartes, 45, rue des Saints-Pères, 75006 Paris, France MeSH keywords: Dioxines, Oestradiol, Modulateurs des récepteurs des oestrogènes, Oestrogènes, Femelle, Humains, Modèles biologiques, Récepteurs aux oestrogènes |
La dioxine est un hydrocarbure aromatique polycyclique synthétisé au cours de processus industriels et, à ce titre, c’est un contaminant environnemental de nos chaînes alimentaires. Elle présente une toxicité chez tous les êtres vivants et a été classée par l’IARC (International agency for research on cancer) en tant que cancérigène de type I [
1] ; toutefois, cela ne doit pas minimiser ses autres effets toxiques, parfois paradoxaux, comme son action antagoniste ou agoniste vis-à-vis des œstrogènes. |
Effet anti-œstrogénique de la dioxine Les premières études menées sur des rats Sprague-Dawley suggèrent que la dioxine diminue l’incidence des tumeurs mammaires et utérines qui se forment spontanément chez ces animaux en antagonisant l’activation des récepteurs des œstrogènes (RE) [
2]. Les RE sont des récepteurs nucléaires qui activent, après liaison de leur ligand, la transcription de gènes cibles. La dioxine agit, par ailleurs, en tant que perturbateur endocrinien et altère les fonctions de reproduction et de développement des organes sexuels ainsi que la puberté chez les individus exposés [
3]. En parallèle, les mécanismes de cette action anti-œstrogène ont été, en partie, caractérisés par l’utilisation de lignées cellulaires exprimant à la fois les RE et le récepteur de la dioxine (AhR : aryl hydrocarbon receptor). L’ensemble des effets de la dioxine passe par son récepteur, le AhR, qui forme un facteur de transcription avec un partenaire ARNT, et augmente l’expression de gènes cibles (par liaison d’éléments de réponse aux xénobiotiques ou XRE) [
4]. Le AhR possède, par ailleurs, des centaines de ligands dont les hydrocarbures aromatiques polycycliques qui agissent tout comme la dioxine. Les premières cibles caractérisées sont certains cytochromes P450 (CYP) qui catalysent l’hydroxylation de leurs substrats et les rendent plus facilement conjugables et éliminables. Cette propriété explique en partie les effets anti-œstrogéniques de la dioxine car les CYP1A1 et 1B1 (dont l’expression augmente en cas d’activation du AhR) métabolisent et inactivent également des molécules endogènes comme les œstrogènes [
5–
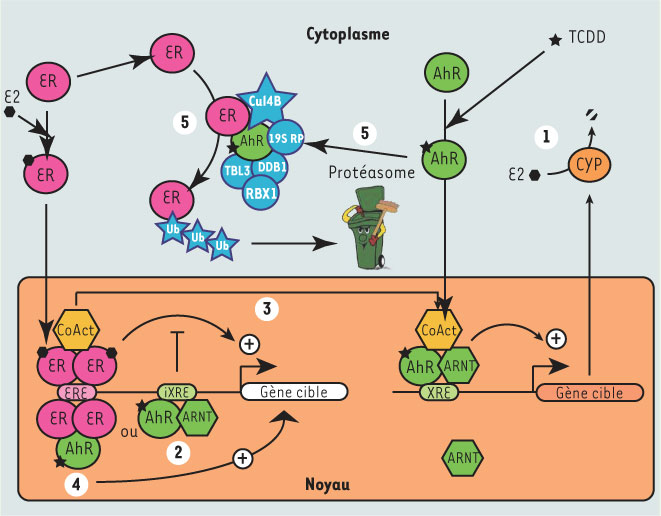
7] (Figure 1 - 1). Si l’effet du AhR dépend, dans ce cas, de l’expression des CYP, elle peut aussi se manifester par sa liaison directe à des promoteurs de gènes régulés par les RE ; plusieurs études ont montré que le AhR pouvait lier des promoteurs cibles du RE au niveau d’éléments de réponse inhibiteurs, gênant ainsi leur activation transcriptionelle (Figure 1 - 2) [3]. En plus de ces effets de compétition directe, le AhR partage avec le RE des coactivateurs qui peuvent donc s’avérer limitants pour les deux voies de transduction (Figure 1 - 3) [3].  | Figure 1.
Différentes voies d’interaction de AhR avec le récepteur des œstrogènes. Le récepteur des œstrogènes (ER) exerce son activité de facteur de transcription par la voie de transduction classiquement décrite dans la littérature, représentée sur la gauche de la figure. La fixation de son ligand (E2) provoque l’homodimérisation de l’ER et l’activation transcriptionelle de ses gènes cibles. Le AhR peut réguler cette voie de transduction de cinq manières différentes : après fixation d’un ligand (ici la dioxine ou TCDD, à droite de la figure), le AhR active la transcription de ses gènes cibles comme certains cytochromes P450, enzymes qui métabolisent et inactivent E2 (1) ; par ailleurs, le AhR activé peut inhiber la transactivation par l’ER en se fixant à des élements de réponse inhibiteurs (iXRE) présents dans certains promoteurs ER-dépendants (2) ou en recrutant des co-activateurs communs aux deux voies de transduction (3, compétition) ou en conduisant à la dégradation de l’ER par la formation d’un complexe ubiquitine-ligase (5). Récemment, il a toutefois été montré que le AhR activé pouvait aussi conduire au recrutement de l’ER (sans ligand) sur des promoteurs œstrogéno-dépendants (4) et activer leur transcription. |
|
Effets pro-œstrogéniques des dioxines : un paradoxe ? Toutefois, d’autres études montrent que la dioxine peut, dans certains cas, exercer des effets pro-œstrogéniques comme l’endométriose (prolifération accrue de l’épithélium utérin). Cet effet endocrinien est favorisé par la perturbation concomitante du système immunitaire, effet mimant lui aussi celui des œstrogènes (diminution de la production des lymphocytes T). Ce paradoxe n’avait jamais été expliqué jusqu’à la publication récente de deux articles mentionnant deux nouveaux rôles du AhR : l’équipe de Shigeaki Kato a ainsi montré en 2003 que le AhR activé s’associe directement avec les RE, conduisant à leur recrutement sur des promoteurs œstrogéno-dépendants, qui sont ainsi activés en l’absence d’œstrogènes (Figure 1 - 4) [7,
8]. À l’inverse, en présence d’œstradiol, le RE est inhibé par le complexe AhR-ARNT. L’agonisme ou l’antagonisme dépendrait donc de la dose d’œstrogènes considérée. Par ailleurs, cette étude montre clairement que le AhR interagit directement avec le RE. Cette découverte est d’autant plus importante que cette interaction semble jouer un rôle supplémentaire dans la régulation de l’expression du RE. |
Un complexe peut en cacher un autre En effet, il a été décrit qu’un traitement par la dioxine conduit à la dégradation du RE via un mécanisme impliquant le protéasome [
9]. Un nouvel article de l’équipe de S. Kato explique ce phénomène : la diminution du niveau d’expression du RE dans la lignée tumorale MCF-7 dépend de l’activité du protéasome (comme l’attestent les expériences utilisant l’inhibiteur MG132) et de la formation d’un complexe comprenant le AhR ; ce complexe spécifique, appelé CUL4BAhR et caractérisé à l’aide de techniques biochimiques classiques de purification, contient en plus du AhR et du RE, une ubiquitine ligase, CUL4B, protéine qui a été associée à certaines formes de retards mentaux héréditaires liés à l’X. Cette liaison n’est observée qu’en présence d’un ligand du AhR ou avec un AhR constitutivement actif [
10]. Quel rôle joue ce complexe dans la cellule ? Il semble favoriser la polyubiquitinylation du RE, conduisant à sa dégradation via le protéasome (Figure 1 - 5). Tous les composants du complexe sont nécessaires à ce phénomène, comme le montrent des expériences utilisant des siARN. Ces résultats ont été confirmés chez l’animal ; en effet, des souris ovariectomisées et traitées avec un ligand du AhR, expriment moins de RE dans l’utérus. Cela n’est pas observé avec des animaux n’exprimant pas le AhR. L’ensemble de ces nouvelles données laisse à penser que le AhR, après activation par ses ligands, est en mesure d’exercer des effets œstrogéniques transitoires (en activant le recrutement du RE sur ses promoteurs) qui seront ensuite inhibés par la dégradation du RE ou le métabolisme des œstrogènes (rétrocontrôle) ; de plus, certains métabolites de l’œstradiol résultant de l’action de cytochromes régulés par le AhR, exercent des effets génotoxiques ce qui ajoute à la complexité des interactions décrites entre ces deux voies de transduction [7]. Par ailleurs, des questions restent en suspens ; on ne sait pas si d’autres récepteurs appartenant à la même famille que le AhR (HIF1a) partagent les propriétés que nous venons de décrire ; il a été montré récemment une activation du RE par l’hypoxie sans qu’une interaction directe ait été démontrée entre HIF et ce récepteur. De plus, on est en droit de s’interroger sur la fonctionnalité des complexes décrits dans l’ensemble des tissus. Enfin, compte tenu de la variété structurale des ligands du AhR, on est en droit de penser que tous n’exerceront pas le même effet que ceux utilisés dans ces études. La présence d’autres complexes protéiques contenant le AhR identifiés par l’équipe de S. Kato laisse à penser qu’il existe encore d’autres fonctions de ce récepteur qui dépassent la seule fonction transactivatrice longtemps décrite. |
1. Steenland K, Bertazzi P, Baccarelli A, Kogevinas M. Dioxin revisited : developments since the 1997 IARC classification of dioxin as a human carcinogen. Environ Health Perspect 2004; 112 : 1265–8. 2. Kociba RJ, Keyes DG, Beyer JE, et al. Results of a two-year chronic toxicity and oncogenicity study of 2,3,7,8-tetrachlorodibenzo-p-dioxin in rats. Toxicol Appl Pharmacol 1978; 46 : 279–303. 3. Safe S, Wormke M, Samudio I. Mechanisms of inhibitory aryl hydrocarbon receptor-estrogen receptor crosstalk in human breast cancer cells. J Mammary Gland Biol Neoplasia 2000; 5 : 295–306. 4. Bock KW, Kohle C. Ah receptor : dioxin-mediated toxic responses as hints to deregulated physiologic functions. Biochem Pharmacol 2006; 72 : 393–404. 5. Tsuchiya Y, Nakajima M, Yokoi T. Cytochrome P450-mediated metabolism of estrogens and its regulation in human. Cancer Lett 2005; 227 : 115–24. 6. Coumoul X, Diry M, Robillot C, Barouki R. Differential regulation of cytochrome P450 1A1 and 1B1 by a combination of dioxin and pesticides in the breast tumor cell line MCF-7. Cancer Res 2001; 61 : 3942–8. 7. Coumoul X, Barouki R. Génotoxicité des métabolites des œstrogènes et cancers. Med Sci (Paris) 2002; 18 : 86–90. 8. Ohtake F, Takeyama K, Matsumoto T, et al. Modulation of oestrogen receptor signalling by association with the activated dioxin receptor. Nature 2003; 42 3 : 545–50. 9. Wormke M, Stoner M, Saville B, et al. The aryl hydrocarbon receptor mediates degradation of estrogen receptor alpha through activation of proteasomes. Mol Cell Biol 2003; 23 : 1843–55. 10. Ohtake F, Baba A, Takada I, et al. Dioxin receptor is a ligand-dependent E3 ubiquitin ligase. Nature 2007; 446 : 562–6. |