| |
| Med Sci (Paris). 2007 August; 23(8-9): 698–700. Published online 2007 August 15. doi: 10.1051/medsci/20072389698.Le danio zébré révèle l’odyssée des précurseurs hématopoïétiques au cours du développement des embryons de vertébrés Karima Kissa, Emi Murayama, and Philippe Herbomel* Unité Macrophages et Développement de l’Immunité, CNRS-URA 2578, Institut Pasteur, 25, rue du Docteur Roux, 75724 Paris Cedex 15, France MeSH keywords: Animaux, Développement embryonnaire, Hématopoïèse, Cellules souches hématopoïétiques, Modèles biologiques, Vertébrés, Danio zébré |
Les cellules souches hématopoïétiques (CSH) sont à l’origine des divers types de cellules sanguines et de leur production continuelle chez les vertébrés adultes. Au cours du développement des mammifères, la genèse des cellules du sang se fait en deux vagues successives [
1,
2]. La première vague, dite primitive, est transitoire, et produit dans le sac vitellin les érythrocytes et les macrophages primitifs de l’embryon. Puis une seconde vague, dite définitive, produit, à partir de CSH, l’ensemble des cellules sanguines caractérisées chez l’adulte, en particulier la diversité des lymphocytes. Cette hématopoïèse définitive a d’abord lieu dans le foie foetal, puis dans la moelle osseuse, et parallèlement dans le thymus pour ce qui est de la maturation des lymphocytes T. Au cours de l’embryogenèse, le premier site où des cellules présentant le potentiel de CSH ont été identifiées est une région intra-embryonnaire appelée AGM (aorte-gonade-mésonephros) (voir Nouvelle d’Isabelle Godin et Ana Cumano, page 681 de ce numéro) [
3]. Ce potentiel de CSH a été mis en évidence en montrant la capacité qu’ont ces cellules, lorsqu’elles sont injectées dans une souris adulte irradiée, de restaurer durablement toute l’hématopoïèse. De là, il a été conclu que les organes hématopoïétiques transitoires (foie fœtal) puis définitifs (thymus, moelle osseuse) sont successivement colonisés par des CSH initialement nées dans l’AGM. Bien que ce principe soit admis, aucune démonstration directe d’une continuité de lignage cellulaire depuis l’AGM jusqu’aux organes hématopoïétiques définitifs n’a jamais été faite (voir Nouvelle d’Isabelle Godin et Ana Cumano, page 681 de ce numéro) [3]. Malgré les divergences apparues entre les mammifères et les poissons au cours de l’évolution, le patron de signalisation moléculaire gouvernant l’hématopoïèse a été très conservé [
4]. Aussi, parce que l’embryon de danio zébré (zebrafish, d’où l’anglicisme poisson zèbre) se développe dans l’eau, est de petite taille, et totalement transparent, il représente un modèle adapté à l’observation et l’analyse in vivo du développement de l’hématopoïèse. Qu’en est-il donc chez ce poisson ?
-
Comme chez les mammifères, une première vague hématopoïétique donne naissance aux macrophages et érythrocytes primitifs, environ 24 h après la fécondation (hpf), peu avant le démarrage de la circulation sanguine [
5].
-
Le site définitif de l’hématopoïèse, comme chez tous les poissons, est le rein, à partir de 7 jpf (jours post-fécondation).
-
Or, dès 2 jours, de nouveaux types leucocytaires apparaissent (granulocytes, et thrombocytes - homologues des plaquettes sanguines chez les vertébrés non-mammifères), et dès 3 jours, les premiers lymphoblastes colonisent le thymus [
6,
7]. Cela suggérait l’existence d’un site préalable de genèse de CSH, et d’un site intermédiaire d’hématopoïèse (rendant compte de la production de granulocytes et de thrombocytes), avant l’établissement de l’hématopoïèse définitive dans le rein.
Deux questions se posaient alors : (1) les CSH sont-elles produites dans une AGM homologue à celle des mammifères ? (2) Peut-on mettre à profit l’accessibilité de l’embryon de danio pour analyser in vivo la colonisation par ces CSH des tissus hématopoïétiques transitoires (à identifier), puis définitifs (thymus et rein) ? |
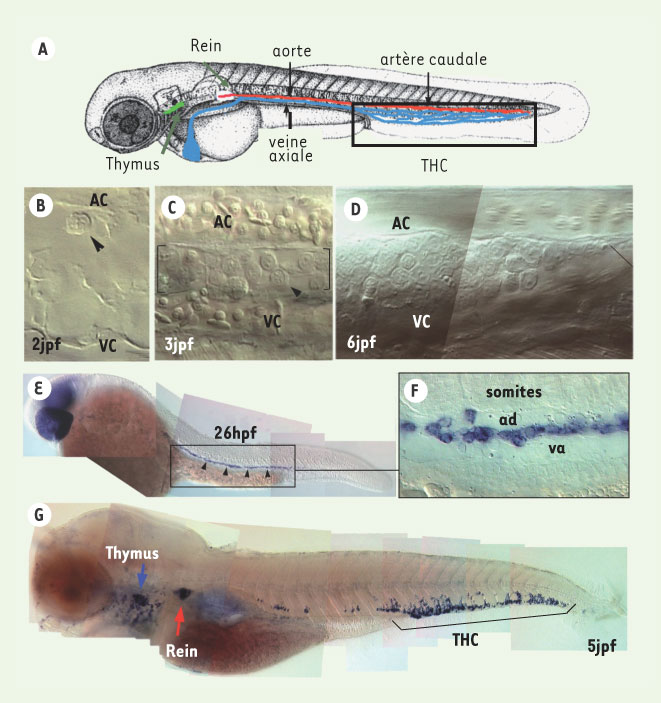
Identification du lieu d’hématopoïèse intermédiaire : le tissu hématopoïétique caudal (THC) Nos explorations par vidéomicroscopie Nomarski sur l’embryon vivant montrent la présence de progéniteurs hématopoïétiques en nombre croissant entre 30 hpf et 6 jpf dans la queue, entre l’artère et le plexus veineux caudal (AC et VC, Figure 1B) [
8]. Ce tissu, que nous avons appelé « tissu hématopoïétique caudal » (THC) est le lieu de genèse de granulocytes, et de thrombocytes. L’analyse par microscopie électronique montre que le THC contient dès 3 jpf des fibroblastes réticulaires adossés aux cellules endothéliales veineuses, qui forment une trame dans laquelle les CSH s’installent pour proliférer et se différencier - cytoarchitecture semblable à celle du stroma hématopoïétique rénal ultérieur du poisson ou de la moelle osseuse des mammifères.  | Figure 1.
Le tissu hématopoïétique caudal : un site hématopoïétique intermédiaire. A-D. L’observation par microscopie Nomarski de l’embryon de danio zébré vivant révèle l’accumulation de précurseurs hématopoïétiques dans la région de la veine caudale, entre 2 et 6 jours post-fécondation (jpf) (B-D). À 2 jpf, la tête de flèche montre un précurseur hématopoïétique présent dans le tissu caudal (B). Progressivement, le nombre de ces progéniteurs croît (C), jusqu’à atteindre un maximum à 6 jpf (D). E-G. L’hybridation in situ à l’aide d’une sonde c-myb, marqueur précoce de l’hématopoïèse définitive révèle à 26 hpf un chapelet de cellules marquées dans le tronc (E, têtes de flèche), entre l’aorte dorsale (ad) et la veine axiale (va) (F). À 5 jpf, l’expression de c-myb est détectée dans le THC, le thymus (flèche bleue) et le rein, organe hématopoïétique définitif chez le poisson (flèche rouge) (G) (figure issue du journal Immunity avec l’aimable autorisation du groupe Cell Press). |
|
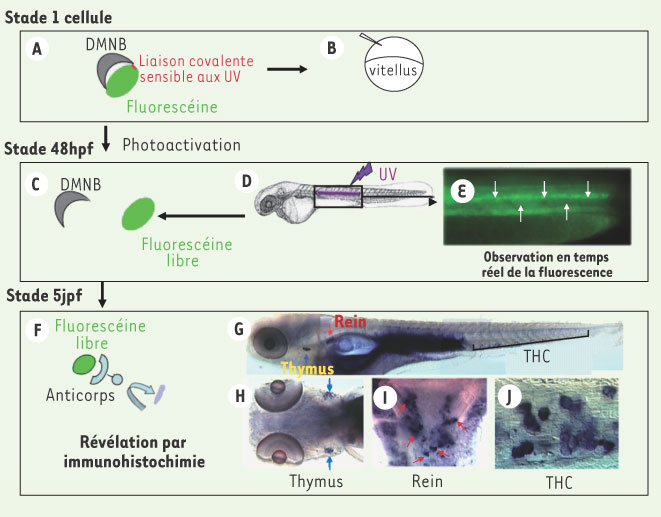
Un traceur cellulaire photoactivable in vivo permet de suivre le voyage des CSH issues de l’AGM au cours du développement du danio zébré Dès 26 hpf, l’hybridation in situ à l’aide d’une sonde ARNc c-myb révèle la présence d’un chapelet de précurseurs hématopoïétiques dans le tronc, entre l’aorte dorsale et la veine axiale, dans une région homologue de l’AGM des mammifères (Figure 1E, 1F). À 48 hpf, ce marquage s’étend aux cellules nichées dans le THC, où le nombre de cellules c-myb+ ne cesse d’augmenter jusqu’à 6 dpf, tandis qu’à 3 et 5jpf un marquage est détecté respectivement dans le thymus et le rein (Figure 1G) [7]. La chronologie des marquages successifs suggère la migration de CSH entre ces différents sites hématopoïétiques. Afin de suivre à court terme le devenir des précurseurs hématopoïétiques initialement présents dans l’AGM, nous avons là encore tiré parti de la transparence de l’embryon de danio zébré en utilisant un traceur cellulaire conditionnel, activable in vivo par une illumination dans l’UV. Le traceur, injecté dans l’œuf fécondé, se transmet ensuite dans toutes les cellules de l’embryon, sous forme non fluorescente. Avec un laser UV couplé au microscope Nomarski, on peut photoactiver le traceur en principe dans n’importe quelle cellule de l’embryon, au stade désiré, puis suivre les cellules ainsi marquées soit in vivo, par leur fluorescence, soit après fixation par immunohistochimie à l’aide d’un anticorps qui ne reconnaît que le fluorochrome activé. Nous avons ainsi marqué à 48 ou 72 hpf les cellules présentes dans le tronc, dans le mince espace entre aorte et veine axiale - l’AGM présomptive du poisson. Leur suivi en temps réel ou après fixation, associé aux hybridations in situ, a montré que ces cellules entrent dans la circulation pour aller ensemencer le THC, où elles se multiplient, se différencient en granulocytes et thrombocytes, ainsi qu’en précurseurs lymphoïdes qui vont aller coloniser le thymus à partir de 3 jpf (avec le phénotype c-myb+, ikaros+, runx1-, scl-), tandis que celles qui demeurent des CSH présomptives (de phénotype c-myb+, ikaros+, runx1+, scl+) vont coloniser le rein à partir de 5 jpf (Figure 2) [8].  | Figure 2.
Le voyage des précurseurs hématopoïétiques au cours du développement de poisson zèbre. A-B. Un traceur photoactivable de haut poids moléculaire (A) est injecté dans l’œuf fécondé de danio zébré (B). Piégé dans la cellule, il se trouve ensuite présent dans toutes les cellules de l’embryon. Ce traceur se compose d’un dextran (10 000 Da) lié à des molécules de fluorescéine elles-même liées de façon covalente à un groupement chimique (DMNB) qui éteint son émission de fluorescence ; cette liaison covalente est sensible au UV. C-E. À 48 hpf, l’ensemble des cellules de l’AGM est illuminé à l’aide d’un laser UV (D) ce qui permet de cliver la liaison du DMNB à la fluorescéine, restaurant ainsi sa fluorescence (C). Les cellules présentes dans l’AGM, ainsi photoactivées, émettent une fluorescence à 488nm (E). F-J. À 5 jpf, ce même embryon est fixé, et la présence de fluorescéine non liée au DMNB est détectée à l’aide d’un anticorps anti-fluorescéine couplé à la phosphatase alcaline (PA) (F). Le halo de photoactivation au niveau de l’AGM est encore visible au niveau du tronc (G), mais on voit également que les cellules issues de l’AGM ont colonisé la queue (G, J), le thymus (G, vue latérale ; H, vue ventrale ; flèche bleue), et le rein (G, vue latérale ; I, vue dorsale ; flèche rouge). ac : artère caudale ; vc : veine caudale ; ad : aorte dorsale ; va : veine axiale (figure issue du journal Immunity avec l’aimable autorisation du groupe Cell Press). |
L’embryon de danio zébré possède donc une structure homologue de l’AGM des mammifères, qui contient les CSH à 2 jpf. Celles-ci sont capables d’ensemencer d’abord le THC pour y proliférer et s’y différencier, puis de là, de migrer pour coloniser les organes hématopoïétiques définitifs, thymus et rein. Le THC joue ainsi le rôle d’organe hématopoïétique transitoire au même titre que le foie fœtal chez les mammifères. On peut se demander à présent quelle est l’origine embryologique des CSH de l’AGM, et par quels mécanismes cellulaires et moléculaires ces CSH quittent l’AGM pour aller coloniser les organes hématopoïétiques successifs. |
Travail soutenu initialement par un contrat Inserm-Avenir, et par le Programme Transversal « Cellules souches » de l’Institut Pasteur. K.K. et E.M. sont financées par la Commission Européenne dans le cadre du Programme Intégré FP6 « ZF-Models ».
|
1. Godin I, Cumano A. The hare and the tortoise: an embryonic haematopoietic race. Nat Rev Immunol 2002; 2 : 593–604. 2. Mikkola HK, Orkin SH. The journey of developing hematopoietic stem cells. Development 2006; 133 : 3733–44. 3. Godin I, Cumano A. Les cellules souches hématopoïétiques : une double origine embryonnaire ? Med Sci (Paris) 2007; 23 : 681–4. 4. Davidson AJ, Zon LI. The definitive (and primitive) guide to zebrafish hematopoiesis. Oncogene 2004; 23 : 7233–46. 5. Herbomel P, Thisse B, Thisse C. Ontogeny and behaviour of early macrophages in the zebrafish embryo. Development 1999; 126 : 3735–45. 6. Willett CE, Cortes A, Zuasti A, Zapata AG. Early hematopoiesis and developing lymphoid organs in the zebrafish. Dev Dyn 1999; 214 : 323–36. 7. Langenau DM, Ferrando AA, Traver D, et al. In vivo tracking of T cell development, ablation, and engraftment in transgenic zebrafish. Proc Natl Acad Sci USA 2004; 101 : 7369–74. 8. Murayama E, Kissa K, Zapata A, et al. Tracing hematopoietic precursor migration to successive hematopoietic organs during zebrafish development. Immunity 2006; 25 : 963–75. |