| |
| Med Sci (Paris). 2007 June; 23(6-7): 619–625. Published online 2007 June 15. doi: 10.1051/medsci/20072367619.Sperme express Est-il possible de produire des gamètes mâles in vitro en trois jours ? Mounia Guenatri and Déborah Bourc’his* Inserm U741, Université Paris 7, 2 place Jussieu, 75251 Paris Cedex 05, France |
Des cellules souches embryonnaires aux cellules souches germinales, in vivo et in vitro
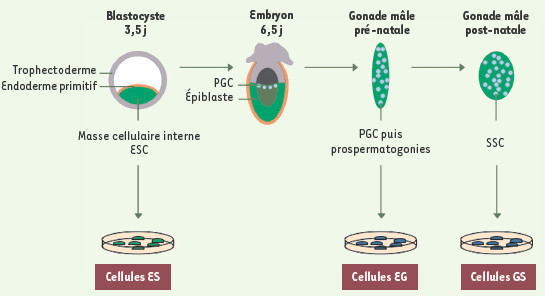
L’ovocyte fécondé est à l’origine du développement d’un organisme entier et représente à cet égard la cellule totipotente par excellence. Après quelques divisions cellulaires, au stade blastocyste, les cellules souches embryonnaires (ESC) de la masse cellulaire interne ont la capacité de donner naissance à tous les types cellulaires spécialisés, à l’exception des tissus extra-embryonnaires. Elles sont dites pluripotentes. Une sous-population de ces ESC donne naissance aux cellules germinales primordiales (PGC), qui sont des cellules souches germinales (GSC) seulement présentes pendant la vie fœtale. Chez les mâles, une deuxième population de GSC réside dans les gonades après la naissance, ce sont les cellules souches spermatogoniales (SSC) qui alimentent la voie de la spermatogenèse chez l’adulte. Les GSC ne sont pas totipotentes per se, mais perpétuent la totipotence de génération en génération : elles sont à l’origine de la production de gamètes qui, après fécondation, permettent la différenciation de tous les tissus sans exception dans l’individu en développement. Les dérivés in vitro des ESC, des PGC et des SSC sont respectivement les cellules ES, les cellules EG et les cellules GS (Figure 1). Ces modèles cellulaires conservent leur pluripotence, comme l’indique leur capacité à former les trois feuillets embryonnaires [
1–
3]. L’efficacité de dérivation des EG et des GS est cependant limitée par la rareté et les difficultés d’identification et d’accès de leurs précurseurs biologiques. De plus, leur différenciation in vitro en gamètes matures et la manipulation de leur matériel génétique ne sont pas encore réalisées en routine [
4]. Le développement d’un protocole de dérivation et de différenciation in vitro de cellules germinales à partir de cellules ES est une priorité. 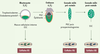 | Figure 1.
Ontogénie des différents types de cellules souches embryonnaires et germinales in vivo
et leurs dérivés in vitro. Au cours du développement embryonnaire, la masse cellulaire interne (ICM) (vert) du blastocyste est composée de cellules souches embryonnaires (ESC). Ces cellules peuvent êtres dérivées in vitro et sont appelées cellules ES. Au jour 6 de développement, les cellules germinales primordiales (PGC) (bleu) se développent au sein de l’épiblaste proximal dérivant de l’ICM. Après une phase de prolifération et de migration, les PGC colonisent les ébauches gonadiques vers J11,5. Chez les mâles, les PGC prolifèrent jusqu’à J15,5 où elles entrent en phase de quiescence (stade prospermatogonies). Les dérivés in vitro des PGC et des prospermatogonies présentes pendant la vie prénatale sont les cellules EG. Enfin, un autre type de cellules souches germinales réside dans les gonades après la naissance, ce sont les cellules souches spermatogoniales (SSC) qui alimentent la voie spermatogénétique chez l’adulte et à partir desquelles sont dérivées les cellules GS. |
Les ESC peuvent se spécialiser en PGC au cours du développement [
5,
6]. Les cellules ES dérivées in vitro sont aussi capables de coloniser la lignée germinale in vivo après injection dans un blastocyste. Plusieurs laboratoires ont récemment réussi à imposer un destin germinal à des cellules ES dans une boîte de culture [
7–
11]. Ces GSC dérivées de cellules ES peuvent être différenciées après culture en spermatides ou en ovocytes, suivant la composition chromosomique XY ou XX des cellules ES d’origine. Cependant, ces modèles cellulaires de différenciation germinale ne reproduisent pas les caractéristiques spatiales et temporelles du développement gamétique in vivo, et se pose légitimement la question de l’intégrité génétique et épigénétique des cellules germinales dérivées des cellules ES et de leur utilisation potentielle en médecine reproductive. Les contraintes d’environnement et de cinétique sont notamment cruciales pour la reprogrammation des profils de méthylation de l’ADN qui accompagnent la différenciation germinale mâle [
12]. |
Mise au point d’un protocole de dérivation in vitro de GSC mâles à partir de cellules ES Spécification des cellules germinales primordiales La dissection des mécanismes de spécification des cellules germinales primordiales au cours du développement a été décisive pour l’élaboration des protocoles de dérivation de GSC à partir de cellules ES [ 5, 6]. Chez la souris, les PGC se développent au sein de l’épiblaste proximal à 6 jours (Figure 1), sous l’impulsion de facteurs de croissance produits par l’ectoderme extra-embryonnaire avoisinant tels que Bmp4 (bone morphogenic protein). Les PGC sont identifiables pour la première fois à 7,25 jours de développement à la base de l’allantoïde par leur propriété à exprimer la phosphatase alcaline et divers autres marqueurs de pluripotence. Les PGC entrent alors en phase de prolifération et de migration de 8,5 à 9,5 jours et colonisent les ébauches gonadiques entre 10,5 et 11,5 jours. Les gonades acquièrent des signes distinctifs mâles ou femelles à 12,5 jours, respectivement déterminés par la présence ou l’absence du gène Sry (chromosome Y). Le sexe génétique des gonades influence à 13,5 jours la décision des PGC d’entrer en méiose ou en mitose [
13]. Les PGC femelles colonisant les ébauches ovariennes s’engagent en prophase de méiose I. Il s’agit d’un processus par défaut puisque les PGC mâles positionnées en dehors des gonades mâles (par migration illégitime ou par transplantation artificielle) adoptent aussi un destin méiotique mais dégénèrent rapidement. Les PGC mâles intégrées dans les gonades mâles répondent à des déterminants sécrétés par les cellules de Sertoli environnantes et conservent leur activité mitotique jusqu’à 14,5 jours. Elles entrent alors en phase de quiescence G0/G1 et prennent le nom de prospermatogonies. Cet arrêt mitotique est levé à la naissance et les prospermatogonies se différencient en cellules spermatogoniales souches (SSC), dont les divisions asymétriques produisent des cellules à capacité d’auto-renouvellement qui maintiennent la réserve de cellules précurseurs, et des cellules s’engageant dans le processus de différenciation spermatogénétique pour produire les spermatozoïdes [
14]. Différenciation de cellules ES en GSC de type PGC L’identification de voies génétiques communes et distinctes entre les cellules souches embryonnaires et germinales a constitué la seconde grande avancée dans la quête du protocole de dérivation de GSC à partir de cellules ES (Figure 2) [
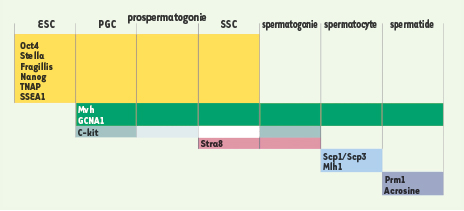
15]. Les cellules ES et les GSC partagent les mêmes marqueurs moléculaires de pluripotence tels que Oct4, SSEA1, Stella, Nanog et la phosphatase alcaline. Les GSC fœtales et adultes expriment en plus des facteurs liés à la lignée germinale comme Mvh ( mouse vasa homolog) et GCNA1 ( germ cell nuclear antigen 1). Il est à noter que les PGC expriment spécifiquement le marqueur c-kit, alors que les SSC expriment spécifiquement Stra8 ( stimulated by retinoic acid 8). Enfin, la prolifération des GSC est stimulée in vitro par l’acide rétinoïque alors que ce même agent induit la différenciation et la perte de pluripotence des cellules ES [
16].  | Figure 2.
Déterminants moléculaires associés aux cellules ES, aux GSC mâles et aux différentes phases de la spermatogenèse. Les marqueurs de pluripotence (jaune) sont communs aux cellules ES, PGC, prospermatogonies et SSC. Les marqueurs liés à la lignée germinale (vert) sont exprimés à partir des PGC et tout au long de la spermatogenèse. Des déterminants spécifiques sont exprimés à des stades clés au cours de la différenciation gamétique mâle : c-kit (gris) dans les PGC et dans une moindre mesure dans les prospermatogonies. C-kit n’est pas exprimé dans les SSC mais réapparaît dans les spermatogonies en phase de multiplication [ 15] ; Stra8 (rose) est exprimé au cours de la vie post-natale dans les SSC et se maintient dans les spermatogonies. Enfin, divers marqueurs associés à la différenciation terminale (bleu) sont exprimés dans les spermatocytes et spermatides. |
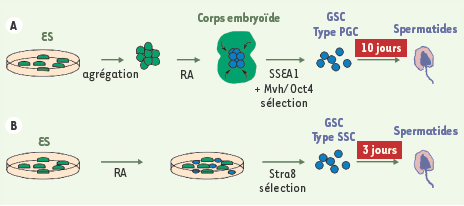
Grâce à ces connaissances, comment a-t-il été possible d’imposer un destin germinal à des cellules ES dans une boîte de culture ? Les groupes de T. Noce et G.Q. Daley ont eu recours à des stratégies expérimentales similaires, fondées sur la reconnaissance d’une population émergente de cellules germinales dans des corps embryoïdes, qui sont des structures cellulaires tridimensionnelles issues de la différenciation d’agrégats de cellules ES en réponse à un traitement par l’acide rétinoïque (RA) (Figure 3A) [7,
9]. Ce protocole a également été appliqué avec succès à des cellules ES humaines [
10]. Trois à 7 jours de différenciation sont suffisants pour voir apparaître spontanément et fréquemment des GSC, reconnaissables par l’expression conjointe de marqueurs de pluripotence et de « germinalité » (respectivement SSEA1/Oct4 et Mvh). L’adjonction de déterminants moléculaires de spécification des PGC comme Bmp4 améliore le rendement de cette méthode. Les corps embryoïdes reproduisent une organisation tissulaire remarquablement similaire aux ébauches gonadiques fœtales. L’expression du récepteur de l’hormone lutéinisante et du facteur anti-müllerien dans ces corps embryoïdes révèle la présence respective de cellules de Leydig et de cellules de Sertoli. Ces cellules constituent le compartiment somatique des gonades et assurent la fonction endocrine et la différenciation sexuelle mâle de cet organe, et en conséquence l’orientation vers un destin mitotique des PGC mâles. Dans ces structures, les cellules germinales émergentes sont localisées à proximité de cellules hématopoïétiques, comme au cours du développement embryonnaire normal. Les corps embryoïdes constitueraient donc un microenvironnement favorable au développement in vitro d’une niche germinale de type PGC. Ces cellules peuvent être isolées par cytométrie de flux et maintenues en culture à l’état pluripotent, puis leur différenciation induite soit en spermatozoïdes après transplantation dans un testicule donneur [7], ou in vitro en spermatides après 10 jours de culture [9]. Les gènes requis pour les étapes-clés de la spermatogenèse liées à la méiose et à la maturation spermatidique sont bien exprimés au cours de la différenciation in vitro. Enfin, le pouvoir fécondant des spermatides in vitro a été démontré par l’obtention de blastocystes après injection intracytoplasmique dans des ovocytes (ICSI), mais il n’existe pas de données quant à leur capacité à promouvoir le développement embryonnaire au-delà de l’implantation.  | Figure 3.
Deux stratégies expérimentales différentes pour l’obtention in vitro de GSC à partir de cellules ES et leur différenciation en spermatides. A. Selon les groupes de T. Noce et G.Q. Daley, la différenciation d’agrégats de cellules ES (vert) par l’acide rétinoïque (RA) permet l’obtention d’une population de cellules germinale GSC (bleu) au sein des corps embryoïdes. La sélection de ces cellules par les marqueurs SSEA1/Mvh et leur stimulation par Bmp4 indique une identité de type PGC. Les corps embryoïdes abritent de plus des cellules somatiques gonadiques qui synthétisent des déterminants (flèches) requis pour la spécification sexuelle des PGC in vivo. La différenciation in vitro de ces GSC en spermatides se fait après 10 jours de culture. B. Le groupe de W. Engel utilise une méthode en deux dimensions sur boîte de Pétri pour dériver des GSC après induction de cellules ES par l’acide rétinoïque (RA). Le recours à Stra8 comme marqueur oriente vers une sélection de GSC type SSC (voir Figure 2). La différenciation en spermatides est achevée en 3 jours. |
Différenciation de cellules ES en GSC de type SSC Plus récemment, le groupe de W. Engel a développé une technique permettant d’obtenir des GSC toujours par traitement de cellules ES par l’acide rétinoïque mais dans un système en deux dimensions [ 11]. Contrairement aux groupes précédents qui avaient isolé des GSC de type PGC, les auteurs ont ici dérivé des GSC de type SSC, définies par l’utilisation du marqueur spécifique Stra8 dans leur stratégie de sélection et confirmées par l’absence d’expression de c-kit ( Figures 2 et 3B) [ 15]. L’effervescence médiatique suscitée par ce travail est liée au fait que les auteurs ont pu ensuite différencier in vitro des spermatides en 3 jours (contre 10 jours précédemment) et que la fonctionnalité de ces gamètes in vitro a été démontrée au-delà du développement préimplantatoire par la naissance d’animaux viables après ICSI ( intracytoplasmic sperm injection). Cette prouesse technique s’accompagne cependant de nombreuses questions quant à la validité d’une telle méthode car peu d’animaux dérivés de ces gamètes synthétiques se développent jusqu’à la naissance, et les quelques animaux nés présentent des anomalies de croissance et meurent prématurément. Plusieurs arguments développés ci-dessous laissent penser que les spermatides dérivés de cellules ES ont des anomalies d’identité cellulaire, ce qui a des répercussions sur leur intégrité génétique et épigénétique. Le choix d’une méthode accélérée de dérivation in vitro bidimensionnelle et la stratégie de sélection de cellules souches germinales de type SSC plutôt que PGC accentueraient de plus ces anomalies. |
Cinétique perturbée : effet sur l’identité cellulaire et l’intégrité génétique Le cycle spermatogénétique (de la SSC au spermatozoïde) requiert 35 jours chez la souris (Figure 4) [
17]. La spermatogenèse implique une étape de multiplication des spermatogonies, une phase d’échange de matériel génétique et de réduction chromosomique dans les spermatocytes en méiose I et II, et une phase de maturation finale aboutissant à la formation des spermatides et enfin des spermatozoïdes. La progression de ces phases est-elle respectée en 10 jours ou 3 jours ? La phase de multiplication des spermatogonies consiste en un enchaînement de 6 divisions mitotiques (spermatogonies A1, A2, A3, A4, intermédiaires et B), aboutissant à une production de 64 cellules à partir d’une cellule SSC [14]. Aucune donnée n’est disponible quant au rendement des procédures de différenciation in vitro et il est donc difficile d’estimer si cette phase d’amplification est respectée. Le marqueur de prolifération des spermatogonies, c-kit, est bien exprimé après l’induction de la différenciation attestant de l’entrée des cellules dans le cycle spermatogénétique (Figure 2), mais cette expression coexiste avec l’expression de marqueurs spécifiques des phases suivantes de la spermatogenèse, méiotique et post-méiotique. Deux interprétations sont possibles : (1) la différenciation in vitro produit dès 3 jours une population hétérogène de cellules à différents stades de différenciation malgré une induction simultanée, ou (2) chacune de ces cellules exprime simultanément des marqueurs pré-méiotiques, méiotiques et post-méiotiques, traduisant un programme anarchique de différenciation sans respect de l’enchaînement séquentiel des différentes phases de la spermatogenèse. 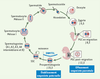 | Figure 4.
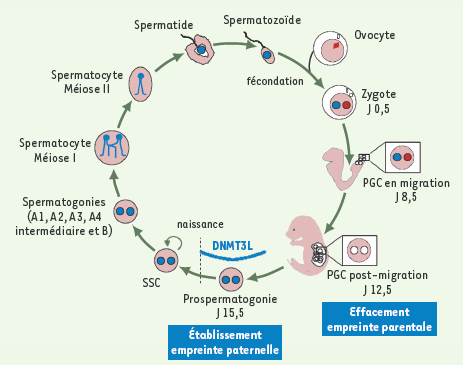
Cycle de l’empreinte parentale au cours de la gamétogenèse mâle chez la souris. L’empreinte parentale est établie au cours de la gamétogenèse. Au moment de la fécondation, les spermatozoïdes sont porteurs d’une empreinte paternelle (bleu) et les ovocytes d’une empreinte maternelle (rouge). Les cellules germinales primordiales (PGC) émergent à J6,5 et sont retrouvées à la base de l’allantoïde à J8,5. À ce stade l’empreinte parentale est toujours de type biparentale somatique (bleu + rouge). Entre J8,5 et 11,5, les PGC migrent pour rejoindre les ébauches gonadiques. L’effacement de l’empreinte parentale s’effectue dans ces PGC post-migration à J12,5. Les PGC intégrés dans les ébauches gonadiques mâles prolifèrent jusqu’à J15,5 où elles entrent en phase de quiescence (stade prospermatogonies). À ce stade, l’empreinte paternelle (bleu) est établie par méthylation de l’ADN sous l’action de l’homologue d’ADN-méthyltransférase DNMT3L. A la naissance les prospermatogonies se différencient en SSC mitotiquement actives. Les SSC ont une capacité d’auto-renouvellement alimentant le pool de cellules souches, et de différenciation passant par divers intermédiaires (spermatogonies, spermatocytes et spermatides) pour produire des gamète haploïdes mâles matures (spermatozoïdes) porteurs d’une empreinte paternelle. |
La méiose pourrait être particulièrement sensible à cette compaction du temps de spermatogenèse, en raison de sa durée (10 jours), mais également des contrôles de qualité du matériel génétique qui opèrent pendant cette période. Un point de contrôle (check-point) très strict existe au stade pachytène de prophase de méiose I, contrôlant l’appariement de tous les autosomes homologues et induisant une réponse apoptotique en cas de non-conformité afin de prévenir la production de cellules avec un nombre aberrant de chromosomes [
18]. Les spermatides dérivés de cellules ES ont bien un contenu d’ADN égal à 1n déterminé par cytométrie de flux, suggérant que la réduction méiotique a bien eu lieu. On ne peut cependant pas exclure des pertes ou des gains de 1 ou 2 chromosomes, attendus en cas d’un défaut d'activation du check-point. Les forts taux d’échec d’implantation des embryons dérivés des spermatides synthétiques et de mortalité prénatale pourraient refléter des aberrations de nombre des chromosomes portés par ces spermatides et transmises à la descendance. |
PGC ou SSC : effet sur l’identité épigénétique parentale La gamétogenèse n’est pas seulement responsable de la création d’un état de totipotence et de la mise en place de l’hérédité génétique. Elle permet également l’acquisition de marques de distinction parentale reconnues sous le terme d’empreinte génomique et qui déterminent le profil d’expression parent-spécifique d’une centaine de gènes avec des effets prépondérants sur le développement embryonnaire et post-natal [12,
19]. La mise en place de l’empreinte correspond à un marquage par méthylation de l’ADN des gènes soumis à empreinte paternelle et maternelle, respectivement dans les gamètes mâles et femelles. Cette fonction fait intervenir l’ADN méthyltransférase de novo DNMT3A, dont l’activité est stimulée par l’homologue d’ADN méthyltransférase DNMT3L [
20]. DNMT3L est catalytiquement inactive mais orchestre la mise en place des profils de méthylation dans la lignée germinale [
21–
23]. En ce qui concerne l’empreinte paternelle, les marques de méthylation sont acquises dans les prospermatogonies, cellules intermédiaires entre les PGC et les SSC, présentes dans les gonades mâles de 14,5 jours de développement à quelques jours après la naissance (Figure 4) [
24]. Cette fenêtre précise coïncide avec l’expression spécifique de Dnmt3L au cours de la spermatogenèse, alors que Dnmt3A a un profil d’expression plus large [
22,
25]. Les marques d’empreinte sont ensuite maintenues au cours des stades suivants de la spermatogenèse et après fécondation dans l’individu en développement. Les PGC pré-migratoires et en phase de migration ont une empreinte biparentale de type somatique, comme toutes les cellules de l’embryon. Ces marques doivent être effacées, afin de permettre le rétablissement de l’empreinte en fonction du sexe de l’individu [
26,
27]. L’entrée dans les gonades déclenche aux alentours de 11,5 jours un effacement des marques de méthylation somatiques. L’environnement gonadique mâle détermine ensuite non seulement l’engagement des PGC vers un destin mitotique mâle, mais aussi l’acquisition subséquente de marques d’empreinte paternelle [
28]. Dériver des GSC mâles matures à partir de cellules ES implique qu’il faille : (1) effacer les marques d’empreinte somatique des cellules ES, comme cela se produit in vivo dans les PGC qui colonisent les gonades, puis (2) établir un profil d’empreinte paternelle dans ces cellules au cours de leur différenciation in vitro. Les corps embryoïdes utilisés par les groupes de Daley et Noce reproduisent un environnement gonadique propice à la formation de GSC de type PGC [7, 9] et qui pourrait également stimuler la reprogrammation de l’empreinte dans ces cellules. Les profils de méthylation biparentaux sont effectivement effacés, à condition cependant que les cellules soient maintenues pendant une semaine à l’état indifférencié [9]. On ne sait pas si ces cellules acquièrent ensuite des marques de méthylation paternelles au cours de leur différenciation. Le groupe de Engel utilise une méthode de culture bidimensionnelle qui ne reproduit pas une architecture tissulaire analogue à des ébauches gonadiques et sélectionne de plus des GSC de type SSC [11]. Cela implique que les types cellulaires correspondant aux phases d’effacement (PGC) et d’acquisition (prospermatogonies) des marques de méthylation paternelles ont été court-circuités lors de cette dérivation. Les GSC de type SSC et les spermatides issus de leur différenciation montrent effectivement des aberrations de méthylation des gènes soumis à empreinte paternelle tels que H19, et soumis à empreinte maternelle tels que Snrpn et Igf2R. Les anomalies de méthylation semblent complètement aléatoires et ne permettent pas de discerner des défauts d’effacement des marques d’empreinte somatiques, d’établissement de l’empreinte paternelle ou d’acquisition illégitime d’empreinte maternelle dans les gamètes mâles dérivés in vitro. La dérivation de cellules type SSC plutôt que PGC n’est donc pas adéquate pour la reprogrammation de l’empreinte, et la différenciation in vitro n’est pas non plus suffisante pour stimuler des mécanismes de correction d’empreinte défectueuse. Une analyse du profil d’expression de DNMT3A et DNMT3L dans chacun des modèles permettrait de révéler si la machinerie d’acquisition de l’empreinte est bien présente et dans quel type cellulaire. Cette étude serait particulièrement informative pour DNMT3L, dont le profil d’expression spatial et temporel coïncide parfaitement avec la cinétique d’acquisition de l’empreinte dans la lignée germinale mâle et femelle [21, 22]. Des anomalies de méthylation des gènes soumis à empreinte sont retrouvées chez les animaux nés de l’injection ovocytaire intracytoplasmique de ces spermatides dérivés de cellules ES. Le phénotype de croissance et de létalité précoce des quelques animaux nés de cette procédure montre des similarités flagrantes avec les animaux issus de clonage par transfert de noyau somatique où des aberrations de méthylation et de régulation des gènes soumis à empreinte sont également documentées [
29]. Le débat quant à l’utilisation potentielle de la technique de clonage à des fins thérapeutiques, et stimulé par ces anomalies d’empreinte [
30], est finalement transférable à l’utilisation potentielle en médecine reproductive de gamètes issus de méthodes de dérivation et différenciation in vitro.

|
1. Matsui Y, Zsebo K, Hogan BL. Derivation of pluripotential embryonic stem cells from murine primordial germ cells in culture. Cell 1992; 70 : 841–7. 2. Kanatsu-Shinohara M, Inoue K, Lee J, et al. Generation of pluripotent stem cells from neonatal mouse testis. Cell 2004; 119 : 1001–12. 3. Guan K, Nayernia K, Maier LS, et al. Pluripotency of spermatogonial stem cells from adult mouse testis. Nature 2006; 440 : 1199–203. 4. Ryu BY, Orwig KE, Oatley JM, et al. Efficient generation of transgenic rats through the male germline using lentiviral transduction and transplantation of spermatogonial stem cells. J Androl 2007; 28 : 353–60. 5. Machev N, Fuhrmann G, Viville S. Ontogenèse des cellules germinales primordiales. Med Sci (Paris) 2004; 20 : 1091–5. 6. Saitou M, Payer B, Lange UC, et al. Specification of germ cell fate in mice. Philos Trans R Soc Lond B Biol Sci 2003; 358 : 1363–70. 7. Toyooka Y, Tsunekawa N, Akasu R, et al. Embryonic stem cells can form germ cells in vitro. Proc Natl Acad Sci USA 2003; 100 : 11457–62. 8. Hubner K, Fuhrmann G, Christenson LK, et al. Derivation of oocytes from mouse embryonic stem cells. Science 2003; 300 : 1251–6. 9. Geijsen N, Horoschak M, Kim K, et al. Derivation of embryonic germ cells and male gametes from embryonic stem cells. Nature 2004; 427 : 148–54. 10. Clark AT, Bodnar MS, Fox M, et al. Spontaneous differentiation of germ cells from human embryonic stem cells in vitro. Hum Mol Genet 2004; 13 : 727–39. 11. Nayernia K, Nolte J, Michelmann HW, et al.
In vitro-differentiated embryonic stem cells give rise to male gametes that can generate offspring mice. Dev Cell 2006; 11 : 125–3. 12. Trasler JM. Gamete imprinting: setting epigenetic patterns for the next generation. Reprod Fertil Dev 2006; 18 : 63–9. 13. McLaren A. Germ and somatic cell lineages in the developing gonad. Mol Cell Endocrinol 2000; 163 : 3–9. 14. De Rooij DG. Proliferation and differentiation of spermatogonial stem cells. Reproduction 2001; 121 : 347–54. 15. Matzuk MM. Germ-line immortality. Proc Natl Acad Sci USA 2004; 101 : 16395–6. 16. Koshimizu U, Watanabe M, Nakatsuji N. Retinoic acid is a potent growth activator of mouse primordial germ cells in vitro. Dev Biol 1995; 2 : 683–5. 17. Clermont Y. Kinetics of spermatogenesis in mammals: seminiferous epithelium cycle and spermatogonial renewal. Physiol Rev 1972; 52 : 198–236. 18. Odorisio T, Rodriguez TA, Evans EP, et al. The meiotic checkpoint monitoring synapsis eliminates spermatocytes via p53-independent apoptosis. Nat Genet 1998; 18 : 257–61. 19. Reik W, Walter J. Genomic imprinting: parental influence on the genome. Nat Rev Genet 2001; 2 : 21–32. 20. Chen ZX, Mann JR, Hsieh CL, et al. Physical and functional interactions between the human DNMT3L protein and members of the de novo methyltransferase family. J Cell Biochem 2005; 1 : 902–17. 21. Bourc’his D, Xu GL, Lin CS, et al. Dnmt3L and the establishment of maternal genomic imprints. Science 2001; 294 : 2536–9. 22. Bourc’his D, Bestor TH. Meiotic catastrophe and retrotransposon reactivation in male germ cells lacking Dnmt3L. Nature 2004; 431 : 96–9. 23. Kaneda M, Okano M, Hata K, et al. Essential role for de novo DNA methyltransferase Dnmt3a in paternal and maternal imprinting. Nature 2004; 429 : 900–3. 24. Li JY, Lees-Murdock DJ, Xu GL, et al. Timing of establishment of paternal methylation imprints in the mouse. Genomics 2004; 84 : 952–60. 25. La Salle S, Trasler JM. Dynamic expression of DNMT3a and DNMT3b isoforms during male germ cell development in the mouse. Dev Biol 2006; 296 : 71–82. 26. Lee J, Inoue K, Ono R, et al. Erasing genomic imprinting memory in mouse clone embryos produced from day 11.5 primordial germ cells. Development 2002; 129 : 1807–17. 27. Hajkova P, Erhardt S, Lane N, et al. Epigenetic reprogramming in mouse primordial germ cells. Mech Dev 2002; 117 : 15–23. 28. Durcova-Hills G, Hajkova P, Sullivan S, et al. Influence of sex chromosome constitution on the genomic imprinting of germ cells. Proc Natl Acad Sci USA 2006; 25 : 11184–8. 29. Mann MR, Chung YG, Nolen LD, et al. Disruption of imprinted gene methylation and expression in cloned preimplantation stage mouse embryos. Biol Reprod 2003; 69 : 902–14. 30. Beaujean N, Martin C, Debey P, et al. Reprogrammation et épigenèse. Med Sci (Paris) 2005; 21 : 412–21. |