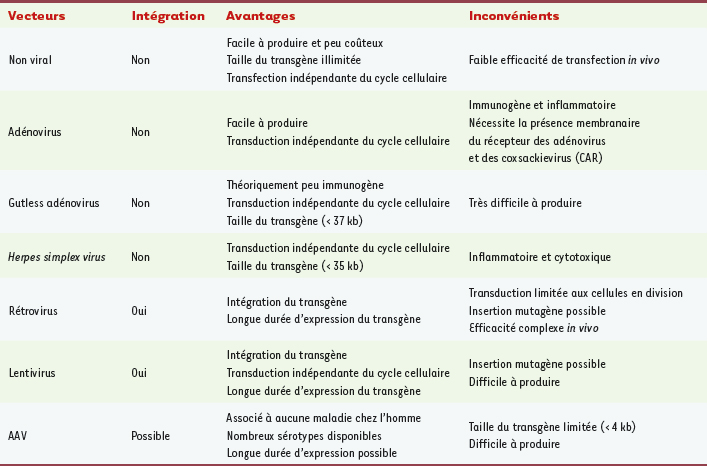
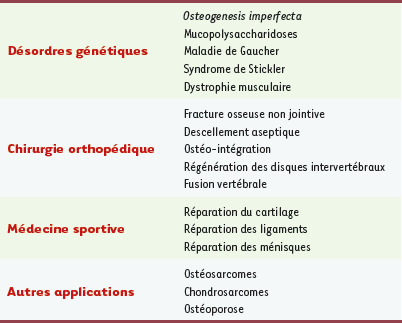
1.
Cavazzana-Calvo M, Hacein-Bey S, de Saint Basile G, et al. Gene therapy of human severe combined immunodeficiency (SCID)-X1 disease. Science 2000; 288 : 669–72.
2.
Gaspar HB, Parsley KL, Howe S, et al. Gene therapy of X-linked severe combined immunodeficiency by use of a pseudotyped gammaretroviral vector. Lancet 2004; 364 : 2181–7.
3.
Hacein-Bey-Abina S, Von Kalle C, Schmidt M, et al. LMO2-associated clonal T cell proliferation in two patients after gene therapy for SCID-X1. Science 2003; 302 : 415–9.
4.
Palmer GD, Steinert A, Pascher A, et al. Gene-induced chondrogenesis of primary mesenchymal stem cells in vitro. Mol Ther 2005; 12 : 219–28.
5.
Gouze JN, Gouze E, Palmer GD, et al. A comparative study of the inhibitory effects of interleukin-1 receptor antagonist following administration as a recombinant protein or by gene transfer. Arthritis Res Ther 2003; 5 : R301–9.
6.
Makarov SS, Olsen JC, Johnston WN, et al. Suppression of experimental arthritis by gene transfer of interleukin 1 receptor antagonist cDNA. Proc Natl Acad Sci USA 1996; 93 : 402–6.
7.
Sant SM, Suarez TM, Moalli MR, et al. Molecular lysis of synovial lining cells by in vivo herpes simplex virus-thymidine kinase gene transfer. Hum Gene Ther 1998; 9 : 2735–43.
8.
Goossens PH, Schouten GJ, ’t Hart BA, et al. Feasibility of adenovirus-mediated nonsurgical synovectomy in collagen-induced arthritis-affected rhesus monkeys. Hum Gene Ther 1999; 10 : 1139–49.
9.
Yao Q, Glorioso JC, Evans CH, et al. Adenoviral mediated delivery of FAS ligand to arthritic joints causes extensive apoptosis in the synovial lining. J Gene Med 2000; 2 : 210–9.
10.
Zhang H, Yang Y, Horton JL, et al. Amelioration of collagen-induced arthritis by CD95 (Apo-1/Fas)-ligand gene transfer. J Clin Invest 1997; 100 : 1951–7.
11.
Chan JM, Villarreal G, Jin WW, et al. Intraarticular gene transfer of TNFR : Fc suppresses experimental arthritis with reduced systemic distribution of the gene product. Mol Ther 2002; 6 : 727–36.
12.
Zhang HG, Xie J, Yang P, et al. Adeno-associated virus production of soluble tumor necrosis factor receptor neutralizes tumor necrosis factor alpha and reduces arthritis. Hum Gene Ther 2000; 11 : 2431–42.
13.
Pan RY, Chen SL, Xiao X, et al. Therapy and prevention of arthritis by recombinant adeno-associated virus vector with delivery of interleukin-1 receptor antagonist. Arthritis Rheum 2000; 43 : 289–97.
14.
Gouze E, Pawliuk R, Gouze JN, et al. Lentiviral-mediated gene delivery to synovium : potent intra-articular expression with amplification by inflammation. Mol Ther 2003; 7 : 460–6.
15.
Lubberts E, Joosten LA, van Den Bersselaar L, et al. Adenoviral vector-mediated overexpression of IL-4 in the knee joint of mice with collagen-induced arthritis prevents cartilage destruction. J Immunol 1999; 163 : 4546–56.
16.
Setoguchi K, Misaki Y, Araki Y, et al. Antigen-specific T cells transduced with IL-10 ameliorate experimentally induced arthritis without impairing the systemic immune response to the antigen. J Immunol 2000; 165 : 5980–6.
17.
Goldring MB, Birkhead JR, Suen LF, et al. Interleukin-1 beta-modulated gene expression in immortalized human chondrocytes. J Clin Invest 1994; 94 : 2307–16.
18.
Nixon AJ, Haupt JL, Frisbie DD, et al. Gene-mediated restoration of cartilage matrix by combination insulin-like growth factor-I/interleukin-1 receptor antagonist therapy. Gene Ther 2005; 12 : 177–86.
19.
Pelletier JP, Caron JP, Evans C, et al.
In vivo suppression of early experimental osteoarthritis by interleukin-1 receptor antagonist using gene therapy. Arthritis Rheum 1997; 40 : 1012–9.
20.
Frisbie DD, Ghivizzani SC, Robbins PD, et al. Treatment of experimental equine osteoarthritis by in vivo delivery of the equine interleukin-1 receptor antagonist gene. Gene Ther 2002; 9 : 12–20.
21.
Zhang X, Mao Z, Yu C. Suppression of early experimental osteoarthritis by gene transfer of interleukin-1 receptor antagonist and interleukin-10. J Orthop Res 2004; 22 : 742–50.
22.
Li WJ, Tuli R, Okafor C, et al. A three-dimensional nanofibrous scaffold for cartilage tissue engineering using human mesenchymal stem cells. Biomaterials 2005; 26 : 599–609.
23.
Pascher A, Palmer GD, Steinert A, et al. Gene delivery to cartilage defects using coagulated bone marrow aspirate. Gene Ther 2004; 11 : 133–41.
24.
Nakamura Y, Nawata M, Wakitani S. Expression profiles and functional analyses of Wnt-related genes in human joint disorders. Am J Pathol 2005; 167 : 97–105.
25.
Tyler JA. Insulin-like growth factor 1 can decrease degradation and promote synthesis of proteoglycan in cartilage exposed to cytokines. Biochem J 1989; 260 : 543–8.
26.
Lafeber FP, van Roy HL, van der Kraan PM, et al. Transforming growth factor-beta predominantly stimulates phenotypically changed chondrocytes in osteoarthritic human cartilage. J Rheumatol 1997; 24 : 536–42.
27.
Tchetina EV, Squires G, Poole AR. Increased type II collagen degradation and very early focal cartilage degeneration is associated with upregulation of chondrocyte differentiation related genes in early human articular cartilage lesions. J Rheumatol 2005; 32 : 876–86.
28.
Palmer G, Pascher A, Gouze E, et al. Development of gene-based therapies for cartilage repair. Crit Rev Eukaryot Gene Expr 2002; 12 : 259–73.
29.
Gelse K, Jiang QJ, Aigner T, et al. Fibroblast-mediated delivery of growth factor complementary DNA into mouse joints induces chondrogenesis but avoids the disadvantages of direct viral gene transfer. Arthritis Rheum 2001; 44 : 1943–53.
30.
Gouze JN, Bianchi A, Becuwe P, et al. Glucosamine modulates IL-1-induced activation of rat chondrocytes at a receptor level, and by inhibiting the NF-kappa B pathway. FEBS Lett 2002; 510 : 166–70.
31.
Gouze JN, Gouze E, Palmer GD, et al. Adenovirus-mediated gene transfer of glutamine : fructose-6-phosphate amidotransferase antagonizes the effects of interleukin-1beta on rat chondrocytes. Osteoarthritis Cartilage 2004; 12 : 217–24.
32.
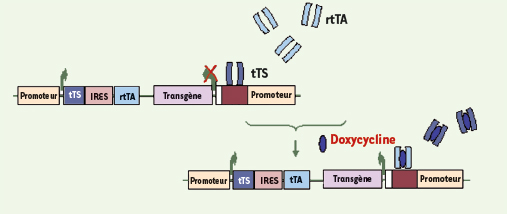
Perez N, Plence P, Millet V, et al. Tetracycline transcriptional silencer tightly controls transgene expression after in vivo intramuscular electrotransfer : application to interleukin 10 therapy in experimental arthritis. Hum Gene Ther 2002; 13 : 2161–72.
33.
Lamartina S, Silvi L, Roscilli G, et al. Construction of an rtTA2(s)-m2/tts(kid)-based transcription regulatory switch that displays no basal activity, good inducibility, and high responsiveness to doxycycline in mice and non-human primates. Mol Ther 2003; 7 : 271–80.
34.
Salucci V, Scarito A, Aurisicchio L, et al. Tight control of gene expression by a helper-dependent adenovirus vector carrying the rtTA2(s)-M2 tetracycline transactivator and repressor system. Gene Ther 2002; 9 : 1415–21.
35.
Favre D, Blouin V, Provost N, et al. Lack of an immune response against the tetracycline-dependent transactivator correlates with long-term doxycycline-regulated transgene expression in nonhuman primates after intramuscular injection of recombinant adeno-associated virus. J Virol 2002; 76 : 11605–11.
36.
Latta-Mahieu M, Rolland M, Caillet C, et al. Gene transfer of a chimeric trans-activator is immunogenic and results in short-lived transgene expression. Hum Gene Ther 2002; 13 : 1611–20.
37.
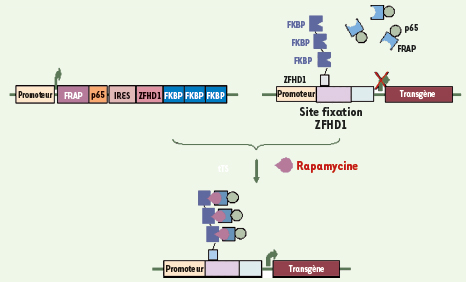
Wang J, Voutetakis A, Papa M, et al. Rapamycin control of transgene expression from a single AAV vector in mouse salivary glands. Gene Ther 2006; 13 : 187–90.
38.
Rivera VM, Clackson T, Natesan S, et al. A humanized system for pharmacologic control of gene expression. Nat Med 1996; 2 : 1028–32.
39.
Xu ZL, Mizuguchi H, Mayumi T, Hayakawa T. Regulated gene expression from adenovirus vectors : a systematic comparison of various inducible systems. Gene 2003; 309 : 145–51.
40.
Chong H, Ruchatz A, Clackson T, et al. A system for small-molecule control of conditionally replication-competent adenoviral vectors. Mol Ther 2002; 5 : 195–203.
41.
van de Loo FA, de Hooge AS, Smeets RL, et al. An inflammation-inducible adenoviral expression system for local treatment of the arthritic joint. Gene Ther 2004; 11 : 581–90.
42.
Bakker AC, van de Loo FA, Joosten LA, et al. C3-Tat/HIV-regulated intraarticular human interleukin-1 receptor antagonist gene therapy results in efficient inhibition of collagen-induced arthritis superior to cytomegalovirus-regulated expression of the same transgene. Arthritis Rheum 2002; 46 : 1661–70.
43.
Li S, Ma Z. Nonviral gene therapy. Curr Gene Ther 2001; 1 : 201–26.
44.
Evans CH, Ghivizzani SC, Robbins PD. The 2003 Nicolas Andry Award. Orthopaedic gene therapy. Clin Orthop Relat Res 2004; 316–29.
45.
Kim SH, Kim S, Robbins PD. Retroviral vectors. Adv Virus Res 2000; 55 : 545–63.
46.
Smith-Arica JR, Bartlett JS. Gene therapy : recombinant adeno-associated virus vectors. Curr Cardiol Rep 2001; 3 : 43–9.
47.
Zhang YC, Powers M, Wasserfall C, et al. Immunity to adeno-associated virus serotype 2 delivered transgenes imparted by genetic predisposition to autoimmunity. Gene Ther 2004; 11 : 233–40.
48.
Bouchard S, MacKenzie TC, Radu AP, et al. Long-term transgene expression in cardiac and skeletal muscle following fetal administration of adenoviral or adeno-associated viral vectors in mice. J Gene Med 2003; 5 : 941–50.
49.
Rivera VM, Gao GP, Grant RL, et al. Long-term pharmacologically regulated expression of erythropoietin in primates following AAV-mediated gene transfer. Blood 2005; 105 : 1424–30.
50.
Stieger K, Le Meur G, Lasne F, et al. Long-term doxycycline-regulated transgene expression in the retina of nonhuman primates following subretinal injection of recombinant AAV vectors. Mol Ther 2006; 13 : 967–75.
51.
Evans CH, Ghivizzani SC, Robbins PD. Gene therapy for arthritis : What next ? Arthritis Rheum 2006; 54 : 1714–29.
52.
Heald A, Pate G. Clinical studies of intra-articular administration of a recombinant adeno-associated vector containing a TNF-antagonist gene in inflammatory arthritis. Baltimore : ASGT 9th Annual Meeting, 2006.
53.
Apparailly F, Khoury M, Vervoordeldonk MJ, et al. Adeno-associated virus pseudotype 5 vector improves gene transfer in arthritic joints. Hum Gene Ther 2005; 16 : 426–34.
54.
McCarty DM, Fu H, Monahan PE, et al. Adeno-associated virus terminal repeat (TR) mutant generates self-complementary vectors to overcome the rate-limiting step to transduction in vivo. Gene Ther 2003; 10 : 2112–8.
55.
Evans CH, Robbins PD, Ghivizzani SC, et al. Gene transfer to human joints : progress toward a gene therapy of arthritis. Proc Natl Acad Sci USA 2005; 102 : 8698–703.