| |
| Med Sci (Paris). 2007 March; 23(3): 291–296. Published online 2007 March 15. doi: 10.1051/medsci/2007233291.La réponse UPR Son rôle physiologique et physiopathologique Fabienne Foufelle* and Pascal Ferré* Inserm U671, Université Pierre et Marie Curie-Paris 6,UMR S671,Centre biomédical des Cordeliers, 15, rue de l’école de médecine,75270 Paris Cedex 06, France |
Le réticulum endoplasmique (RE), qui représente à lui seul plus de 50 % des membranes d’une cellule, assure un certain nombre de fonctions cruciales pour l’homéostasie et la survie cellulaires. Le RE est le principal site de réserve du calcium (Ca2+) dans la cellule (2-5 mM dans le RE pour 1 µM dans le cytosol), ceci grâce à la présence d’une pompe à Ca2+ présente dans les membranes du RE. Ce Ca2+ peut être libéré dans le cytoplasme en réponse à différents stimulus extracellulaires et servir de messager intracellulaire. Le RE est également le lieu de synthèse du cholestérol et de la plupart des lipides, composants indispensables des membranes biologiques. Enfin, c’est dans le RE que les protéines sécrétées ainsi que les protéines de la membrane plasmique et des organites intracellulaires sont synthétisées, modifiées et repliées dans leur conformation native. En effet, la lumière du RE présente un environnement oxydatif permettant la création de ponts disulfures. Il est par ailleurs particulièrement riche en protéines chaperons et en enzymes spécialisées dans le repliement des protéines dépendantes pour la plupart du Ca2+ pour leur activité catalytique. Finalement, c’est dans le RE que les protéines subiront un certain nombre de modifications post-traductionnelles (N-glycosylation, oligomérisation…). Le RE est donc un carrefour important où les protéines subissent un contrôle de qualité très strict et, seules les protéines ayant passé avec succès ce contrôle seront acheminées vers l’appareil de Golgi pour être sécrétées ou orientées vers d’autres compartiments. Les protéines identifiées comme incorrectes sont dégradées par un processus appelé ERAD (ER-associated-degradation). Cela nécessite l’export de ces protéines vers le cytoplasme de la cellule où elles sont dégradées par la voie du protéasome [
1,
2]. Toutes les situations conduisant à une altération de la fonction du RE, comme par exemple l’accumulation de protéines mal repliées ou des modifications de l’homéostasie calcique, entraînent le déclenchement d’une réponse physiologique appelée réponse UPR (unfolded protein response) ou encore stress du RE [
3,
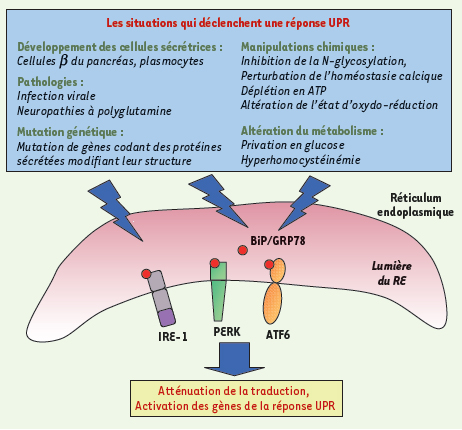
4]. C’est le cas par exemple lors de l’infection par le virus de l’hépatite C ou par celui de l’herpès. Ces virus, en se répliquant dans le RE et en entraînant une synthèse accrue de protéines par la cellule hôte, déclenchent une réponse UPR (Figure 1). La réponse UPR a pour but : (1) de ralentir la synthèse protéique globale pour empêcher l’arrivée d’autres protéines dans la lumière du RE ; (2) de synthétiser de nouvelles protéines chaperons ou des « foldases » pour stimuler les processus de repliement ; (3) d’entraîner vers la dégradation les protéines mal repliées ; (4) de déclencher l’apoptose de la cellule quand les processus précédents ont échoué. 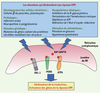 | Figure 1.
Situations physiologiques, physiopathologiques ou pharmacologiques conduisant à l’activation de la réponse UPR.
|
Dans cette synthèse, nous aborderons dans une première partie les mécanismes cellulaires et moléculaires mis en jeu lors de la réponse UPR puis nous examinerons le rôle de la réponse UPR dans certaines situations physiologiques ou physiopathologiques dans les cellules de mammifères. Pour une description plus détaillée des mécanismes d’activation de la voie UPR, nous invitons le lecteur à se référer à des revues récentes de la littérature [3–
5]. |
Les composantes de la réponse UPR chez les mammifères La réponse UPR a été mise en évidence chez la levure Saccharomyces cerevisiae. Chez ces organismes, la réponse UPR est restreinte à l’activation de la transcription de gènes cibles codant les protéines chaperons du RE, les protéines de glycosylation et les protéines de la voie ERAD (pour revue, voir [
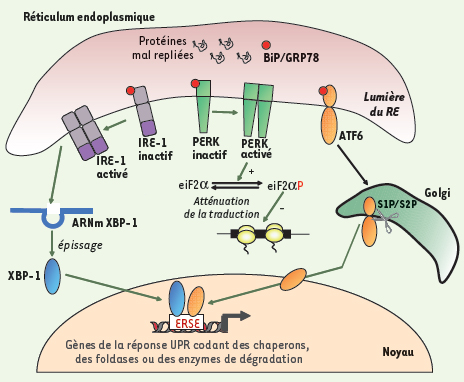
6]). Chez les mammifères, la réponse UPR est plus complexe et entraîne l’activation de deux voies : une voie traductionnelle et une voie transcriptionnelle. Elle peut également déclencher, dans certains cas, l’activation d’une voie apoptotique. Elle implique l’activation de trois protéines transmembranaires du RE : PERK (PKR-like ER-associated protein kinase), ATF6 (activating transcription factor-6) et IRE1 (inositol-requiring enzyme-1) [5]. L’activation de ces trois protéines nécessite leur dissociation de la protéine chaperon BiP/GRP78 qui les maintient dans un état inactif dans les membranes du RE (Figure 2). L’arrivée accrue de protéines dans la lumière du RE entraîne la dissociation de BiP/GRP78 qui va s’associer aux protéines en cours de repliement permettant ainsi l’activation de la voie UPR. 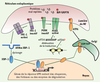 | Figure 2.
Les différentes composantes de la réponse UPR. À l’état non induit, les protéines transmembranaires de la réponse UPR (PERK, ATF6 et IRE-1) sont maintenues inactives dans le RE grâce à leur interaction avec la protéine chaperon BiP/GRP78. L’accumulation de protéines mal conformées dans la lumière du RE entraîne une dissociation de BiP/GRP78 et l’ activation des trois protéines de la réponse UPR. PERK s’oligomérise ce qui entraîne une stimulation de son activité kinase. Elle phosphoryle alors la sous-unité α du facteur d’initiation de la traduction eiF2 entraînant une inhibition de la traduction. ATF6 migre du RE vers le Golgi où il subit un double clivage protéolytique par les protéases S1P et S2P. Le domaine amino-terminal d’ATF6 migre vers le noyau pour se fixer sur des séquences ERSE (ER stress response element). La protéine IRE-1 possède, une activité sérine/thréonine kinase et endoribonucléase dans son domaine cytoplasmique. Son activation lors de la dissociation de Bip/GRP78 entraîne une oligomérisation et une induction de l’activité kinase d’IRE-1. La protéine IRE-1 activée provoque l’épissage et la traduction de l’ARNm du facteur XBP-1. XBP-1 se lie sur des séquences ERSE des promoteurs cibles de la réponse UPR. |
La voie traductionnelle : activation de la kinase PERK Cette voie est, au cours du temps, la première qui se met en place. Elle permet de ralentir momentanément la synthèse protéique afin d’éviter un afflux supplémentaire de protéines dans le RE. L’inhibition de la traduction s’effectue par l’intermédiaire de la kinase PERK qui lors d’un stress, dimérise et s’autophosphoryle en trans. La protéine ainsi activée phosphoryle la sous-unité α du facteur d’initiation de la traduction eiF-2 ( eukaryotic translation initiation factor 2) [
7] sur le résidu Ser 51 empêchant la formation du complexe de pré-initiation de la traduction et donc l’interaction des ARNm avec la sous-unité 40S du ribosome. Curieusement, malgré le blocage de la synthèse protéique, la traduction de certains ARNm est augmentée lors de l’activation de la voie PERK/eiF2α. C’est le cas de l’ARNm codant le facteur de transcription ATF4, qui est un des acteurs de la réponse UPR. La traduction d’ATF4 est rendue possible par la présence dans sa partie 5’ non traduite de séquences uORF ( upstream open reading frame) qui lui permettent d’être exprimé lors d’une inhibition de la synthèse protéique [
8]. AFT4 est impliqué dans l’activation de la voie apoptotique en induisant l’expression de la protéine CHOP ( CEBP homologous protein). Il est important de noter que plusieurs kinases sont capables, en réponse à des stress cellulaires variés, de phosphoryler le facteur eiF-2α et donc d’activer le facteur de transcription ATF4. Ce sont les kinases GCN2, PKR et HRI qui sont respectivement induites par la carence en acides aminés, lors d’une infection virale par l’ARN double brin, ou par la carence en hème. La voie transcriptionnelle : activation des protéines ATF6 et IRE-1 La réponse transcriptionnelle à un stress du RE va permettre d’activer un ensemble de gènes codant des protéines chaperons et des protéines impliquées dans la dégradation. Cette réponse est relayée par les protéines ATF6 et IRE1. Lors d’un stress du RE, la dissociation de BiP/GRP78 du facteur ATF6 entraîne la migration de ce dernier du RE vers le Golgi où il subit un double clivage protéolytique par les protéases S1P et S2P. Le domaine amino-terminal d’ATF6 ainsi libéré, migre vers le noyau pour se fixer sur des séquences ERSE (ER stress response element). Ces séquences sont présentes dans les promoteurs de gènes codant des protéines majeures du RE comme les chaperons BiP/GRP78 et GRP94 et la protéine disulfide isomérase (PDI) catalysant la formation des ponts disulfures [
9]. L’activation d’ATF6 permet ainsi d’accroître les capacités de repliement des protéines dans le RE. La protéine IRE1 possède une activité sérine/thréonine kinase et endoribonucléase dans son domaine cytoplasmique [5]. La dissociation de Bip/GRP78 entraîne une oligomérisation et une induction de l’activité kinase d’IRE1, conduisant à son autophosphorylation en trans. Cette activation va permettre l’expression de son activité endoribonucléasique. La protéine IRE1 activée provoque l’épissage de l’ARNm d’un facteur de transcription appelé XBP-1 (un intron de 26 bases est clivé) ce qui change le cadre de lecture et rend l’ARNm traductible. La protéine XBP-1 ainsi traduite se lie sur des séquences ERSE des promoteurs cibles de la réponse UPR. XBP-1 active principalement la transcription de gènes codant des enzymes impliquées dans la voie de dégradation ERAD comme celui de la protéine EDEM (ER-degradation-enhancing α-mannosidase-like protein) impliquée dans la reconnaissance des protéines glycosylées mal conformées [
10]. La voie apoptotique Quand tous les efforts mis en œuvre pour prendre en charge l’excès de protéines dans le RE ont échoué, la réponse UPR conduit à l’apoptose de la cellule [ 4,
11]. Les signaux apoptotiques sont produits à partir du RE par trois mécanismes. Le premier implique les protéines proapoptotiques Bak et Bax qui subissent un changement conformationnel lors d’un stress du RE entraînant un efflux de Ca 2+ dans le cytosol. Le Ca 2+ ainsi libéré active une protéase dépendante du Ca 2+, la m-calpaïne qui à son tour clive et active la procaspase 12. La caspase 12 induit une cascade d’activation de la voie des caspases conduisant à l’apoptose. La seconde voie apoptotique implique la protéine CHOP qui, en inhibant l’expression de la protéine Bcl2, favorise l’apoptose de la cellule. Finalement, IRE-1, en formant un complexe hétérotrimérique avec TRAF-2 et ASK-1 ( apoptosis signal-regulating kinase 1), active la c-Jun kinase (JNK) et la mort cellulaire. |
Rôle de la réponse UPR dans la physiologie cellulaire et la physiopathologie La réponse UPR, en association avec la voie de dégradation des protéines ERAD, a un rôle majeur dans l’adaptation du RE à la prise en charge d’une synthèse accrue de protéines. Ce rôle est particulièrement important dans les cellules possédant une forte capacité sécrétrice comme les cellules β du pancréas ou les hépatocytes. L’activation de la voie UPR est également indispensable à la différenciation et à la maturation de certaines cellules spécialisées comme les lymphocytes B. De plus, des dysfonctionnements de la voie UPR ou de la voie ERAD peuvent être à l’origine de pathologies liées à l’accumulation de protéines dans les cellules. Dans le paragraphe suivant, nous évoquerons quelques situations dans lesquelles la réponse UPR intervient pour maintenir une homéostasie cellulaire puis nous citerons des exemples de pathologies où la réponse UPR est altérée. Réponse UPR et différenciation des lymphocytes B La maturation terminale des lymphocytes B en plasmocytes (cellules productrices d’anticorps) s’accompagne d’une augmentation considérable de la surface du RE au sein de la cellule (multipliée par 5). Ce phénomène est probablement lié à la demande accrue de synthèse d’anticorps dans le plasmocyte. Cette différenciation terminale s’accompagne également d’une augmentation forte et rapide de l’expression du facteur de transcription XBP-1 suggérant un rôle de la réponse UPR dans ce processus final de différenciation. L’inactivation de XBP-1 dans les lymphocytes B a permis de démontrer son rôle majeur dans leur maturation [
12]. Les lymphocytes déficients en XBP-1 ne se différencient pas en plasmocytes et ne produisent pas d’IgG. La ré-expression d’une forme épissée de XBP-1 dans les lymphocytes déficients en XBP-1 permet de restaurer une production quasi-normale d’IgG. Ainsi, la réponse UPR, via XBP-1, pourrait faire partie intégrante d’un programme de différenciation se mettant en place dans le lymphocyte B avant que celui-ci ne se mette à produire massivement des anticorps. Cela aurait pour but d’augmenter les capacités de prise en charge des protéines par le RE en accroissant notamment sa surface. La découverte récente du rôle de XBP-1 dans la voie de biosynthèse des phospholipides renforce cette hypothèse [
13]. Réponse UPR, homéostasie glucidique et diabète L’importance de la réponse UPR dans la physiopathologie du diabète a été mise en évidence par la découverte que des inactivations chez la souris ou chez l’homme de certains acteurs de la réponse UPR conduisent à un diabète sévère. L’exemple le plus démonstratif est celui d’une perte de fonction de la kinase PERK qui conduit chez l’homme au syndrome de Wolcott-Rallison, caractérisé par un diabète juvénile [
14]. Les souris invalidées pour le gène PERK ( PERK−/−
) naissent avec des îlots de Langerhans normaux, mais développent dans les premières semaines de vie un diabète dû à une destruction des cellules β [
15]. Les souris sauvages stimulent leur sécrétion d’insuline en réponse à une augmentation du glucose sanguin et déclenchent dans le même temps une réponse physiologique UPR au niveau de la cellule β afin de limiter la synthèse protéique et l’apport d’une trop grande quantité de proinsuline dans le RE. Au contraire, chez les souris PERK−/−
, cette réponse étant absente, la pro-insuline s’accumule dans le RE et entraîne une destruction de la cellule β par la voie apoptotique. L’importance de la voie eiF2α/PERK dans l’homéostasie de la cellule β est également démontrée par l’invalidation du co-chaperon P58 IPK ou DNAJC3, une protéine induite par la réponse UPR et qui joue un rôle dans le contrôle négatif de la protéine PERK. Les souris invalidées pour P58 IPK développent peu après le sevrage une hyperglycémie sévère s’expliquant également par une apoptose des cellules β [
16]. Une autre forme de diabète juvénile, le syndrome de Wolfram, caractérisé par un diabète précoce sans réponse auto-immune, a également pour cause des troubles de l’homéostasie du RE. Le gène touché dans cette pathologie code une protéine transmembranaire du RE, la wolframine [
17], qui semble jouer un rôle dans la régulation du Ca2+ intracellulaire. Les souris invalidées pour le gène de la wolframine dans la cellule β, développent rapidement une intolérance au glucose qui évolue vers un diabète dû à une apoptose des cellules β s’expliquant par une activation de la réponse UPR [
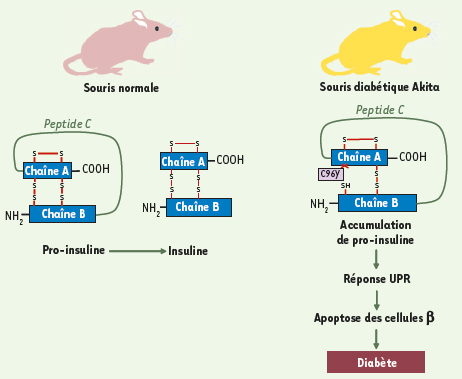
18]. Ainsi, toute altération dans le développement d’une réponse UPR normale dans la cellule β conduit à un diabète sévère. Le modèle génétique de souris diabétiques Akita démontre clairement que la réponse UPR doit être contrôlée. Ces souris développent un diabète précoce dû à une réduction importante de la masse des cellules β. L’analyse génétique a permis de mettre en évidence une mutation conduisant à un changement d’acide aminé (cystéine 196 en tyrosine) au niveau d’un des gènes de l’insuline. Cette mutation empêche la formation d’un des deux ponts disulfures normalement présents dans la pro-insuline et conduit à la formation d’une proinsuline de structure tridimensionnelle différente qui s’accumule dans le RE [
19] (Figure 3). L’apparition de l’hyperglycémie chez ces animaux s’accompagne d’une induction de l’expression de la protéine chaperon BiP/GRP78 et de la protéine CHOP dans les cellules β suggérant que la protéine mutante entraîne un stress du RE et une apoptose des cellules β. L’implication de la voie UPR dans l’apparition du diabète de la souris Akita a été confirmée en croisant les souris Akita avec des souris invalidées pour le gène CHOP. Chez ces animaux, la destruction des cellules β et l’apparition du diabète sont sensiblement retardées [
20]. 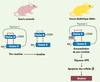 | Figure 3.
Implication de la réponse UPR dans le développement du diabète chez la souris Akita. Chez la souris normale, la synthèse d’insuline nécessite la maturation de la prépro-insuline en pro-insuline puis de la pro-insuline en insuline. Ce processus de maturation conduit successivement à l’élimination d’un peptide signal et à l’ajout de ponts disulfures dans le RE. Le clivage du peptide C conduira ensuite à la formation de l’insuline active. Chez la souris Akita, la présence d’une mutation ponctuelle dans le gène 2 codant l’insuline conduit à un changement d’acide aminé (Cys96Tyr) au niveau de la cystéine impliquée dans la formation d’un des ponts disulfures entre les chaînes A et B. Cela entraîne un changement conformationnel important de la préproinsuline dont la maturation est bloquée et qui, en s’accumulant dans le RE, déclenche une réponse UPR, qui conduit à une apoptose des cellules β et à l’apparition progressive d’un diabète. |
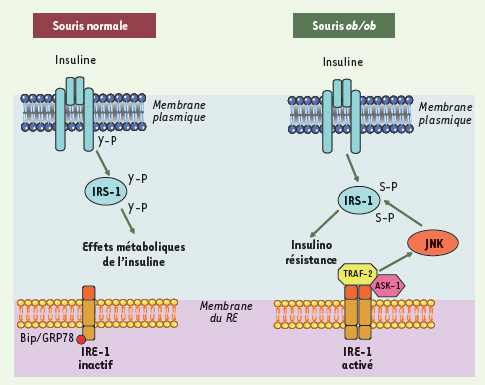
Des travaux récents suggèrent que la réponse UPR pourrait jouer un rôle important non seulement dans la cellule β mais également dans les tissus périphériques sensibles à l’insuline. En effet, il a été montré que la voie UPR était activée dans le foie et le tissu adipeux d’animaux obèses insulinorésistants comme les souris ob/ob ou les souris nourries avec un régime riche en graisse [
21]. Cette activation aurait pour conséquence d’activer la voie JNK (voire la voie apoptotique) qui, en phosphorylant les protéines IRS (insulin receptor substrate) sur des résidus sérine, inhiberait la voie de signalisation de l’insuline (Figure 4). 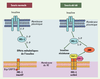 | Figure 4.
Réponse UPR et sensibilité à l’insuline dans les tissus périphériques. Chez les souris normales, l’insuline en se fixant sur son récepteur entraîne son autophosphorylation et l’activation de son domaine tyrosine kinase. Cela conduit à la phosphorylation des protéines IRS (insulin receptor substrate) sur des résidus tyrosine entraînant une cascade de phosphorylation et d’activation de protéines permettant de relayer les effets biologiques de l’insuline. Chez les souris obèses, l’activation de la voie UPR dans le RE, s’accompagne d’une induction de la protéine IRE-1 qui en formant un complexe hétérotrimérique avec TRAF-2 et ASK-1 (apoptosis signal-regulating kinase 1) active la c-Jun kinase (JNK). La JNK en phosphorylant les protéines IRS sur des résidus sérine inhibe la voie de signalisation insulinique conduisant à une insulinorésistance. |
La réponse UPR pourrait donc jouer un rôle central dans la physiopathologie du diabète de type 2 aussi bien au niveau de la sécrétion d’insuline qu’au niveau de la sensibilité à l’insuline des tissus périphériques. Cette voie pourrait se révéler dans les années futures comme une cible thérapeutique prometteuse dans le traitement du diabète de type 2 et de l’obésité chez l’homme. Des travaux récents réalisés chez l’animal montrent en effet qu’une diminution de la réponse UPR permet d’améliorer la sensibilité à l’insuline chez des animaux obèses diabétiques. Ainsi la surexpression de la chaperone ORP150 (oxygen regulated protein) dans le foie de souris db/db diminue la réponse UPR observée dans le foie de ces animaux et améliore l’insulinosensibilté [
22]. De la même façon, le traitement de souris ob/ob avec des chaperons chimiques comme l’acide 4-phényl butyrique ou des dérivés d’acides biliaires comme l’acide ursodésoxycholique, restaure une sensibilité à l’insuline des tissus périphériques et normalise la glycémie de ces animaux [
23]. Ces composés, de la même façon que les protéines chaperons endogènes sont capables de stabiliser les protéines en cours de synthèse dans le RE, et d’augmenter les capacités de prise en charge des protéines mal repliées du RE. Réponse UPR et maladies neurologiques Les maladies par expansion de polyglutamine (maladie de Huntington, ataxies cerébelleuses) et les maladies neurodégénératives (maladie d’Alzheimer et maladie de Parkinson) se caractérisent par une accumulation anormale de protéines dans les neurones. De nombreuses études indiquent que la pathogénicité de ces maladies serait due à des dysfonctionnements de la voie de dégradation par le protéasome qui conduiraient à une activation de la réponse UPR et à plus long terme à la mort cellulaire. Ainsi, dans l’ataxie spino-cérébelleuse de type III-l (maladie de Machado-Joseph), l’accumulation cytoplasmique de la protéine SCA3, en inhibant l’activité du protéasome, interfère avec la voie ERAD et déclenche une réponse UPR conduisant à l’activation de la caspase 12 et à l’apoptose de la cellule [
24]. Ces résultats suggèrent que l’accumulation de protéines mal repliées dans le cytosplasme peut déclencher la réponse UPR. La maladie d’Alzheimer est un désordre neurodégénératif caractérisé par un dépôt extracellulaire de substance amyloïde. La protéine β-amyloïde provient du clivage anormal d’une glycoprotéine membranaire appelée amyloid precursor protein (APP). Ce clivage est assuré par les présénilines 1 et 2 (PS-1et PS-2) qui sont des γ-sécrétases. Des mutations dans les gènes PS-1 et PS-2 et APP sont responsables des formes familiales juvéniles de la maladie d’Alzheimer. Il a été montré que PS-1 se lie directement sur IRE-1 au niveau des membranes du RE. L’expression de formes mutantes de PS-1 entraîne une diminution de la réponse UPR en diminuant l’autophosphorylation de IRE-1 ainsi que l’activation de PERK et ATF6 [
25]. Ainsi, les neurones exprimant des formes mutées de PS-1 présentent une plus forte vulnérabilité face au stress ER. En résumé, la réponse UPR est un mécanisme physiologique développé par toutes les cellules en réponse à une arrivée importante de protéines dans la lumière du RE. Des altérations dans la qualité ou dans l’intensité de la réponse UPR sont à l’origine de maladies très variées. Des recherches sont en cours pour identifier des composés permettant de moduler la réponse UPR. Elles ont abouti à partir du criblage de 19 000 composés, à l’identification du Salubrinal® comme un régulateur de la réponse UPR. Le Salubrinal® protège du stress ER induit pharmacologiquement ou par un virus de la famille de l’herpès en empêchant la déphosphorylation du facteur eiF2α [
26]. Son efficacité dans le traitement de maladies comme le diabète ou les maladies neurodégénératives reste à démontrer. |
Footnotes |
1. Ellgaard L, Helenius A. Quality control in the endoplasmic reticulum. Nat Rev Mol Cell Biol 2003; 4 : 181–91. 2. Sitia R, Braakman I. Quality control in the endoplasmic reticulum protein factory. Nature 2003; 426 : 891–4. 3. Kaufman RJ. Orchestrating the unfolded protein response in health and disease. J Clin Invest 2002; 110 : 1389–98. 4. Schroder M, Kaufman RJ. ER stress and the unfolded protein response. Mutat Res 2005; 569 : 29–63. 5. Rutkowski DT, Kaufman RJ. A trip to the ER: coping with stress. Trends Cell Biol 2004; 14 : 20–8. 6. Garlatti M, Barouki R. Le stress du réticulum endoplasmique : adaptation et toxicité. Med Sci
(Paris) 2002; 18 : 585–94. 7. Harding HP, Zhang Y, Ron D. Protein translation and folding are coupled by an endoplasmic-reticulum-resident kinase. Nature 1999; 397 : 271–4. 8. Harding HP, Novoa I, Zhang Y, et al. Regulated translation initiation controls stress-induced gene expression in mammalian cells. Mol Cell 2000; 6 : 1099–108. 9. Yoshida H, Haze K, Yanagi H, et al. Identification of the cis-acting endoplasmic reticulum stress response element responsible for transcriptional induction of mammalian glucose-regulated proteins. Involvement of basic leucine zipper transcription factors. J Biol Chem 1998; 273 : 33741–9. 10. Lee AH, Iwakoshi NN, Glimcher LH. XBP-1 regulates a subset of endoplasmic reticulum resident chaperone genes in the unfolded protein response. Mol Cell Biol 2003; 23 : 7448–59. 11. Zhang K, Kaufman RJ. The unfolded protein response: a stress signaling pathway critical for health and disease. Neurology 2006; 66 : S102–9. 12. Reimold AM, Iwakoshi NN, Manis J, et al. Plasma cell differentiation requires the transcription factor XBP-1. Nature 2001; 412 : 300–7. 13. Sriburi R, Jackowski S, Mori K, Brewer JW. XBP1: a link between the unfolded protein response, lipid biosynthesis, and biogenesis of the endoplasmic reticulum. J Cell Biol 2004; 167 : 35–41. 14. Delepine M, Nicolino M, Barrett T, et al. EIF2AK3, encoding translation initiation factor 2-alpha kinase 3, is mutated in patients with Wolcott-Rallison syndrome. Nat Genet 2000; 25 : 406–9. 15. Harding HP, Zeng H, Zhang Y, J et al. Diabetes mellitus and exocrine pancreatic dysfunction in perk−/−
mice reveals a role for translational control in secretory cell survival. Mol Cell 2001; 7 : 1153–63. 16. Ladiges WC, Knoblaugh SE, Morton JF, et al. Pancreatic beta-cell failure and diabetes in mice with a deletion mutation of the endoplasmic reticulum molecular chaperone gene P58IPK. Diabetes 2005; 54 : 1074–81. 17. Inoue H, Tanizawa Y, Wasson J, et al. A gene encoding a transmembrane protein is mutated in patients with diabetes mellitus and optic atrophy (Wolfram syndrome). Nat Genet 1998; 20 : 143–8. 18. Riggs AC, Bernal-Mizrachi E, Ohsugi M, et al. Mice conditionally lacking the Wolfram gene in pancreatic islet beta cells exhibit diabetes as a result of enhanced endoplasmic reticulum stress and apoptosis. Diabetologia 2005; 48 : 2313–21. 19. Araki E, Oyadomari S, Mori M: Impact of endoplasmic reticulum stress pathway on pancreatic beta-cells and diabetes mellitus. Exp Biol Med (Maywood) 2003; 228 :1213–7. 20. Oyadori S, Koizumi A, Takeda K, et al. Targeted disruption of the Chop gene delays endoplasmic reticulum stress-mediated diabetes. J Clin Invest 2002; 109 : 525–32. 21. Özcan U, Cao Q, Yilmaz E, et al. Endoplasmic reticulum stress links obesity, insulin action and type 2 diabetes. Science 2004; 306 : 457–61. 22. Nakatani Y, Kaneto H, Kawamori D, et al. Involvement of endoplasmic reticulum stress in insulin resistance and diabetes. J Biol Chem 2005; 280 : 847–51. 23. Özcan U, Yilmaz E, Özcan L et al. Chemical chaperones reduces ER stress and restore glucose homeostasis in a mouse model of type 2 diabetes. Science 2006; 313 :1137–40. 24. Nishitoh H, Matsuzawa A, Tobiume K, et al. ASK1 is essential for endoplasmic reticulum stress-induced neuronal cell death triggered by expanded polyglutamine repeats. Genes Dev 2002; 16 : 1345–55. 25. Katayama T, Imaizumi K, Manabe T, et al. Induction of neuronal death by ER stress in Alzheimer’s disease. J Chem Neuroanat 2004; 28 : 67–78. 26. Boyce M, Bryant KF, Jousse C, et al. A selective inhibitor of eIF2alpha dephosphorylation protects cells from ER stress. Science 2005; 30 : 935–939. |