La myéline est une extension membranaire riche en protéines et en lipides s’enroulant autour des axones du système nerveux central et périphérique. Un peu comme la gaine isolante d’un fil électrique, la myéline isole les axones ce qui permet une propagation rapide et efficace des signaux électriques dans le cerveau, ainsi qu’à travers l’ensemble de l’organisme. La myéline est produite par les cellules de Schwann dans le système nerveux périphérique et par les oligodendrocytes dans le système nerveux central. Des maladies affectent l’intégrité de la myéline : tel est le cas, par exemple, de la sclérose en plaques qui touche le système nerveux central, ou encore de la maladie de Charcot-Marie-Tooth, ainsi que des syndromes de Dejerine-Sottas et de Guillain Barré qui altèrent le système nerveux périphérique. Leurs conséquences sont graves et souvent irréversibles : mouvements non coordonnés, douleurs chroniques, paralysie. Afin de mieux comprendre leur physiopathologie et de mettre au point des approches de reconstruction de la myéline, il est essentiel de clarifier davantage les mécanismes cellulaires et moléculaires qui concourent à la formation de la myéline au cours du développement normal du système nerveux.
De récents travaux ont mis en évidence le rôle de signaux extracellulaires comme les neurégulines [ 1] et de certaines neurotrophines [ 2, 3] dans la formation de la myéline par les cellules de Schwann. Par exemple, la neurotrophine-3 accroît la migration des cellules de Schwann sur les axones tout en inhibant la formation de la myéline [2– 4]. Inversement, le brain-derived neurotrophic factor (BDNF) bloque la migration des cellules de Schwann sur les axones et induit la myélinisation en stimulant le récepteur des neurotrophines p75 (p75NTR) [2, 3, 5]. En revanche, les signaux intracellulaires de la myélinisation restent beaucoup moins bien connus.
La formation de la myéline est un processus hautement polarisé qui requiert que la cellule de Schwann entreprenne la formation de la myéline seulement du côté qui est en contact avec l’axone. Mais quel est le mécanisme propre à l’amorce unilatérale de la myélinisation ? Le complexe protéique de polarité comprenant Par-3 et Par-6, deux protéines à domaine PDZ, ainsi que la protéine kinase C atypique (aPKC) sont essentiels à la polarisation cellulaire dans une variété de contextes, tant chez les invertébrés que chez les vertébrés [ 6]. Les protéines Par ont d’abord été identifiées chez le nématode C. elegans, où elles sont nécessaires à la spécification de l’axe antéro-postérieur. Le complexe des Par est aussi essentiel à la division asymétrique chez la drosophile, ainsi qu’à la polarisation des cellules épithéliales et la détermination axonale chez les vertébrés.
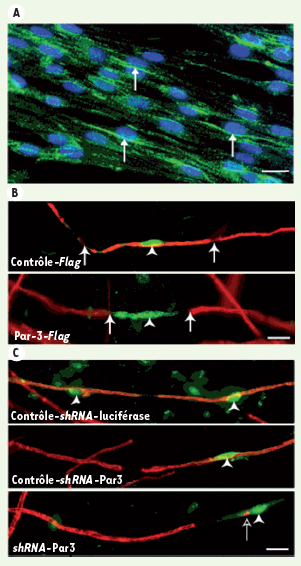
Considérant le rôle important du complexe des protéines Par dans la formation de la polarité cellulaire et la nature asymétrique du début de la formation de la myéline, nous avons récemment étudié le rôle des protéines Par dans le processus de myélinisation [ 7]. En utilisant un système de coculture de cellules de Schwann et de neurones des ganglions dorsaux (NGD), nous avons démontré que la protéine Par-3 s’accumule unilatéralement dans les cellules de Schwann précisément du côté qui est en contact avec l’axone durant les stades précoces de la myélinisation (Figure 1A). Cette distribution asymétrique de Par-3 à la jonction axo-gliale suggérait que Par-3 pouvait jouer un rôle dans l’amorce de la formation de la myéline. Pour tester cette hypothèse, nous avons perturbé la localisation unilatérale de Par-3 dans les cellules de Schwann en surexprimant le gène par-3 ou en bloquant la production de la protéine à l’aide de short-hairpin RNA. Nous avons ensuite évalué la capacité des cellules de Schwann à myéliniser les axones de NGD. Après la surexpression ou le blocage de Par-3, nous avons observé que les cellules de Schwann étaient incapables de myéliniser les axones des NGD (Figure 1B, C).
| Figure 1.
La protéine de polarité Par-3 est au coeur du processus de myélination. A. Localisation unilatérale de Par-3 (vert, flèches) dans les cellules de Schwann en coculture avec des neurones des ganglions dorsaux. Les noyaux sont en bleu.B. La surexpression de Par-3 dans les cellules de Schwann (vert, têtes de flèches) bloque la formation de la myéline (rouge). Les flèches indiquent les limites des cellules de Schwann qui surexpriment Par-3. C. Le blocage de l’expression de Par-3 avec un shRNA (vert, têtes de flèches) empêche la formation de la myéline (rouge) (photos tirées de Science [7]). |
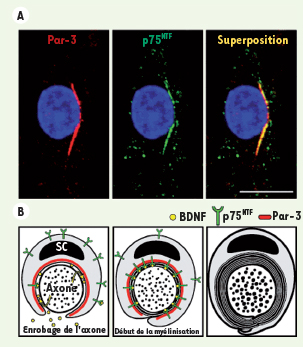
Nous nous sommes ensuite penchés sur le mécanisme par lequel Par-3 pourrait exercer son action sur la myélinisation. Puisque Par-3 contient trois domaines d’interactions protéine-protéine de type PDZ, nous voulions déterminer si Par-3 pouvait être à la base d’un échafaudage moléculaire permettant l’amorce unilatérale de la myélinisation. Cette hypothèse semblait logique puisque le récepteur p75NTR, qui est critique dans la formation de la myéline par les cellules de Schwann [3], contient un motif de liaison PDZ. Afin de tester cette hypothèse, nous avons d’abord démontré que Par-3 et p75NTR sont colocalisés dans les cellules de Schwann à la jonction axo-gliale (Figure 2A). Ensuite, en utilisant des techniques biochimiques, nous avons démontré que Par-3 se lie directement au récepteur p75NTR exclusivement via son domaine PDZ-1, et non via les domaines PDZ-2 et PDZ-3 de Par-3 qui ne peuvent pas se lier à p75NTR. De plus, cette association entre Par-3 et p75NTR est facilitée par la présence de BDNF, le ligand de p75NTR. Pour tester le rôle potentiel de Par-3 dans la localisation unilatérale de p75NTR, et non l’inverse, nous avons bloqué l’expression de Par-3 dans les cellules de Schwann et déterminé leur capacité à localiser p75NTR unilatéralement. Ces expériences ont permis d’observer une diminution importante du nombre de cellules ayant une distribution latéralisée de p75NTR, suggérant que Par-3 permet le recrutement du récepteur p75NTR à la jonction axo-gliale afin d’y favoriser la myélinisation. De plus, les cellules de Schwann provenant de souris dont le gène p75NTR a été inactivé, avaient une distribution asymétrique de Par-3 identique à celle observée chez les souris sauvages. Ces résultats indiquent que Par-3 est nécessaire au recrutement de p75NTR à la jonction axo-gliale, mais que p75NTR n’est pas requis pour la localisation latéralisée de Par-3. À la lumière de ces résultats, nous avons proposé un modèle dans lequel Par-3 se localise d’un côté dans la cellule de Schwann lors du contact avec l’axone. Cette polarisation permet alors de recruter p75NTR à la jonction axo-gliale afin d’assurer que le ligand BDNF, sécrété par les axones, soit reçu efficacement et de façon continue pour induire la signalisation permettant l’amorce unilatérale de la myélinisation (Figure 2B).
| Figure 2.
Par-3 régit la formation de la myéline en recrutant le récepteur p75NTR. A. Par-3 (rouge) colocalisé avec p75NTR (vert) dans les cellules de Schwann. B. Version schématique du modèle proposé pour l’action de Par-3 et p75NTR dans la régulation de la myélinisation (Photos et schémas tirés de Science [7]). |
Ces travaux ouvrent la voie à de nouvelles études qui devraient permettre de découvrir d’autres molécules qui s’associent avec Par-3 afin de contribuer à la formation de la myéline. De plus, il sera intéressant de déterminer si Par-3 régule aussi la formation de la myéline dans le système nerveux central. Éventuellement, la manipulation du centre d’organisation établi par Par-3 permettra peut-être d’augmenter l’efficacité des stratégies de reconstruction de la myéline altérée par suite de blessures ou de certaines affections comme la maladie de Charcot-Marie-Tooth ou même la sclérose en plaques.