« Toute respiration propose un règne »
René Char
Actuellement, la toute première description d’une protéine est généralement obtenue grâce au décryptage du gène qui la code. De la séquence de ce gène est déduite la chaîne d’acides aminés qui compose la protéine, information qui va alors être employée par le biologiste pour prédire sa fonction et, plus ou moins précisément, son repliement en structures secondaires, voire tertiaires. S’il est indéniable que cette démarche a été, et reste, particulièrement fructueuse, elle peut aussi obscurcir ce qu’est intrinsèquement une protéine : une molécule, autrement dit un assemblage d’atomes. Plusieurs travaux récents ont souligné l’intérêt de l’étude de la composition élémentaire (atomique) des biopolymères, et notamment des protéines. Des découvertes intéressantes ont émergé de cette nouvelle approche, en particulier sur les mécanismes mis en jeu lors de l’évolution des protéines [ 1]. Les travaux les plus récents viennent d’être publiés par Acquisti et al., dans la revue Nature [ 2].
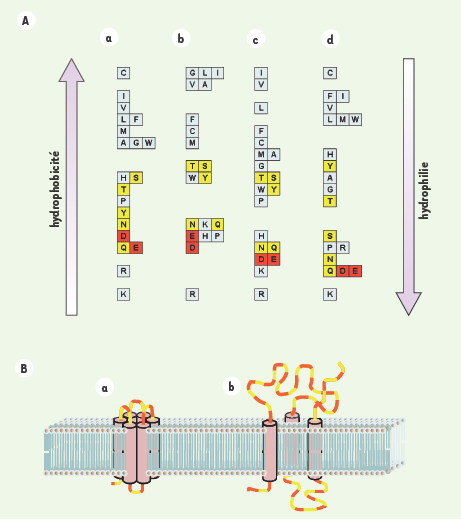
En analysant les teneurs en atomes d’oxygène des protéines prédites de 19 organismes, Acquisti et al. observent que les protéines transmembranaires présentent des distributions particulières, contenant moins d’atomes d’oxygène que les autres protéines. Cela résulte de la présence au sein de ces protéines de domaines intramembranaires, riches en acides aminés hydrophobes, et de la forte corrélation entre l’hydrophobicité d’un acide aminé et son contenu en oxygène. En effet, plus un acide aminé est hydrophobe, moins il contient d’oxygène (Figure 1A). Les auteurs montrent aussi que, de façon surprenante, les protéines membranaires des bactéries et des archées contiennent moins d’atomes d’oxygène que les protéines membranaires des eucaryotes. Cette différence les conduit à émettre une nouvelle hypothèse sur le rôle majeur joué par l’oxygène atmosphérique (O2) dans l’apparition d’organismes multicellulaires complexes.
| Figure 1.
A. L’hydrophobicité des acides aminés est corrélée à leur contenu en atomes d’oxygène. Les acides aminés (désignés par le code à une lettre) sont colorés en fonction du nombre d’atomes d’oxygène de leur chaîne latérale : aucun atome, blanc ; un atome, jaune ; deux atomes, rouge. Les échelles d’hydrophobicité sont tirées de (a) [
5], (b) [
6], (c) [
7] et (d) [
8]. B. Les protéines transmembranaires sont principalement de deux sortes : (a) « canaux » et (b) « récepteurs ». Représentation schématique des deux types de protéines transmembranaires définis par Acquisti et al. [2]. Les parties hydrophobes, en rose, sont principalement constituées d’acides aminés contenant peu d’atomes d’oxygène, alors que les boucles hydrophiles, représentées en rouge et jaune, sont riches en acides aminés contenant de l’oxygène. |
Utilisant un logiciel de prédiction de structure, Acquisti et al. identifient deux grandes classes de protéines transmembranaires : la première comprend les protéines composées de multiples domaines transmembranaires liés par de courtes boucles extramembranaires. Ils appellent ces protéines des « canaux » (channels). La seconde classe est constituée des protéines composées de quelques domaines transmembranaires liés par de grandes boucles extra-membranaires, dénommées « récepteurs » (receptors, Figure 1B). Les deux populations ont des teneurs en oxygène clairement distinctes, les récepteurs étant construits avec plus d’atomes d’oxygène que les canaux en raison de leurs longues boucles hydrophiles.
Acquisti et al. montrent alors que les protéines transmembranaires des eucaryotes, plus nombreuses que celles des procaryotes, sont principalement enrichies en récepteurs. De surcroît, plus la classe de l’organisme est d’apparition évolutive récente, plus les boucles extracellulaires de ses récepteurs sont longues. Parce que les boucles extracellulaires des récepteurs jouent un rôle essentiel dans le transfert d’information à travers les membranes, les auteurs proposent que leur présence et leur structure aient joué un rôle décisif lors de l’évolution de cellules non compartimentées vers des cellules compartimentées, puis dans la transition d’organismes unicellulaires vers des organismes multicellulaires. Ces transitions évolutives majeures auraient ainsi été intimement liées à la possibilité d’incorporer des atomes d’oxygène dans les protéines transmembranaires, et plus précisément dans leurs boucles extracellulaires.
En corrélant la date d’émergence des différentes classes d’organismes et les compositions en atomes d’oxygène des récepteurs actuels, Acquisti et al. estiment que les conditions favorables à l’existence de récepteurs riches en atomes d’oxygène ne sont réunies que depuis environ deux milliards d’années (Ma). Cela correspond approximativement au premier grand événement d’oxygénation de l’atmosphère terrestre, il y a 2,2 Ma. Plusieurs événements d’oxygénation ont marqué l’histoire de notre planète et modelé notre biosphère [ 3]. Il a d’ailleurs été démontré qu’il existait une corrélation entre la complexification des organismes et le développement du métabolisme aérobie [ 4]. Jusqu’à présent, cette corrélation était généralement interprétée en termes d’efficacité métabolique : puisque la respiration aérobie permet de tirer le maximum d’énergie des nutriments, elle favoriserait le maintien de fonctions complexes. Les travaux d’Acquisti et al. fournissent une nouvelle explication, de nature physicochimique : une atmosphère réductrice, à faible teneur en O2, n’aurait pas permis l’émergence des longues boucles extracellulaires propres aux récepteurs, nécessaires aux communications de part et d’autre des membranes, et donc, aurait été incompatible avec l’apparition d’architectures cellulaires complexes.
Le travail d’Acquisti et al. soulève plusieurs questions. Notamment, les membranes des différents organites étant au contact d’environnements divers, on s’attend à ce que la structure et la composition de leurs protéines transmembranaires soient différentes. Par exemple, comme les membranes de la mitochondrie baignent dans un environnement particulièrement pauvre en O2, celui-ci étant consommé par la respiration, elles devraient contenir des protéines transmembranaires pauvres en oxygène. Ce même phénomène pourrait d’ailleurs expliquer le maintien de faibles teneurs en oxygène dans les protéines de la membrane plasmique des bactéries contemporaines, alors même qu’elles évoluent dans une atmosphère riche en O2 : chez ces organismes, la membrane plasmique est le siège de la respiration, elle est donc en réalité immergées dans un environnement pauvre en O2. Nous proposons que deux conditions aient été simultanément requises pour doter les organismes des récepteurs nécessaires à l’établissement de la multicellularité : l’enrichissement en O2 de l’atmosphère, comme proposé par Acquisti et al., mais aussi l’absence de respiration dans les membranes séparant les cellules les unes des autres.