L’ion calcium (Ca2+) est un second messager universel qui contrôle un très grand nombre de processus biologiques, tels que la contraction musculaire, la mémorisation, la fertilisation, la sécrétion, la transcription des gènes, le trafic cellulaire, le métabolisme, la croissance et l’adhérence cellulaire ou bien encore l’apoptose. Afin de contrôler spécifiquement tous ces processus, le signal calcique est régulé, de façon très fine en amplitude et de façon spatio-temporelle, par plusieurs protéines de mobilisation et de liaison du calcium (Figure 1).
| Figure 1.
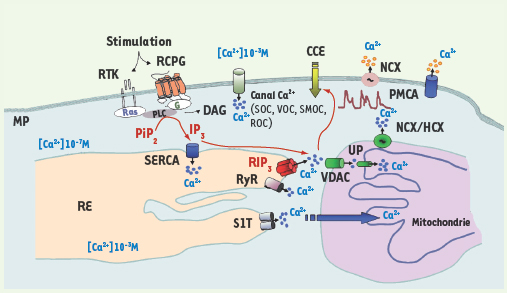
Principaux acteurs de la signalisation calcique intracellulaire. La stimulation extracellulaire des récepteurs membranaires à activité tyrosine kinase (RTK) et ceux couplés aux protéines G (RCPG) déclenche une cascade de réactions qui aboutit, via l’hydrolyse du phospho-inositol 1-4,5-biphosphate (PIP2) par la phospholipase C (PLC), à la production du second messager IP3 (inositol 1-4,5-triphosphate) et du diacylglycérol (DAG). L’IP3 se lie à son récepteur (RIP3) et détermine la sortie du Ca2+ du réticulum endoplasmique (RE) vers le cytosol. Dans les cellules excitables, la sortie du Ca2+ du RE est assurée par les récepteurs de la ryanodine (RyR). À la suite de la déplétion des réserves calciques intracellulaires, la cellule active l’influx calcique à travers la membrane plasmique par un processus appelé capacitative calcium entry (CCE). L’augmentation de la [Ca2+] intracellulaire fait intervenir également les canaux calciques (SOC, VOC, SMOC et ROC) localisés au niveau de la membrane plasmique (MP). Les élévations de la [Ca2+] cytosolique sont finement régulées, notamment par les SERCA (sarco-endoplasmic reticulum calcium ATPase) qui pompent le Ca2+ du cytosol vers le RE, les PMCA (plasma membrane calcium ATPase) qui pompe le calcium du cytosol vers l’espace extracellulaire et l’échangeur Na+/Ca2+ (NCX) faisant sortir le Ca2+ vers le milieu extracellulaire. L’accumulation du Ca2+ par la mitochondrie implique deux protéines : VDAC (voltage dependant anion channel) et UP (uniporter). L’efflux calcique mitochondrial implique les échangeurs Na+/Ca2+ (NCX) et H+/Ca2+ (HCX) qui utilisent la force motrice due à l’entrée du Na+ et du H+ pour faire sortir le Ca2+. L’expression des protéines SERCA1 tronquées (S1T) induit la diminution du stock calcique du RE en augmentant la fuite passive du calcium de cette organite [
9]. La protéine S1T localisée au niveau des sites de contact RE/mitochondrie favorise le transfert du Ca2+ vers la mitochondrie. |
En condition de repos, la concentration de calcium libre dans le cytosol ([Ca2+]cyt) est maintenue à des niveaux très faibles (0,1 à 2µM) par rapport à la concentration calcique dans le milieu extracellulaire et dans le réticulum endoplasmique (RE) (1 à 2 mM). Le signal calcique résulte d’une élévation de la concentration du calcium cytosolique à la suite de sa libération des stocks intracellulaires, en particulier le RE, ou de son entrée depuis l’espace extracellulaire (Figure 1). Outre le RE, la mitochondrie constitue un organite d’accumulation de calcium pouvant contrôler à la fois l’amplitude, la durée, la localisation et la propagation des élévations calciques cytosoliques, et le recyclage du Ca2+ vers le RE. L’accumulation du Ca2+ par les mitochondries est assurée par l’élévation localisée de la [Ca2+]cyt à proximité des canaux calciques de la membrane cytoplasmique et de la membrane du RE et par les sites de contact entre les mitochondries et le RE [ 1, 2] (Figure 1).
Le développement de sondes calciques extrêmement sensibles et dotées d’une grande spécificité subcellulaire, comme les sondes aequorine et les sondes fluorescentes « FRET » (fluorescence resonance electron transfert), permet actuellement d’évaluer la signalisation calcique dans différents compartiments subcellulaires et d’apprécier la complexité de la dynamique de la signalisation calcique dans la régulation de différents mécanismes cellulaires [2].
Les infections chroniques par le virus de l’hépatite B (VHB) et le virus de l’hépatite C (VHC) constituent deux facteurs étiologiques majeurs dans le développement du CHC (carcinome hépatocellulaire), une des tumeurs les plus fréquentes au monde (8e rang) [ 3, 4]. L’impact de la signalisation calcique dans la carcinogenèse hépatique a été mis en évidence pour la première fois par les études qui visaient à comprendre les mécanismes oncogéniques liés à l’intégration du génome du VHB dans le génome des cellules hépatocytaires.
L’intégration du génome du VHB dans l’ADN des hépatocytes peut induire des réarrangements chromosomiques, la transactivation de gènes cellulaires par des protéines virales tronquées (protéines X et preS2/S) et la mutagenèse insertionnelle, c’est-à-dire la modification quantitative ou qualitative de l’expression du gène cellulaire ciblé par l’intégration virale [ 5].
Pour étudier l’impact de la mutagenèse insertionnelle dans la carcinogenèse hépatique liée au VHB, notre équipe a développé une méthode originale, fondée sur la Alu-PCR, permettant l’amplification sélective des sites d’intégration de l’ADN du VHB dans l’ADN cellulaire [ 6].
L’utilisation de cette approche nous a permis d’isoler l’intégration du VHB dans plusieurs gènes importants pour la croissance/différenciation/mort cellulaire, y compris dans des gènes clés de la signalisation calcique: les gènes IP3R (inositol triphosphate receptor) de type 1 et de type 2, le gène SERCA1 (sarco-endoplasmic reticulum calcium ATPase) et le gène SMOC1 (SPARC related modular calcium binding 1) [ 7].
L’analyse moléculaire de l’intégration du VHB dans le gène SERCA1 (qui code une protéine ATP-dépendante capable de « pomper » le calcium contre gradient du cytosol vers le RE) a montré l’existence de deux transcrits hybrides X-VHB/SERCA1 constitués par une séquence X du VHB en 5’ et une séquence SERCA1 en 3’ caractérisée par un épissage alternatif de l’exon 4 et/ou l’exon 11 donnant naissance à un codon stop prématuré au niveau de l’exon 12 [ 8]. Les transcrits SERCA1 épissés et non chimériques ont été par la suite clonés à partir du foie humain normal et codent des protéines SERCA1 tronquées (S1T) qui, ayant perdu 6 des 7 résidus de liaison de calcium, ne peuvent plus fonctionner comme des pompes calciques. L’utilisation des sondes aequorine recombinantes a permis de montrer que leur expression induit la diminution du stock calcique du RE en augmentant la fuite passive du calcium de cet organite [9]. L’utilisation de la sonde calcique FRET « Pericam » et de l’imagerie à haute résolution a montré par la suite que la protéine S1T augmente les sites de contact entre le RE et la mitochondrie et induit une augmentation du transfert du calcium du RE vers la mitochondrie. Ce mécanisme joue un rôle clé dans la régulation de l’apoptose liée au stress du RE. Ces travaux suggèrent dans un cas de CHC l’implication des protéines S1T cis-activées par l’intégration du VHB dans le processus de carcinogenèse hépatique via le contrôle de la signalisation calcique et de l’équilibre prolifération/apoptose [8, 9].
Ces résultats nous ont conduits à formuler l’hypothèse selon laquelle la régulation de la signalisation calcique pourrait avoir, de façon générale, un rôle important en carcinogenèse hépatique. Pour tester cette hypothèse, nous avons étudié l’impact de deux protéines virales essentielles en carcinogenèse hépatique, connues pour avoir un rôle pro-oncogène, la protéine X du VHB (HBx) [3] et la protéine de capside du VHC [4] sur la signalisation calcique subcellulaire. Les données de littérature indiquent que ces deux protéines interfèrent sur l’équilibre prolifération/apoptose cellulaire.
Nos résultats montrent que la protéine HBx, localisée au niveau de la membrane mitochondriale, détermine l’amplification du signal calcique cytosolique plus particulièrement au niveau du domaine localisé sous la membrane plasmique. Cet effet est relayé par le clivage et l’inactivation caspase-3 dépendante de la PMCA (plasma membrane calcium ATPase) impliquée dans l’extrusion du calcium du cytosol vers le milieu extracellulaire. Nos résultats montrent l’importance des altérations de la signalisation calcique dans le contrôle du processus d’apoptose induit par l’HBx [ 10] (Figure 2). D’autres travaux ont rapporté que l’élévation calcique cytosolique, induite par l’HBx, active, d’une part, les kinases PyK2 (proline rich tyrosine kinase-2) et FAK (focal adhesion kinase) activant à leur tour la réplication de l’ADN du VHB [ 11] et, d’autre part, favorise l’assemblage de la capside virale [ 12] (Figure 2).
La synthèse et la maturation de la protéine de capside du VHC se font au niveau du RE. Nous avons donc formulé l’hypothèse selon laquelle cette protéine pourrait modifier la signalisation calcique de cet organite. Nous avons montré que la capside induit le stress du RE et la diminution de la concentration en calcium du RE. De plus, les résultats d’imagerie et de microscopie électronique montrent sa translocation du RE vers la mitochondrie, à travers les contacts RE-mitochondries. La baisse de la concentration calcique du RE induite par la capside du VHC active à la fois les voies apoptotiques spécifiques du RE (expression de CHOP/GADD153, growth arrest and DNA-inducible gene 153) et de la mitochondrie (activation de Bax, dépolarisation de la membrane mitochondriale et libération du cytochrome c). En effet, nos travaux ont montré que la correction de la déplétion calcique du RE par la transfection de SERCA2 permet d’inhiber l’apoptose mitochondriale. Ces résultats obtenus in vitro (en exprimant la protéine de capside seule) ont été validés par la suite dans le modèle « réplicon » du VHC (exprimant l’ensemble des protéines du VHC) et chez des souris transgéniques exprimant la protéine de capside du VHC [ 13] (Figure 2). Il a également été rapporté que la réduction de la [Ca2+]RE active les lymphocytes T via le facteur de transcription NFAT (nuclear factor of activated T cells) [ 14] (Figure 2). D’autres protéines du VHC interfèrent potentiellement avec la signalisation calcique intracellulaire, notamment la sérine phosphoprotéine NS5A qui active STAT-3 et NF-κB par un mécanisme calcium-dépendant [ 15] (Figure 2).
Ces résultats montrent le rôle potentiel du dérèglement de la signalisation calcique dans les infections chroniques liées au VHB et VHC et le développement du carcinome hépatocellulaire et suggèrent que la modulation pharmacologique fine de la signalisation calcique subcellulaire pourrait être une voie intéressante dans la prévention et/ou le traitement des lésions hépatiques associées aux infections par ces deux virus.