Pendant de nombreuses années, l’endocytose a été considérée comme un événement cellulaire impossible chez les végétaux, en raison de la forte pression de turgescence des cellules végétales et de la présence d’une paroi pecto-cellulosique. Des données récentes de biologie cellulaire et de biologie du développement des plantes ont toutefois permis de remettre en cause ce dogme, notamment par l’intermédiaire de travaux sur la physiologie de l’auxine. L’auxine est une hormone de croissance végétale impliquée dans de nombreux aspects du développement dont le contrôle de l’architecture de la plante, l’émission des organes latéraux ou la réponse à la gravité. Elle est principalement synthétisée à l’apex de la tige et transportée vers l’extrémité de la racine. Ce transport « basipète » est assuré par une famille de transporteurs d’auxine, les protéines PIN [ 1, 2]. Ces transporteurs au nombre de huit sont localisés de manière polarisée sur une face des cellules et assurent un efflux d’auxine, ce qui contraint la direction du flux d’auxine [ 3].
Une étude sur le trafic intracellulaire de la protéine PIN1 chez Arabidopsis thaliana a permis de démontrer l’existence de l’endocytose dans un tissu intact [ 4]. Pour cela, les auteurs ont utilisé une toxine fongique, la bréfeldine A (BFA), dont l’action inhibitrice sur la sécrétion a été démontrée dans des cellules animales. Après 30 minutes d’incubation des racines dans la BFA, la protéine PIN1, normalement localisée à la membrane plasmique, est observée dans un compartiment intracellulaire aberrant appelé « compartiment BFA ». L’accumulation de PIN1 dans le compartiment BFA peut résulter soit de l’arrêt de son export vers la membrane lors de sa phase de biosynthèse, soit du blocage de son recyclage vers la membrane suivant une étape d’internalisation, soit de l’inhibition de la voie de dégradation amenant PIN1 de la membrane plasmique vers le compartiment lytique de la cellule (les vacuoles). La courte durée du traitement à la BFA et le fait que la protéine PIN1 soit très stable permet d’éliminer cette dernière hypothèse. Lorsque les racines sont traitées par un inhibiteur de la synthèse des protéines avant traitement à la BFA, PIN1 se trouve toujours accumulée dans le compartiment BFA. Cette observation indique que l’accumulation de PIN1 dans ce compartiment n’est pas associée à sa synthèse. Par ailleurs, il a été montré que les fonctions sécrétoires des saccules golgiens, qui participent activement à la maturation des protéines sécrétées ou membranaires, ne sont pas affectées par un traitement à la BFA [4, 5]. Ces données suggèrent fortement que la BFA agit sur l’étape de recyclage de PIN1 après son internalisation. Il est intéressant de noter que plusieurs inhibiteurs du transport de l’auxine inhibent également le recyclage de PIN1 [4]. Ainsi, l’internalisation de PIN1 et son recyclage à la membrane plasmique est nécessaire au transport polarisé de l’auxine.
Les cibles moléculaires de la BFA sont les ARF GEF (GTP exchange factor for ARF GTPase). Le génome d’Arabidopsis comprend plusieurs ARF GEF, mais l’une d’entre elles, la protéine GNOM, est un bon candidat pour être la cible directe de la BFA. En effet, GNOM est requise pour le transport polaire de l’auxine et l’établissement de la polarité embryonnaire [ 6]. Les ARF GEF peuvent être naturellement sensibles ou résistantes à la BFA, en fonction de la présence ou non d’une méthionine dans leur site catalytique. Par mutagenèse dirigée, Geldner et al. ont produit une version de GNOM résistante à la BFA (GNOMM696L) [ 7]. GNOMM696L est fonctionnelle puisque son expression complémente le phénotype du mutant gnom. Dans une lignée gnom complémentée par GNOMM696L, le trafic de PIN1 n’est plus sensible au traitement à la BFA, indiquant que GNOM est la cible de cette toxine. Les auteurs ont alors recherché la localisation subcellulaire de GNOM et montré, pour la première fois, chez les végétaux, que GNOM est une protéine endosomique. Les endosomes contenant GNOM s’agrègent en présence de BFA dans une lignée sauvage, mais ne s’agrègent plus dans la lignée complémentée GNOMM696L. Ainsi, PIN1 recycle en permanence entre la membrane plasmique et un compartiment endosomique grâce à la protéine GNOM.
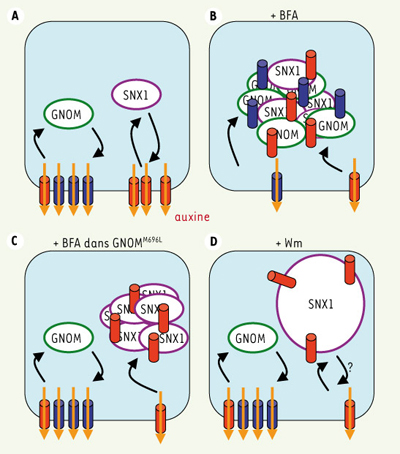
Contrairement à PIN1, un autre transporteur d’auxine, PIN2, reste en partie sensible à la BFA dans la lignée complémentée GNOMM696L. Le trafic de PIN2 n’est donc pas exclusivement dépendant de l’endosome GNOM et utilise un autre endosome sensible à la BFA. Le travail de notre équipe a permis récemment d’identifier la nature de ce nouveau compartiment endosomique [ 8]. Nous avons montré que ce compartiment se caractérise par la présence d’une protéine de type sorting nexin, que nous avons nommée SNX1. Les SNX ont été identifiées dans les cellules de mammifères et de levures, mais n’avaient jamais été étudiées chez les plantes. Il s’agit de protéines localisées dans le cytosol ou associées à la membrane des endosomes et qui sont impliquées dans l’endocytose et le trafic intracellulaire des protéines [ 9]. SNX1 est absente des endosomes GNOM. Après traitement à la BFA, ces deux populations d’endosomes s’agrègent dans le même « compartiment BFA ». Nous avons cherché un produit qui affecte sélectivement les endosomes contenant SNX1. La wortmannine (Wm), un inhibiteur des phosphatidyl-inositol-3-OH kinases, provoque la fusion des endosomes SNX1 entre eux mais n’affecte pas les endosomes GNOM. La localisation de PIN1 n’est pas modifiée par un traitement à la Wm, alors que PIN2 est accumulée dans la cellule dans le compartiment marqué par SNX1. Ainsi, PIN1 et PIN2 recyclent tous les deux via des endosomes différents, les uns marqués spécifiquement par la protéine GNOM et les autres par la protéine SNX1 (Figure 1).
| Figure 1.
Modèle pour le recyclage des transporteurs d’auxine PIN1 et PIN2 dans les cellules de racine. A. PIN1, et partiellement PIN2, recyclent via les endosomes GNOM alors que seule PIN2 utilise les endosomes SNX1. B. En présence de la bréfeldine A (BFA), les endosomes GNOM et SNX1 s’agrègent dans un même compartiment BFA. C. Dans une lignée gnom complémentée par GNOMM696L, seul le compartiment endosomique SNX1 est sensible à la BFA et accumule PIN2. D. En présence de wortmannine (Wm), seul le compartiment SNX1 est sensible à la molécule et accumule PIN2. Les endosomes GNOM sont cerclés en vert, les endosomes SNX1 en violet, PIN1 en bleu et PIN2 en rouge. Pour simplifier le schéma, PIN1 et PIN2 ont été représentées dans la même cellule, ce qui est rarement le cas in planta, et seuls les organites indispensables à la compréhension de la figure ont été représentés. |
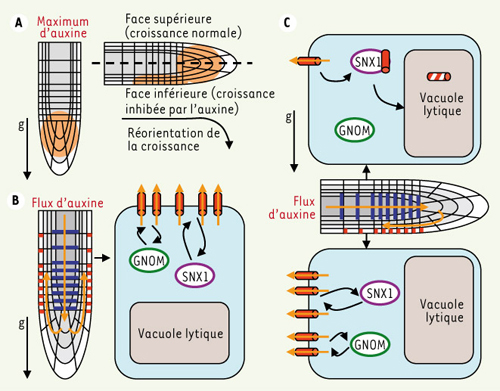
Les racines des plantes sont capables de sentir la gravité et poussent vers le bas. Quand elles rencontrent un obstacle, elles réorientent leur croissance à l’horizontale. Une fois celui-ci évité, leur croissance redevient verticale. Au laboratoire, il est possible de reproduire ce phénomène en faisant croître les racines verticalement dans des boîtes de Pétri, puis en positionnant les racines à l’horizontal par une rotation des boîtes de 90° (Figure 2). Le transporteur d’auxine PIN2 est impliqué dans la réorientation de la croissance racinaire en fonction de la gravité. Récemment, il a été démontré que PIN2 est internalisée et dégradée après gravistimulation, au niveau de la face supérieure de la racine mais pas de la face inférieure (Figure 2) [ 10]. L’auxine s’accumule ainsi vers la face inférieure de la racine permettant la réorientation de sa croissance. Nous avons montré que PIN2 transite par l’endosome SNX1 lors de ce processus avant d’être dégradée [8]. Ainsi, l’un des rôles de l’endosome SNX1 pourrait être de réguler la quantité de PIN2 à la membrane plasmique en fonction de la réponse à certains stimulus dont la gravistimulation. Les différents facteurs impliqués dans ce tri cellulaire et dans la répartition et la localisation des PIN au niveau de la membrane plasmique demeurent encore inconnus. L’étude de la dynamique du trafic des PIN constitue un domaine particulièrement intéressant pour une meilleure compréhension du rôle de l’auxine dans le développement des plantes.
| Figure 2.
L’endosome SNX1 contrôle la dégradation de PIN2 et le gravitropisme de la racine. A. Schéma représentant la répartition de l’auxine dans la pointe racinaire en situation normale (à gauche) et après gravistimulation (à droite). Après gravistimulation, l’auxine s’accumule sur la face inférieure de la racine, ce qui inhibe localement l’élongation cellulaire et provoque la courbure de la racine. B. En l’absence de gravistimulation, PIN2 répartit l’auxine de manière symétrique de part et d’autre de la racine. C. Après réorientation de la racine, PIN2 continue à recycler au niveau de la face inférieure de la racine, mais est dégradée dans sa face supérieure. La distribution de PIN2 devient asymétrique, l’auxine s’accumule vers le bas et la racine se courbe. Les maxima d’auxine et flux d’auxine sont représentés en orange, PIN1 en bleu et PIN2 en rouge. Le vecteur de gravité (g) est indiqué par une flèche verticale. |