| |
| Med Sci (Paris). 2007 December; 23(12): 1148–1158. Published online 2007 December 15. doi: 10.1051/medsci/200723121148.Les prions État des lieux 20 ans après l’apparition de l’encéphalopathie spongiforme bovine Carole Crozet and Sylvain Lehmann* Institut de Génétique Humaine, UPR1142 CNRS, CHU de Montpellier, UM1 Montpellier, 141, rue de la Cardonille, 34396 Montpellier Cedex 5, France |
Généralités sur les encéphalopathies spongiformes subaiguës transmissibles (ESST) Les ESST sont des maladies dégénératives du système nerveux central (SNC) aussi bien humaines (démences telles que la maladie de Creutzfeldt-Jakob [MCJ], Kuru, syndrome de Gerstmann-Sträussler-Scheinker [GSS], Insomnie Fatale Familiale [IFF]) qu’animales (tremblante du mouton ou Scrapie, encéphalopathie spongiforme bovine [ESB], féline [ESF], maladie du dépérissement chronique des cervidés [CWD]) [
1]. Une des caractéristiques essentielles des ESST réside dans leur durée d’incubation longue et silencieuse jusqu’à l’apparition de symptômes cliniques et leur caractère inexorablement fatal, expliquant ainsi le qualificatif de « subaiguë » attribué à cette maladie. Ces encéphalopathies sont dites spongiformes et transmissibles en raison respectivement d’une vacuolisation neuronale touchant le SNC (Figure 1), et de la transmissibilité de ces maladies (Figure 2). Notons qu’il est également possible de les transmettre expérimentalement par injection aux primates et aux rongeurs.
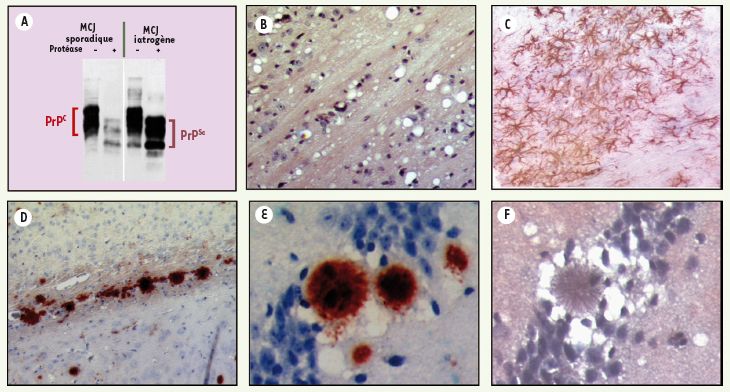
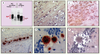 | Figure 1.
A. Détection de la PrP avant (PrPC) et après (PrPSc) digestion à la protéinase K dans des extraits de cerveau de patients atteints de forme sporadique et iatrogène de MCJ (Pr Warter et Mohr, CHU Strasbourg). B-F. Histologie et immunohistologie du SNC dans les ESST dans des modèles expérimentaux de souris. On retrouve généralement dans les ESST une vacuolisation neuronale importante (B), une gliose réactionnelle (C, immunohistochimie de la GFAP, glial fibrillary acidic protein), parfois la présence de plaques amyloïdes (D, immunohistochimie de la PrP) qui peuvent être de type floride entourées de vacuoles dans le cas du vMCJ (E, F) (clichés C. Crozet et A. Bencsik, AFSSA Lyon, France). |
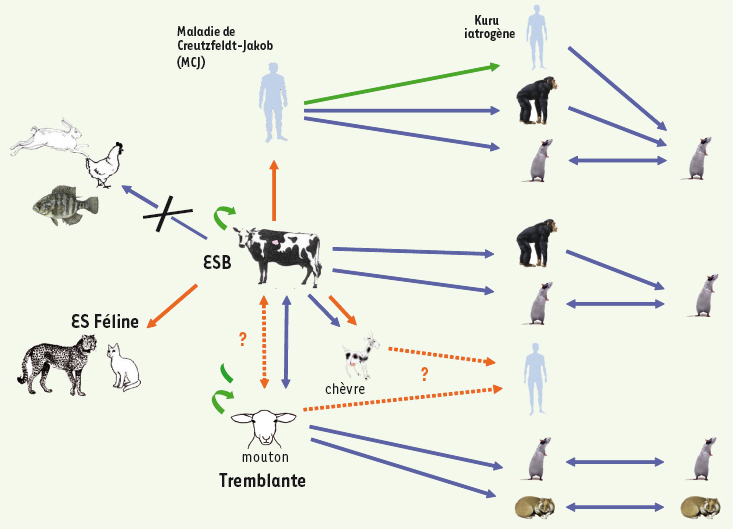
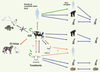 | Figure 2.
Transmission inter-espèces des prions. L’agent présent naturellement chez l’homme (MCJ), les bovins (ESB) et chez les petits ruminants (tremblante) a pu être transmis expérimentalement (flèches bleues) à d’autres espèces et en particulier aux rongeurs (souris et hamsters) et aux petits ruminants (ovins, caprins). En revanche, la transmission expérimentale de l’ESB n’a pas été possible chez les poissons, les poules ou le lapin, vraisemblablement à cause des différences de séquence de la PrP dans ces espèces. Au sein d’une même espèce (flèches vertes), les prions peuvent se transmettre par contamination iatrogène et cannibalisme (Kuru) chez l’homme, par l’alimentation en farines animales chez les bovins (ESB) et par transmission horizontale chez les petits ruminants (tremblante). Enfin, l’agent de l’ESB est passé « spontanément » d’une espèce à une autre, ce qui a été confirmé pour l’homme, les félins et la chèvre (flèches oranges pleines) et ce qui est théoriquement possible pour l’ovin, et pour l’homme après passage intermédiaire chez les petits ruminants (flèches oranges pointillées). |
Au niveau neuropathologique (Figure 1), en plus d’une perte de neurones et d’une vacuolisation neuronale intense (phénomène de spongiose), ces maladies sont aussi caractérisées par une prolifération des astrocytes (gliose réactionnelle), et surtout par l’accumulation cérébrale d’une protéine prion anormale (PrPSc). Cette PrPSc correspond à une isoforme anormale, qui résulterait de la conversion conformationelle d’une protéine PrP cellulaire (PrPC), codée par l’hôte et majoritairement exprimée dans le SNC et le système lympho-réticulaire [
2]. Si la structure primaire de la PrPSc est identique à celle de la PrPC, sa nouvelle conformation lui confère des propriétés biochimiques particulières. En effet, au cours du processus de « transconformation », la PrPC qui contient 42 % d’hélices-α et 3 % de feuillets-β adopte une structure riche en feuillets-β (54 %). Cette modification semble être responsable des propriétés d’insolubilité de la PrPSc dans les détergents ainsi que de sa capacité à former des agrégats alors que la PrPC est quant à elle soluble. De même, la PrPSc est partiellement résistante à la protéinase K (PK) alors que la PrPC y est sensible [
3]. Ces propriétés sont exploitées pour faciliter la détection de la PrPSc à des fins de diagnostic. Les maladies à prions font ainsi partie d’un groupe d’affections associées à l’agrégation de protéines et à la formation d’amyloïdes : ce sont des protéinopathies. Appartiennent à ce groupe la maladie d’Alzheimer, la maladie de Parkinson et la maladie de Huntington où il est décrit respectivement une agrégation du peptide Aβ, de l’α-synucléine et de la Huntingtine. Toutes ces affections sont associées le plus souvent à la formation d’amyloïdes par oligomérisation et agrégation de fragments protéiques ayant une structure β plissée, et présentent des paramètres physiopathologiques (stress oxydant, atteinte synaptique) assez proches. Ainsi les avancées sur les maladies à prions contribuent, tant sur un plan fondamental qu’appliqué, aux recherches sur les autres maladies neurodégénératives liées à l’agrégation de protéines [
4,
57,
60]. |
La situation des maladies à prions chez les animaux et l’apparition de l’encéphalopathie spongiforme bovine Chez les animaux, les premières données concernant les ESST remontent au XVIIIe siècle, avec la description, chez le mouton, d’une maladie « la tremblante ». Cette maladie fut également appelée « scrapie » en raison de la tendance des animaux à se gratter (to scrape). Les manifestations cliniques, survenant après une période d’incubation longue (10 mois à plusieurs années), sont variées (troubles du comportement, prurit, troubles moteurs). Non seulement transmissible [
5], cette maladie présente la singularité d’être une maladie contagieuse chez le mouton. Les placentas, les pâtures, ainsi que de nombreux organes périphériques sont infectieux [
6]. Par ailleurs, la séquence de la PrPC ovine présente des codons très polymorphes responsables d’un contrôle génétique de la sensibilité à la tremblante [
7]. En 1986 l’ESB fut décrite chez les bovins au Royaume-Uni (maladie de la « vache folle ») où plus de 180 000 cas ont été recensés depuis (Tableau I). La symptomatologie, survenant après une période d’incubation longue (5 à 6 ans), est dominée par l’apparition de troubles neurologiques d’ordre sensitif et moteur (nervosité, crainte, hyperexcitabilité, ataxie locomotrice) conduisant à la mort en quelques semaines à plusieurs mois. Les données épidémiologiques mettent en cause une contamination alimentaire via les farines animales provenant d’organes et d’os de ruminants infectés préparés avec des procédés de chauffage et d’extraction des graisses insuffisants vis-à-vis d’une contamination de type prion [
8]. L’interdiction des farines animales dans l’alimentation des ruminants (en 1988 en Angleterre et en 1990 en France, avec un renforcement en 1996) a conduit à un déclin très significatif de l’épizootie d’ESB dans ces deux pays (Figure 3, Tableau I). Cependant, un petit nombre de cas dits NAIF (Nés Après l’Interdiction des Farines) a été enregistré après ces interdictions, très probablement en raison de la contamination de la nourriture des bovins par des farines destinées à d’autres animaux de rente. Pour prévenir la présence de l’agent de l’ESB dans la chaîne alimentaire humaine, les principaux organes susceptibles de contenir des prions ont été retirés de la vente (matériaux à risques spécifiés : MRS), en 1989 au Royaume-Uni, en 1996 en France. En 1996, alors que la transmission de l’agent de l’ESB à l’homme était démontrée, le Royaume-Uni retira de la consommation tous les bovins de plus de 30 mois. Malgré ces mesures, une seconde crise « de la vache folle » éclata fin 2000, quand il est apparu évident que l’épizootie s’était étendue en Europe et que des animaux infectés étaient susceptibles d’entrer dans la chaîne alimentaire. Ce deuxième épisode provoqua une nouvelle baisse de la consommation de viande bovine conduisant la Commission Européenne à mettre en place à l’abattoir le dépistage systématique des bovins de plus de 24 mois (porté ensuite à 30 mois). De très rares cas d’ESB atypiques [
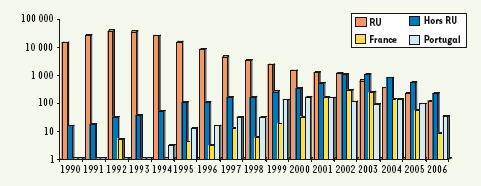
9], différents de l’ESB classique, furent ainsi identifiés. La diminution de l’épizootie observée depuis peu en Europe conduira certainement à un assouplissement des mesures de protection des consommateurs en maintenant néanmoins une veille sanitaire de la présence résiduelle d’ESB. 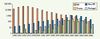 | Figure 3.
Nombre de cas d’ESB dans différents pays. Le nombre de cas annuels d’ESB au Royaume-Uni, dans le reste du monde (hors RU), en France et au Portugal est représenté en ordonnée logarithmique. Au Royaume-Uni, un pic est présent en 1992 avec une valeur de 36 682 cas. La diminution observée après 1992 est la conséquence du retrait des farines de l’alimentation des bovins effectué cinq ans auparavant (ce qui correspond environ à la période d’incubation de la maladie chez les bovins). Le nombre de cas hors Royaume-Uni suit une courbe décalée dans le temps ce qui correspond à une poursuite de l’utilisation de farines contaminées et à des mesures de protection plus tardives. Un pic hors Royaume-Uni est atteint en 2003, année à partir de laquelle ce nombre devient supérieur à celui du Royaume-Uni. En France, le nombre de cas d’ESB est en diminution importante et il est maintenant inférieur à celui d’autres pays touchés comme le Portugal. Concernant les principaux pays touchés, l’Allemagne comptabilisait au total 404 cas (en mai 2007), la Suisse 464 (octobre 2006), le Portugal 1 029 (décembre 2006), l’Irlande 1 596 (avril 2007), l’Italie 139 (décembre 2006), la Belgique 133 (décembre 2006), l’Espagne 681 (décembre 2006), et la France 985 cas (en décembre 2006, le premier cas ayant été identifié en 1991). Hors Europe, le Japon compte 31 cas (décembre 2006), les États-Unis 2 (juin 2006) et le Canada : 10 (septembre 2006). Source : http://www.oie.int/eng/info/en_esb.htm / World organisation for animal health (OIE). |
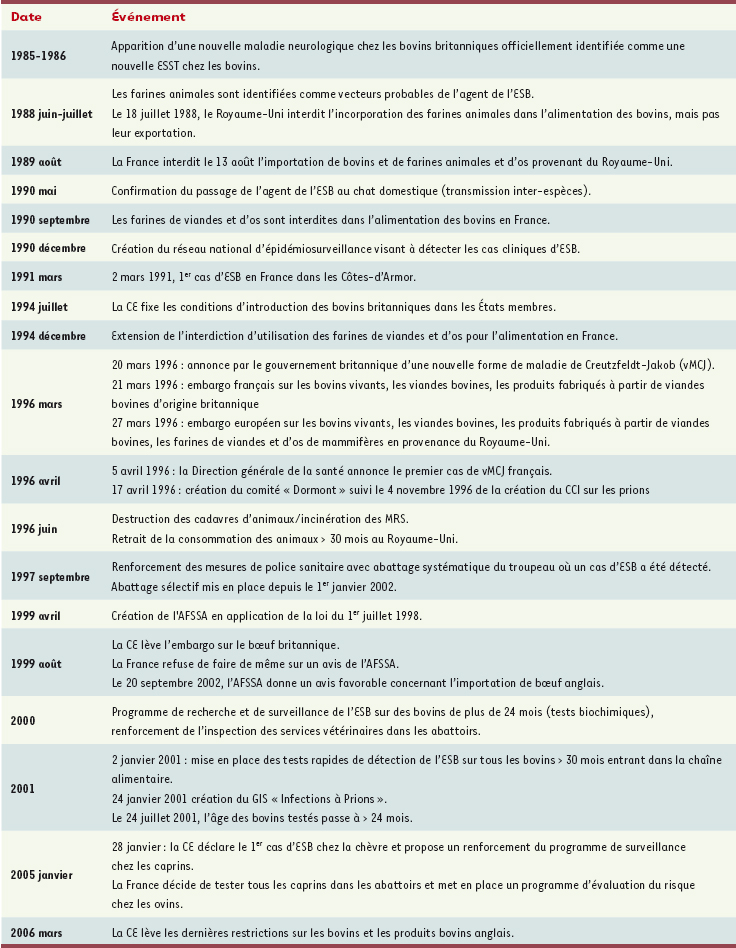
 | Tableau I.
Bref historique de l’ESB et du vMCJ.
|
De façon consécutive à l’émergence de l’ESB, l’ESF fut identifiée chez le chat au Royaume-Uni en 1990 [
10] puis chez d’autres félins en captivité tels que le puma ou le guépard [
11] probablement à la suite d’une contamination alimentaire par la souche ESB. Concernant les ovins et caprins, la question de l’éventuelle transmission de l’ESB par l’intermédiaire de farines contaminées s’est très vite posée et est devenue d’une importance primordiale dans le domaine de la santé publique. En effet, si la tremblante naturelle ne semble pas dangereuse pour l’homme, le passage de l’agent de l’ESB chez les petits ruminants, démontré possible de façon expérimentale [
12], pourrait représenter une menace sérieuse puisque la souche ESB apparaît capable de franchir les barrières d’espèce et de toucher l’homme (Figure 2). Dans une telle hypothèse, le risque majeur serait que la souche ESB se comporte comme une souche de tremblante naturelle avec un tropisme dans de nombreux tissus lymphoïdes et nerveux périphériques. Cela pourrait entraîner une transmission entre animaux de façon endémique ainsi qu’une pérennisation de l’infection par l’agent de l’ESB dans le cheptel ovin sans exclure un possible masquage par une souche de tremblante naturelle dans le cas d’une co-infection des animaux [
13]. Toutes ces incertitudes ont conduit à l’initiation, en 2002, des programmes de dépistage prion chez les petits ruminants. La souche ESB a ainsi été détectée récemment chez la chèvre [
14] montrant que la barrière d’espèce avait pu être franchie. De très nombreux cas de tremblantes « atypiques » ont aussi été détectés [
15], touchant même des moutons génétiquement résistants aux tremblantes classiques. Il est cependant encore trop tôt pour évaluer le risque que représentent ces formes pour la santé animale ou humaine. Il apparaît évident que l’on traverse depuis quelques années une période d’émergence d’ESST dans de nombreuses espèces animales. En Amérique du Nord sont ainsi apparues l’encéphalopathie du vison et la maladie du dépérissement chronique des cervidés (chronic wasting disease : CWD) [
16]. Cette dernière, qui se répand dans les groupes d’animaux sauvages, représente un sujet d’inquiétude important pour la santé animale bien que pour le moment aucun risque pour l’homme n’a pu être formellement identifié [
17]. |
La situation des maladies à prions chez l’homme et l’apparition du nouveau variant de la maladie de Creutzfeldt-Jakob Chez l’homme, Creutzfeldt et Jakob ont décrit en 1920 et 1921 pour la première fois une encéphalopathie spongiforme, nommée alors maladie de Creutzfeldt-Jakob (MCJ) [
18,
19]. Actuellement, ces maladies forment un groupe rare d’affections neurodégénératives (prévalence globale 1-2 cas/million habitants/an) ayant plusieurs formes nosologiques [
20] :
-
La forme sporadique (80-90 % des MCJ) touche des personnes de 50 à 75 ans, elle est caractérisée par une détérioration mentale (démence), des signes neurologiques et visuels et son évolution est rapide et fatale (2 à 12 mois).
-
Les formes familiales (IFF, GSS) à mode de transmission autosomique dominant, sont liées à des mutations du gène de la PrP, et touchent une tranche d’âge allant de 34 à 54 ans.
-
Les formes infectieuses font suite à des contaminations centrales iatrogènes (interventions chirurgicales, c’est-à-dire greffe de dure-mère, greffe de cornée…), ou plus souvent périphériques, telles que l’historique Kuru lié à un cannibalisme rituel ainsi que la contamination d’enfants associée à l’utilisation d’hormone de croissance purifiée à partir de cerveaux de personnes atteintes de MCJ.
S’est ajoutée en 1996 une nouvelle forme d’ESST chez l’homme : le variant de la maladie de Creutzfeldt-Jakob (vMCJ) [
21], qui touche des patients jeunes (en moyenne 29 ans), comparativement aux formes sporadiques. Cette maladie évolue plus lentement (14 mois en moyenne) et s’exprime au début par des symptômes psychiatriques, puis une ataxie, des mouvements involontaires, enfin un état stuporeux et comateux. En se fondant sur des critères épidémiologiques (répartition géographique, âge…), mais aussi sur la caractérisation de la souche responsable du vMCJ, le passage de l’ESB à l’homme a pu être proposé, ce qui a conduit en 1996 au déclenchement de la « crise de la vache folle » (Encadré 1). Compte tenu des incertitudes en termes de sensibilité de la population, de dose infectante ou de durée d’incubation, les fourchettes d’estimation du nombre de personnes atteintes, très larges initialement (100 000 cas), n’ont pu être précisées qu’avec un suivi épidémiologique associé à des modélisations mathématiques plus affinées. Au 5 janvier 2007, on comptait un total de 158 cas de vMCJ en Angleterre et 21 cas en France (Figure 4). Certaines études prédisent qu’il y aura au total de l’ordre de quelques centaines de patients atteints de vMCJ au Royaume-Uni [
22]. Cependant, des études rétrospectives réalisées au Royaume-Uni, portant sur la détection de la PrPSc sur un échantillon important de biopsies d’amygdales ou d’appendices (12 674 au total), indiquent, par extrapolation, une prévalence de 237 cas de vMCJ/million de personnes, plusieurs milliers de personnes pourraient ainsi être en phase d’incubation du vMCJ [
23]. Ces observations confirment aussi les craintes qui avaient été précédemment exprimées concernant le tropisme lymphoïde du vMCJ puisque des taux importants de PrPSc et d’agent infectieux sont retrouvés dans les organes lymphoïdes périphériques des patients atteints du vMCJ. Cela constitue un risque transfusionnel auquel s’ajoute l’impossibilité de détecter la PrPSc dans le sang par les méthodes diagnostiques classiques. Ces craintes sont depuis peu renforcées par l’identification de 4 cas de transmission de vMCJ par transfusion sanguine en Angleterre [
24]. Par ailleurs, si tous les patients atteints sont homozygotes M/M au codon polymorphe (129) de la PrP humaine, tout comme 40 % de la population, il apparaît difficile de dire avec certitude si les autres génotypes développeront également la maladie. Néanmoins, parmi les 4 patients atteints de vMCJ et vraisemblablement contaminés par transfusion sanguine, l’un d’entre eux, qui était asymptomatique, s’est révélé être de génotype hétérozygote M/V au codon 129, ce qui montre la possibilité de transmission du vMCJ chez des individus autres que M/M à ce même codon. Cela est également renforcé par la mise en évidence de la présence de PrPSc dans l’appendice d’un individu de génotype 129V/V détecté lors d’études rétrospectives anglaises sur les appendices [
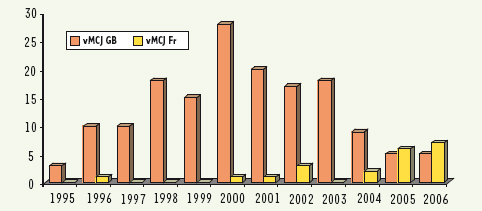
25].  | Figure 4.
Nombre de cas certains ou probables de vMCJ en France et au Royaume-Uni. Le nombre de cas de vMCJ au Royaume-Uni (total 158) et en France (total 21) est représenté par année. On constate un pic au Royaume-Uni en 2000 alors que le nombre de patients français semble toujours en augmentation. Tous ces cas de vMCJ symptomatiques sont d’un génotype particulier (129 M/M) qui est présent chez 40 % de la population caucasienne. Il est possible que les autres génotypes développent la maladie avec une incubation plus longue et/ou des signes cliniques différents. Sources. Royaume-Uni : http://www.cjd.ed.ac.uk/figures.htm - France : http://www.invs.sante.fr/publications/mcj/donnees_mcj.html
|
Les préoccupations en santé publique se portent maintenant principalement sur les risques de transmission secondaire des prions (iatrogène ou sanguine). Ainsi, plusieurs recommandations ont été modifiées dans les domaines de la décontamination hospitalière (conditions d’autoclavage), des dons du sang (exclusion du don du sang des personnes ayant séjourné plus d’un an au Royaume-Uni entre 1980 et 1996) ou encore des pratiques médicales invasives chez les patients à risque (endoscopie, chirurgie).

|
L’agent infectieux des ESST et la protéine du prion La nature exacte de l’agent infectieux responsable des ESST est depuis longtemps sujette à controverses car elle ne répond pas aux critères classiques des agents infectieux : grande résistance aux procédés qui détruisent les microorganismes et les virus, invisibilité en microscopie électronique, absence de réponse immunitaire. Cela explique la terminologie française d’agents transmissibles non conventionnels (ATNC). Selon Stanley Prusiner, la protéine PrPSc serait elle-même l’agent infectieux : c’est l’hypothèse des « prions » pour « Proteinaceous infectious particles » [
26]. La PrPSc interagirait directement avec la PrPC et induirait un changement de conformation de cette dernière. De plus, l’efficacité de transmission est corrélée au degré d’homologie entre les séquences de PrPSc de l’inoculum et celles de PrPC de l’hôte, c’est la barrière d’espèce ou de transmission (Figure 2). Cette hypothèse du prion a été très controversée initialement car elle allait à l’encontre de l’existence présumée d’un virus et des dogmes de la microbiologie et de la virologie conventionnelle en excluant toute implication d’acides nucléiques dans l’infection. Au cours des vingt dernières années, si de nombreuses découvertes sont venues étayer cette hypothèse, des interrogations subsistent toujours. Parmi les ambiguïtés relevées : l’absence de détection de PrPSc dans des cerveaux murins infectieux après transmission de l’ESB suggère que la PrPSc n’est pas le seul constituant de l’agent infectieux [
27]. De même, des souris transgéniques dans lesquelles la PrP sauvage a été remplacée par une PrP portant des mutations retrouvées dans les formes familiales de Creutzfeldt-Jakob, ne développent pas de maladies spontanées [
28], ce qui ne reflète pas la maladie humaine. Des résultats opposés avaient été obtenus par l’équipe de S. Prusiner mais avec des souris surexprimant des forts taux non physiologiques de PrP mutées, biaisant alors l’interprétation [
29] et sans pour autant que la maladie soit transmissible à des souris sauvages. Ces deux résultats opposés illustrent bien la difficulté d’avoir des arguments clairs en faveur de cette théorie. Cependant récemment, des fibres amyloïdes, obtenues à partir de protéines PrP recombinantes tronquées (89-230), ont été décrites comme « infectieuses » après l’injection de très grandes quantités de fibrilles dans un modèle de souris transgéniques exprimant cette PrP tronquée [
30]. Cela pourrait constituer un argument quasi définitif en faveur de cette théorie des Prions si ces résultats étaient confirmés par d’autres équipes et validés dans des souris sauvages et surtout avec des protéines PrP recombinantes non tronquées. De même, les succès récents de l’amplification de PrPSc et de l’infectiosité du Prion par la méthode de « Protein Misfolding Cyclic Amplification » (PMCA) constituent un argument supplémentaire pour les prions [
31]. Néanmoins, l’infectiosité dans ces deux exemples reste très faible malgré une quantité de PrPSc détectée élevée. Une des hypothèses alternatives à celle du rôle unique de la PrP propose un agent infectieux de nature virale ou un virino : c’est-à-dire un agent contenant son propre acide nucléique enveloppé dans une protéine codée par l’hôte. Une autre possibilité pourrait être que la PrPSc ou plutôt les agrégats de PrPSc, contiendraient une petite quantité d’acides nucléiques provenant de l’hôte appelé co-prion. Cette théorie n’est pas exclue même si pour le moment personne n’a prouvé la présence de cet agent. Par ailleurs, lors des tentatives de purification du Prion, les préparations infectieuses contiennent une grande quantité d’acides nucléiques ainsi que de discrètes particules de 25-30 nm de diamètre tout à fait dans le spectre de virus conventionnels ; particules qui pourraient héberger un génome de plus d’1 kb [
32]. De même, des études ont montré un co-fractionnement spécifique de l’infectiosité liée à l’agent de la MCJ et des complexes de rétrovirus endogènes IAP (ARN viral, protéines GAG) connus pour être particulièrement résistants aux traitements physico-chimiques [
33]. Enfin, de très récentes expériences ont mis en évidence que des rétrovirus de type MuLV (Murine leukemia virus) ou VIH-1 (virus de l’immunodéficience humaine) pouvaient être produits dans des cellules infectées par les prions et recruteraient dans leur enveloppe la PrPC et la PrPSc. Leblanc et al. [
34] ont ainsi montré que l’infection et la production de particules virales de MuLV favoriseraient la production de PrPC, de PrPSc et d’infectivité prion dans le cas de cellules infectées par les prions. Ces travaux indiquent que des rétrovirus pourraient constituer des cofacteurs de dissémination du prion.

Dans le futur, des réponses seront peut-être apportées par l’utilisation de modèles dits analogues. Par exemple, chez les levures, des protéines ayant des comportements « prion » (association à un changement de conformation transmissible) ont été décrites [
35]. Ces « prions » ne sont pas pathologiques, ce qui suggère l’existence de protéines autres que la PrP ayant un comportement prion dans le cadre de leur fonction physiologique (Encadré 2). Ces découvertes donnent une dimension nouvelle et physiologique au concept de transmission d’une information fondé sur la conformation des protéines [
36]. Les phénomènes prions participeraient ainsi à des mécanismes épigénétiques de transmission d’une information, indépendamment du matériel génétique. Enfin, il faut noter que la PrPC normale donne également du fil à retordre en particulier en ce qui concerne sa fonction physiologique. L’amélioration de nos connaissances dans ce domaine est essentielle pour comprendre la physiopathologie des ESST. En effet, si les souris invalidées pour le gène de la PrP n’ont pas de phénotype majeur [
37], des fonctions subtiles sont néanmoins touchées. On peut citer par exemple une altération de la réponse au stress oxydant, du cycle circadien, de l’activité synaptique, de la mémoire à long terme… Si la mise en évidence in vivo de la fonction de la PrP est plutôt difficile, les modèles cellulaires offrent la possibilité d’identifier des mécanismes dans lesquels la PrPC joue un rôle prépondérant [
56,
58,
59]. La PrPC étant une protéine membranaire à ancrage GPI (glycosyl-phosphatidylinositol), elle serait impliquée dans des voies de signalisation [
38] en tant que senseur du stress oxydant ou nécessaire à la survie neuronale. Sa liaison au cuivre est également importante pour ses fonctions physiologiques [
39]. Sa fonction semble liée à l’activité synaptique, l’adhérence cellulaire et la poussée neuritique en association avec d’autres molécules (LRP, Laminine, N-CAM) [
40–
42]. Récemment, il a même été montré que la PrP régulerait la prolifération des précurseurs neuraux durant le développement et lors de la neurogenèse adulte [
43] ainsi que la prolifération des cellules souches hématopoïétiques [
44]. Aussi, la modification des fonctions physiologiques de la PrPC dans les cellules neuronales au cours de l’infection pourrait expliquer les altérations neuronales observées [56]. |
Moyens diagnostiques et thérapeutiques dans les maladies à prions Le diagnostic de certitude des maladies à prions repose sur l’analyse histopathologique du cerveau mais les tests rapides utilisés en routine sont fondés sur la mise en évidence de la PrPSc par des techniques immunologiques (immunohistochimie, western-blot, immunoréplique, ELISA, « conformation dependent immunoassay » (CDI)) en tirant partie des propriétés de modifications conformationnelles et de résistance à la digestion par les protéases. La sensibilité de cette détection s’est grandement améliorée à la suite de la mise en place des programmes de dépistage de l’ESB. Par ailleurs, le seul marqueur indirect de la maladie disponible à ce jour chez l’homme est la présence de la protéine 14-3-3 dans le liquide cérébro-spinal [
45], une conséquence de la mort neuronale rapide associée à la MCJ. Toutefois, ce marqueur n’est pas performant dans toutes les formes d’ESST et la découverte de techniques plus sensibles et prometteuses fondées en particulier sur la précipitation et/ou la concentration de la PrPSc de façon à augmenter sa détection, suggère que la détection d’une très faible quantité de PrPSc dans différents types d’échantillons (tissus, urine, sang…) sera prochainement possible. Des efforts sont particulièrement centrés sur le sang [
46] car l’amélioration de la détection préclinique des maladies à prions pourra favoriser une thérapie précoce ainsi que la prévention d’une transmission secondaire (iatrogène, transfusion sanguine). En terme de thérapie, si les maladies à prions sont des affections neurodégénératives pour lesquelles il existe des modèles animaux reproduisant complètement la physiopathologie des formes humaines, néanmoins, aucune thérapie n’est à ce jour validée chez l’animal de laboratoire, et encore moins chez l’homme, qui guérisse ou même ralentisse la maladie une fois les symptômes apparus [
47]. Les évaluations récentes de molécules utilisables directement chez l’homme (quinacrine) ont été décevantes. Des essais plus prometteurs d’administration intracérébrale de polysulfate de pentosan sont en cours [
48]. Le plus grand espoir réside dans le développement d’approches immunologiques [
49] ou génétiques visant à bloquer ou à diminuer l’expression de la PrPC [
50] ou encore l’interaction PrPC/PrPSc [
51]. Ainsi, malgré les efforts importants déployés, nous ne possédons actuellement ni moyen diagnostique ante mortem, ni traitement des maladies à Prions. De nombreuses voies doivent néanmoins être explorées pour mettre en place des stratégies thérapeutiques : par exemple une meilleure connaissance de la fonction de la PrPC (défense contre le stress oxydant et dans la survie neuronale ? Relation entre la PrP et les acides nucléiques ? Molécules interagissant physiologiquement avec la PrP ?). De même, une meilleure connaissance de la maladie et de la physiopathologie semble indispensable pour établir de nouvelles cibles thérapeutiques : rôle des cytokines, rôle de l’activation microgliale, neurogenèse adulte… |
L’attention portée aux maladies à Prions a été conditionnée et stimulée ces vingt dernières années par deux éléments :
-
l’apparition de l’ESB et les risques associés,
-
les interrogations sur la nature des prions.
Par ailleurs, les recherches sur les prions présentent deux champs d’extension :
-
les protéinopathies (Alzheimer, Parkinson, amyloses…) dont les ESST sont un exemple particulièrement démonstratif,
-
l’étude des mécanismes de transmission épigénétique de type prion.
Dans le cadre plus général de la santé publique, les recherches sur les prions se focalisent maintenant sur les risques de contaminations secondaires et sanguines, et l’évaluation du risque lié à la présence de l’ESB chez les petits ruminants. En conclusion, compte tenu de l’analyse globale de la situation 20 ans après, et de la persistance de nombreuses questions sur les risques et les mécanismes physiopathologiques des ESST, il est clair que les efforts de recherche fondamentale et appliquée doivent être poursuivis afin de progresser de façon satisfaisante vers la compréhension et le contrôle des prions. |
Les auteurs remercient les Drs J. Grassi et T. Baron pour leurs commentaires qui ont aidé à la rédaction de ce manuscrit.
|
1. Prusiner SB, Scott MR, Dearmond SJ, Cohen FE. Prion protein biology. Cell 1998; 93 : 337–48. 2. Caughey B, Race RE, Chesebro B. Detection of prion protein mRNA in normal and scrapie-infected tissues and cell lines. J Gen Virol 1988; 69 : 711–6. 3. Meyer RK, McKinley MP, Bowman KA, et al. Separation and properties of cellular and scrapie prion proteins. Proc Natl Acad Sci USA 1986; 83 : 2310–4. 4. Aguzzi A, Haass C. Games played by rogue proteins in prion disorders and Alzheimer’s disease. Science 2003; 302 : 814–8. 5. Cuille J, Chelle P. La maladie dite tremblante du mouton est-elle inoculable ? CR Acad Sci
Paris 1936; 1552–4. 6. Andreoletti O, Lacroux C, Chabert A, et al. PrP(Sc) accumulation in placentas of ewes exposed to natural scrapie: influence of fetal PrP genotype and effect on ewe-to-lamb transmission. J Gen Virol 2002; 83 : 2607–16. 7. Goldmann W, Hunter N, Smith G, et al. PrP genotype and agent effects in scrapie: change in allelic interaction with different isolates of agent in sheep, a natural host of scrapie. J Gen Virol 1994; 75 : 989–95. 8. Wilesmith JW. An epidemiologist’s view of bovine spongiform encephalopathy. Philos Trans R Soc Lond B Biol Sci 1994; 343 : 357–61. 9. Biacabe AG, Laplanche JL, Ryder S, Baron T. Distinct molecular phenotypes in bovine prion diseases. EMBO Rep 2004; 5 : 110–5. 10. Pearson GR, Gruffydd-Jones TJ, Wyatt JM, et al. Feline spongiform encephalopathy. Vet Rec 1991; 128 : 532. 11. Baron T, Belli P, Madec JY, et al. Spongiform encephalopathy in an imported cheetah in France. Vet Rec 1997; 141 : 270–1. 12. Lezmi S, Martin S, Simon S, et al. Comparative molecular analysis of the abnormal prion protein in field scrapie cases and experimental bovine spongiform encephalopathy in sheep by use of Western blotting and immunohistochemical methods. J Virol 2004; 78 : 3654–62. 13. Baron TG, Biacabe AG. Molecular analysis of the abnormal prion protein during coinfection of mice by bovine spongiform encephalopathy and a scrapie agent. J Virol 2001; 75 : 107–14. 14. Eloit M, Adjou K, Coulpier M, et al. BSE agent signatures in a goat. Vet Rec 2005; 156 : 523–4. 15. Buschmann A, Biacabe AG, Ziegler U, et al. Atypical scrapie cases in Germany and France are identified by discrepant reaction patterns in BSE rapid tests. J Virol Methods 2004; 117 : 27–36. 16. Miller MW, Williams ES. Chronic wasting disease of cervids. Curr Top Microbiol Immunol 2004; 284 : 193–214. 17. Kong Q, Huang S, Zou W, et al. Chronic wasting disease of elk: transmissibility to humans examined by transgenic mouse models. J Neurosci 2005; 25 : 7944–9. 18. Creutzfeldt H. Über eine eigenartige herdförmige Erkrankung des Zentralnervensystems. Zeitschrift für die Gesamte Neurologie und Psychiatrie 1920; 57 : 1–18. 19. Jakob A. Über eigenartige Erkrankungen des Zentralnervensystems mit bemerkenswerten anatomischen Befunde (spastische Pseudosklerose-Encephalomyelopathie mit disseminierten Degenerationsherden). Deutsche Zeitschrift für Nervenheilkunde 1921; 70 : 132–46. 20. Parchi P, Gambetti P. Human prion diseases. Curr Opin Neurol 1995; 8 : 286–93. 21. Will RG, Ironside JW, Zeidler M, et al. A new variant of Creutzfeldt-Jakob disease in the UK. Lancet 1996; 347 : 921–5. 22. Ghani AC, Donnelly CA, Ferguson NM, Anderson RM. Updated projections of future vCJD deaths in the UK. BMC Infect Dis 2003; 3 : 4. 23. Hilton DA, Ghani AC, Conyers L, et al. Prevalence of lymphoreticular prion protein accumulation in UK tissue samples. J Pathol 2004; 203 : 733–9. 24. Ironside JW. Variant Creutzfeldt-Jakob disease: risk of transmission by blood transfusion and blood therapies. Haemophilia 2006; 12 (suppl 1) : 8–15. 25. Ironside JW, Bishop MT, Connolly K, et al. Variant Creutzfeldt-Jakob disease: prion protein genotype analysis of positive appendix tissue samples from a retrospective prevalence study. Br Med J 2006; 332 : 1186–8. 26. Prusiner SB. Novel proteinaceous infectious particles cause scrapie. Science 1982; 216 : 136–44. 27. Lasmezas CI, Deslys JP, Robain O, et al. Transmission of the BSE agent to mice in the absence of detectable abnormal prion protein. Science 1997; 275 : 402–5. 28. Manson JC, Jamieson E, Baybutt H, et al. A single amino acid alteration (101L) introduced into murine PrP dramatically alters incubation time of transmissible spongiform encephalopathy. EMBO J 1999; 18 : 6855–64. 29. Hsiao KK, Groth D, Scott M, et al. Serial transmission in rodents of neurodegeneration from transgenic mice expressing mutant prion protein. Proc Natl Acad Sci USA 1994; 91 : 9126–30. 30. Legname G, Baskakov IV, Nguyen HO, et al. Synthetic mammalian prions. Science 2004; 305 : 673–6. 31. Castilla J, Saa P, Hetz C, Soto C. In vitro generation of infectious scrapie prions. Cell 2005; 121 : 195–206. 32. Manuelidis L. A 25 nm virion is the likely cause of transmissible spongiform encephalopathies. J Cell Biochem 2007; 100 : 897–915. 33. Manuelidis L. Dementias, neurodegeneration, and viral mechanisms of disease from the perspective of human transmissible encephalopathies. Ann NY Acad Sci 1994; 724 : 259–81. 34. Leblanc P, Alais S, Porto-Carreiro I, et al. Retrovirus infection strongly enhances scrapie infectivity release in cell culture. EMBO J 2006; 25 : 2674–85. 35. Wickner RB, Edskes HK, Maddelein ML, et al. Prions of yeast and fungi. Proteins as genetic material. J Biol Chem 1999; 274 : 555–8. 36. Tuite MF, Cox BS. Propagation of yeast prions. Nat Rev Mol Cell Biol 2003; 4 : 878–90. 37. Bueler H, Fischer M, Lang Y, et al. Normal development and behaviour of mice lacking the neuronal cell-surface PrP protein. Nature 1992; 356 : 577–82. 38. Mouillet-Richard S, Ermonval M, Chebassier C, et al. Signal transduction through prion protein. Science 2000; 289 : 1925–8. 39. Lehmann S. Metal ions and prion diseases. Curr Opin Chem Biol 2002; 6 : 187–92. 40. Chen S, Mange A, Dong L, Schachner M. Different signal transduction pathways are involved in neurite outgrowth and neuronal survival mediated by the prion protein. Mol Cell Neurosci 2003; 2 : 227–33. 41. Simoneau S, Haik S, Leucht C, et al. Different isoforms of the non-integrin laminin receptor are present in mouse brain and bind PrP. Biol Chem 2003; 384 : 243–6. 42. Cazaubon S, Viegas P, Couraud PO. Fonctions de la protéine prion PrPc.Med Sci (Paris) 2007; 23 : 741–5. 43. Steele AD, Emsley JG, Ozdinler PH, et al. Prion protein (PrPc) positively regulates neural precursor proliferation during developmental and adult mammalian neurogenesis. Proc Natl Acad Sci USA 2006; 103 : 3416–21. 44. Zhang CC, Steele AD, Lindquist S, Lodish HF. Prion protein is expressed on long-term repopulating hematopoietic stem cells and is important for their self-renewal. Proc Natl Acad Sci USA 2006; 103 : 2184–9. 45. Zerr I, Bodemer M, Weber T. The 14-3-3 brain protein and transmissible spongiform encephalopathy. N Engl J Med 1997; 336 : 875. 46. Brown P. Blood infectivity, processing and screening tests in transmissible spongiform encephalopathy. Vox Sang 2005; 89 : 63–70. 47. Brown P. Drug therapy in human and experimental transmissible spongiform encephalopathy. Neurology 2002; 58 : 1720–5. 48. Todd NV, Morrow J, Doh-Ura K, et al. Cerebroventricular infusion of pentosan polysulphate in human variant Creutzfeldt-Jakob disease. J Infect 2005; 50 : 394–6. 49. Aguzzi A, Glatzel M, Montrasio F, et al. Interventional strategies against prion diseases. Nat Rev Neurosci 2001; 2 : 745–9. 50. Mallucci G, Dickinson A, Linehan J, et al. Depleting neuronal PrP in prion infection prevents disease and reverses spongiosis. Post-natal knockout of prion protein alters hippocampal CA1 properties, but does not result in neurodegeneration. Science 2003; 302 : 871–4. 51. Crozet C, Lin YL, Mettling C, et al. Inhibition of PrPSc formation by lentiviral gene transfer of PrP containing dominant negative mutations. J Cell Sci 2004; 117 : 5591–7. 52. Fernandez-Bellot E, Guillemet E, Ness F, et al. The URE3 phenotype: evidence for a soluble prion in yeast. EMBO Rep 2002; 3 : 76–81. 53. Saupe SJ, Clave C Begueret J. Vegetative incompatibility in filamentous fungi: Podospora and Neurospora provide some clues. Curr Opin Microbiol 2000; 3 : 608–12. 54. Si K, Lindquist S, Kandel ER. A neuronal isoform of the aplysia CPEB has prion-like properties. Cell 2003; 115 : 879–91. 55. Shorter J, Lindquist S. Prions as adaptive conduits of memory and inheritance. Nat Rev Genet 2005; 6 : 435–50. 56. Cazaubon S, Viegas P, Couraud PO. Fonctions de la protéine prion PRPC. Med Sci (Paris) 2007; 23 : 741–5. 57. Bousset L, Melki R. Protéines prions : propriétés de repliement et d’agrégation. Med Sci (Paris) 2005; 21 : 634–40. 58. Madly B, Chrétien F. La structure de la protéine prion et la relation avec son infectiosité. Med Sci (Paris) 2005; 21 : 806–7. 59. Février B, Laude H, Raposo G, Vilette D. Les exosomes : des convoyeurs de prions ? Med Sci (Paris) 2005; 21 : 132–3. 60. Goggin K, Roucou X. La protéine prion ne se fait pas prier pour faire des agrégats moléculaires. Med Sci (Paris) 2006; 22 : 1013–4. |