| |
| Med Sci (Paris). 2007 December; 23(12): 1133–1140. Published online 2007 December 15. doi: 10.1051/medsci/200723121133.La cellule souche cancéreuse Un pilote aux commandes du cancer du sein Christophe Ginestier,1* Hasan Korkaya,1 Gabriela Dontu,1 Daniel Birnbaum,2* Max S. Wicha,1 and Emmanuelle Charafe-Jauffret2 1University of Michigan Medical Center, Comprehensive Cancer Center, Int Med-Hematology/Oncology, 1500 E Medical Center Drive, Ann Arbor, MI, États-Unis 2UMR 599 Inserm , Institut Paoli- Calmettes , Laboratoire d’Oncologie Moléculaire, Centre de Recherche en Cancérologie de Marseille, et Université de la Méditerranée, 27, boulevard Leï Roure, 13009 Marseille, France |
Les cellules souches mammaires normales (CSN) chez l’adulte La glande mammaire est l’un des organes au sein desquels l’existence de cellules souches normales (CSN) à l’état adulte est la plus probable au regard même de la biologie de la glande. En effet, la glande mammaire achève son développement lors de la puberté et subit de nombreuses modifications morphologiques à l’âge adulte en fonction des périodes de la vie génitale, notamment durant les périodes de gestation, de lactation et de sevrage [
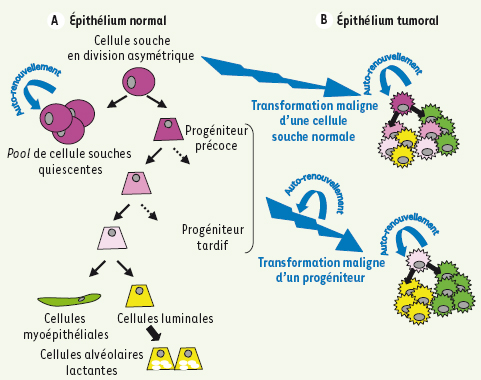
1]. Les CSN épithéliales organisent le fonctionnement de la glande mammaire grâce à des propriétés intrinsèques spécifiques. Ces propriétés associent une longue durée de vie et une capacité à la fois à s’auto-renouveler et à produire des cellules filles capables de se différencier. La capacité d’auto-renouvellement permet de préserver et de réguler le pool de CSN dans la glande mammaire. Lors de la division cellulaire, la CSN donne naissance à deux cellules filles gardant les propriétés de la cellule souche mère (division symétrique), ou à une cellule identique à la cellule souche mère et une cellule, le progéniteur, engagée dans la voie de la différenciation (division asymétrique) [
2]. Le progéniteur se divisera plusieurs fois avant de donner à la fin du processus de maturation, une cellule spécialisée (Figure 1A). 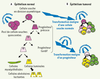 | Figure 1.
Différenciation de l’épithélium mammaire normal et tumoral. A. Le pool de cellules souches de l’épithélium mammaire normal (CSN) est globalement dans un état quiescent. Une CSN peut se diviser de façon asymétrique afin de donner naissance à une cellule souche identique à la cellule d’origine grâce a la propriété d’auto-renouvellement, et une cellule progénitrice engagée dans la voie de la différenciation. La CSN nouvellement formée pourra retourner dans un état quiescent tandis que le progéniteur précoce va continuer à se diviser pour donner des progéniteurs tardifs qui évolueront en cellules spécialisées qui composent l’épithélium mammaire (cellules luminales, cellules myoépithéliales et cellules alvéolaires lactantes). B. Lors de l’oncogenèse, les cellules ciblées par la transformation maligne pourront être soit les cellules souches, soit les progéniteurs de l’épithélium normal. Les cellules souches transformées ou cellules souches cancéreuses (CSC) garderont les propriétés des cellules souches de l’épithélium normal, c’est-à-dire l’auto-renouvellement pour guider la tumorigénicité et la capacité à se différencier. Lorsque les CSC ont comme cellule d’origine un progéniteur, elles réacquièrent la propriété d’auto-renouvellement lors de la transformation maligne. |
La différenciation permet à la CSN de donner naissance à toutes les cellules épithéliales matures de la glande mammaire. Ces cellules matures vont acquérir lors du processus de différenciation une spécialisation indispensable à la fonction de la glande mammaire. Les cellules luminales ont un rôle structurant pour la glande, les cellules alvéolaires produisent et sécrètent le lait lors de la lactation, et les cellules myoépithéliales permettent la contraction des canaux pour expulser le lait vers le mamelon. Ces dernières, alignées le long de la membrane basale, servent aussi d’interface entre les cellules épithéliales et le stroma ou conjonctif palléal (ou conjonctif intra-lobulaire). L’étude des CSN épithéliales mammaires chez l’adulte connaît un véritable essor notamment grâce au modèle murin qui facilite la manipulation de ces cellules [
3] (→). Différentes combinaisons de marqueurs ont permis d’isoler une petite population de cellules capables de régénérer, in vivo, une glande mammaire adulte et fonctionnelle [
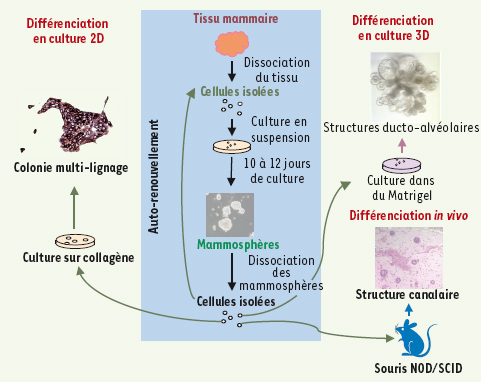
4]. L’étude des CSN mammaires humaines est plus difficile du fait de l’absence de consensus sur les techniques permettant de les isoler, les tests fonctionnels étant moins aisés. Cependant, quelques stratégies ont été développées afin d’étudier ces CSN chez la femme. En 2003, notre laboratoire a mis au point la technique dite des « mammosphères », qui permet de maintenir en culture en conditions non adhérentes et en l’absence de sérum, les CSN et progéniteurs mammaires humains dans un état indifférencié [
5]. Cette technique est décrite dans la Figure 2. En 2004, C. Kuperwasser a décrit la régénération d’une structure mammaire humaine dans le stroma graisseux dans lequel se développe normalement la glande murine, à partir de la transplantation chez la souris de fragments de glande mammaire humaine (xénogreffe de glande mammaire normale) [
6]. Ces études décrivent ainsi deux méthodes, in vitro et in vivo, pour l’étude des CSN mammaires épithéliales humaines chez l’adulte. (→)Voir l’ article de M.A. Deugnier et al., p. 1125 de ce numéro
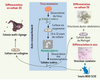 | Figure 2.
Les mammosphères : protocole expérimental et propriétés. Le protocole expérimental de formation des mammosphères se fonde sur la mise en culture des cellules épithéliales mammaires issues de mammoplasties en suspension, dans un milieu ne contenant pas de sérum et supplémenté en facteurs de croissance. Dans ces conditions, la majorité des cellules entre en apoptose et seul un petit nombre de cellules est capable de survivre et de proliférer pour former des sphéroïdes multicellulaires appelés mammosphères. Ces cellules présentent des propriétés de CSN. Elle sont capables de s’auto-renouveler en donnant des mammosphères de seconde génération contenant des cellules ayant les mêmes propriétés que les mammosphères primaires. Les cellules des mammosphères cultivées en 2D sur du collagène se différencient et donnent des colonies multi-lignages. Lorsqu’elles sont cultivées en 3D dans du Matrigel elles donnent naissance à des structures ducto-alvéolaires. Enfin, l’injection de ces cellules dans le coussin adipeux mammaire de souris immunodéficientes NOD/SCID permet de reconstituer une structure mammaire humaine. |
|
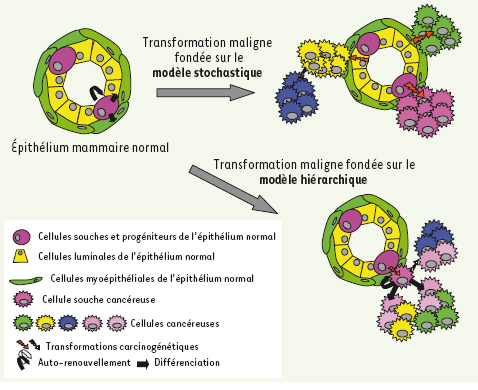
Le concept de cellule souche cancéreuse (CSC) et le modèle hiérarchique Deux modèles d’oncogenèse s’opposent [
7]. Dans le modèle stochastique, chaque cellule d’un tissu, même différenciée, peut, à la suite de l’accumulation de mutations acquises de façon aléatoire, proliférer de façon indéfinie et former un clone tumoral indépendant. Le second modèle, le modèle hiérarchique, considère la cellule souche cancéreuse comme le moteur de l’activité tumorigène du cancer. Les cellules d’une tumeur ont un potentiel de prolifération limité en dehors d’un petit nombre de cellules cancéreuses, les CSC, qui ont la capacité de proliférer de façon indéfinie et de donner naissance à toutes les autres cellules de la masse tumorale (Figure 3). Dans le cancer du sein, les CSC proviendraient directement des CSN adultes de l’épithélium mammaire qui seraient seules le siège des altérations génétiques tumorales (Figure 1B). De récents travaux effectués dans le système hématopoïétique ont montré que les progéniteurs précoces, descendants immédiats des CSN, pourraient aussi être les cibles des altérations oncogéniques et se comporter comme des CSC en ré-exprimant un programme d’auto-renouvellement [
8]. 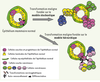 | Figure 3.
Deux modèles hypothétiques de la transformation maligne. Afin d’expliquer l’hétérogénéité tumorale régnant au sein d’une tumeur, deux hypothèses modélisant la transformation maligne ont été proposées. D’une part, le modèle stochastique dans lequel chaque cellule de l’épithélium mammaire peut être transformée et donner un clone tumoral composé de cellules qui ont toutes la capacité de proliférer de façon indéfinie et d’évoluer en réponse à l’accumulation de nouvelles altérations oncogéniques. D’autre part, le modèle hiérarchique dans lequel seule une cellule souche ou progénitrice peut être la cible de l’oncogenèse. Ainsi, seules les cellules souches cancéreuses vont proliférer de façon indéfinie et donneront naissance a l’hétérogénéité tumorale en contrôlant la différenciation. |
Ainsi, les propriétés caractéristiques des CSC vont être celles des CSN adultes, auto-renouvellement, longue durée de vie, capacité à reproduire l’hétérogénéité tissulaire, auxquelles s’ajoutent d’autres propriétés acquises à la suite des altérations génétiques, comme la prolifération continue et l’autonomie vis-à-vis de la « niche » environnementale dans laquelle se développent les cellules souches. L’auto-renouvellement (intrinsèque ou acquis dans le cas des progéniteurs) est un élément clé lors de l’initiation de l’oncogenèse où l’expansion des CSC permettra de former le pool initial de la tumeur. La capacité à se différencier des cellules issues de CSC peut être moins aboutie que dans le tissu normal. Elle dépend probablement à la fois du type de cellule transformée (CSN ou progéniteur), du type d’altérations génétiques subies, et des interactions restantes avec la « niche ». Ces variations expliquent l’hétérogénéité phénotypique que l’on retrouve dans les carcinomes mammaires. Au total, les CSC diffèrent des CSN par plusieurs critères inhérents à la transformation cancéreuse comme la prolifération anarchique guidée par des dysfonctionnements du programme d’auto-renouvellement, et une différenciation partielle et anormale. D’autres propriétés généralement attribuées aux CSN sont au contraire conservées dans les CSC. Ces propriétés incluent l’expression de l’activité télomèrase, l’activation de voies de signalisation anti-apoptotiques, la possibilité d’entrer en phase de quiescence, l’augmentation de l’activité des transporteurs membranaires, des capacités de migration cellulaire, de survie en l’absence d’adhérence à un substrat, et de résistance à l’hypoxie [
9]. Autant de propriétés qui vont donner aux CSC la possibilité de former des métastases et de résister aux traitements anti-tumoraux actuels. Les études de Balic et al. et celles de Sheridan et al. ont notamment illustré le potentiel métastatique des CSC mammaires en montrant leurs propriétés accrues d’invasivité, et la présence de CSC épithéliales dans la circulation sanguine de patientes atteintes de cancer du sein, [
10,
11]. La résistance des CSC aux traitements actuels qui ciblent essentiellement des cellules en cycle, et les récidives qui en découlent, modifient notre vision de la prise en charge des patientes atteintes d’un cancer du sein. |
Les cellules souches cancéreuses mammaires Des cellules cancéreuses ayant des propriétés de cellules souches pourraient être à l’origine de nombreux types de cancers. Les premières CSC ont été mises en évidence dans les leucémies il y a une dizaine d’années [
12] mais ce n’est que plus récemment que des CSC ont été isolées dans les tumeurs solides. Ces CSC ont été identifiées et isolées dans une très grande variété de néoplasies comme les tumeurs du système nerveux, les carcinomes de la prostate, du sein, et du côlon, les mélanomes, les myélomes multiples, les adénocarcinomes du pancréas, et les cancers ORL [
13–
21]. Les méthodes permettant d’isoler les CSC utilisent deux principes différents, selon qu’elles se fondent sur des propriétés intrinsèques des cellules souches, communes quelle que soit la pathologie considérée, ou sur l’expression de marqueurs de surface spécifiques, comportant souvent une spécificité d’organe et d’espèce. Associés à ces méthodes, des tests prouvant la tumorigénicité des fractions de cellules isolées permettent de confirmer la présence de CSC. |
Isolement d’une population dite Side Population
Une des méthodes les plus répandues et les plus anciennes utilisée pour isoler des CSC est la technique isolant une population appelée Side Population ou population SP. Elle repose sur la surexpression de pompes transmembranaires par les CSC (comme ABCG2/BCRP1 pour ATP-binding cassettes/breast cancer resistance protein). Ces pompes permettent d’exclure diverses substances pénétrant dans la cellule [
22]. L’incubation de cellules cancéreuses en présence de colorants vitaux tels que le Hoechst 33342 permet de distinguer les cellules différenciées gorgées de colorant des CSC qui rejettent le colorant. Une population SP a été trouvée dans la lignée cellulaire humaine de cancer du sein MCF-7 [
23]. La population SP ne représente que 2 % de la population totale mais est la seule à former une tumeur lorsqu’ elle est injectée chez la souris NOD/SCID en reconstituant l’hétérogénéité initiale de la lignée MCF-7 [23,
24]. |
Le phénotype CD44 +CD24 -/lowlin -
Un seul phénotype de CSC mammaire humaine a été décrit [
15]. Ce phénotype est fondé sur l’expression de marqueurs de surface et défini par l’expression de CD44 et l’absence ou la faible expression de CD24 (CD44+CD24-/faiblelin-)1. Cette population a été isolée à partir de tumeurs humaines xénogreffées dans le modèle murin NOD/SCID au niveau du coussin adipeux mammaire amputé de son rudiment épithélial et humanisé par la présence de fibroblastes humains. Un tout petit nombre (200) de ces cellules cancéreuses CD44+CD24-/faiblelin-, qui ne représentent que 1 % à 10 % de la tumeur, forment une tumeur après injection alors que 20 000 cellules ne possédant pas ce phénotype en sont incapables. Les tumeurs ainsi formées reproduisent l’hétérogénéité phénotypique décrite dans la tumeur d’origine et la population CD44+CD24-/faiblelin- peut être transplantée à nouveau dans différents animaux. Ces manipulations montrent les capacités d’autorenouvellement et de différenciation de la population CD44+CD24-/faiblelin- et donc la présence de CSC. |
L’aldéhyde déshydrogénase Une nouvelle méthode permettant d’isoler les CSC de cancers du sein utilise l’expression d’une forte activité enzymatique de l’ALDH (aldéhyde déshydrogénase) [
25]. Cette enzyme intervient dans le métabolisme de l’acide rétinoïque et joue un rôle dans le contrôle de la différenciation cellulaire. Cette activité peut être mesurée et utilisée pour isoler les cellules la possédant, en utilisant un kit commercial (kit ALDEFLUOR, Stem cell technologies). Ce kit contient un substrat fluorescent spécifique de l’ALDH (BAAA) qui permet discriminer les cellules exprimant l’activité enzymatique, qui sont fluorescentes (ALDEFLUOR-positives), et les cellules n’exprimant pas cette activité, qui ne sont pas (ou peu) fluorescentes. Cette technique a déjà été utilisée afin d’isoler les CSC dans des pathologies aussi diverses que les leucémies ou le myélome multiple [
26]. Dans le cas du cancer du sein, nous avons démontré que seules les cellules ALDEFLUOR-positives issues de tumeurs humaines et greffées dans la souris NOD/SCID sont tumorigènes et reconstituent l’hétérogénéité de la tumeur initiale, ce qui reflète les capacités d’auto-renouvellement et de différenciation de ces cellules. Tous ces phénotypes permettent d’isoler des populations enrichies en CSC et sont indispensables à l’étude du rôle joué par ce petit nombre de cellules dans la croissance et l’évolution d’une tumeur. Les problèmes majeurs de l’étude de ces cellules reste leur faible représentation dans chaque tumeur et la difficulté de leur culture. |
Afin d’amplifier ces cellules in vitro en les gardant dans un état indifférencié, Ponti et al. ont adapté la technique des mammosphères à la propagation des tumorosphères [
27]. Tout comme leurs équivalents de l’épithélium normal sont enrichis en CSN, les tumorosphères sont enrichies en CSC, ce que traduit la présence au sein des tumorosphères d’une population SP importante, et d’un enrichissement en cellules CD44+CD24-/faiblelin-. Ces différentes méthodes sont encore balbutiantes, mais ouvrent des perspectives pour l’étude des CSC et pour la prise en charge thérapeutique des patientes atteintes de cancer du sein. |
Les CSC à la base des résistances thérapeutiques ? Si les CSC sont au cœur du processus d’oncogenèse et de métastase, elles sont certainement aussi à l’origine d’un des mécanismes majeurs de la résistance thérapeutique et de la récidive [7]. Même si, de manière générale, les stratégies de prise en charge thérapeutique ont prouvé leur efficacité (chirurgie, radiothérapie, chimiothérapie) dans le cancer du sein, un certain ralentissement de la courbe de survie malgré l’avènement de thérapies nouvelles peut suggérer l’existence d’une population cellulaire qui n’est pas sensible à ces traitements ou y échappe. Par ailleurs, il n’existe pas de traitement curatif en phase métastatique. |
Pourquoi les CSC seraient-elles résistantes aux traitements usuels ? Tout d’abord, ces cellules expriment de manière intrinsèque de nombreuses molécules qui les rendent résistantes aux chimiothérapies, certaines étant même utilisées pour les isoler comme les transporteurs membranaires responsables de l’efflux du Hoeschst (technique de Side Population). Bloquer ces pompes avec des inhibiteurs spécifiques pourrait être une perspective thérapeutique intéressante, mais les essais cliniques se heurtent à des difficultés pratiques. D’une part, une toxicité importante, car ces molécules peuvent être très exprimées dans le tissu normal et pas seulement par les CSC. D’autre part, des variations dans la pharmacocinétique des drogues liées à la présence de polymorphismes particuliers, dans le gène ABCG2 notamment [
28]. La résistance aux chimiothérapies classiques est aussi liée à une caractéristique essentielle des cellules souches, leur capacité d’entrer en quiescence. Les CSC conservent une quiescence relative par rapport aux progéniteurs et aux cellules plus différenciées du reste de la tumeur. Cela les rend moins accessibles aux drogues anti-cancéreuses anti-mitotiques qui ciblent des cellules en division. La radiothérapie utilise les radiations ionisantes pour créer des lésions irréparables de l’ADN et arrêter la croissance des cellules qui ne se divisent plus et meurent. Très largement utilisée dans le traitement des cancers, elle l’est particulièrement dans les tumeurs cérébrales et les cancers du sein. Les études sur les glioblastomes permettent de penser que les CSC identifiées sur la base de l’expression de l’antigène de surface CD133 (prominine) résisteraient aussi à l’irradiation par l’intermédiaire de protéines régulatrices des points de contrôle du cycle cellulaire comme CHK1 et CHK2 [
29,
30]. Dans les cancers du sein, des cellules ayant un phénotype de CSC seraient relativement résistantes à la radiothérapie, comme en témoigne une étude récente effectuée à partir de lignées cellulaires [
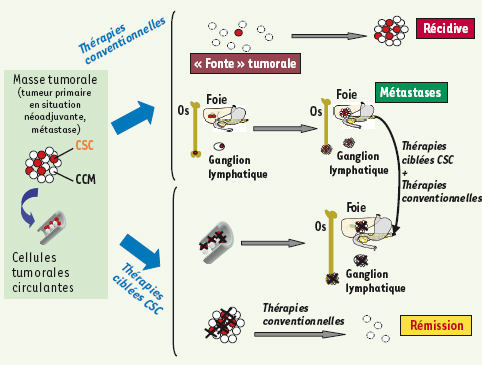
31]. La récidive tumorale peut survenir après une phase initiale de réponse thérapeutique avec régression tumorale ou même disparition totale de la tumeur. Elle pourrait être liée au fait que les thérapies utilisées ne ciblent pas les CSC. Ces cellules persistant, même en très petit nombre, peuvent proliférer à nouveau et reconstituer la tumeur dans toute sa diversité phénotypique [7] (Figure 4). 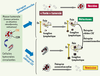 | Figure 4.
L’hypothèse de la cellule souche cancéreuse face aux thérapies. Si l’on considère que le modèle hiérarchique décrit la réalité de la transformation maligne et de l’évolution tumorale, il faut alors repenser les effets des thérapies conventionnelles pour le traitement du cancer. Ces thérapies induisent la fonte tumorale en ciblant les cellules de la masse tumorale (cellules cancéreuses matures, CCM) (qui sont en cycle) mais ne détruisent pas les cellules souches cancéreuses (CSC) qui résistent aux traitements et sont à l’origine des récidives ou des métastases. Des thérapies spécifiques ciblant les CSC permettraient d’éliminer le pool de CSC présentes dans la masse tumorale en situation primaire (chimiothérapie néoadjuvante) et les CSC micrométastatiques ou présentes dans les métastases constituées. Ces thérapies, associées aux thérapies conventionnelles, permettraient d’induire une rémission complète chez les patients grâce à l’élimination de l’ensemble des cellules de la masse tumorale en situation primaire comme métastatique. |
|
Vers une thérapie ciblant les cellules souches cancéreuses Cibler les CSC pourrait donc représenter un enjeu majeur dans le traitement des cancers du sein. Quelques exemples existent déjà dans d’autres pathologies, et ouvrent la voie à des thérapies ciblées sur des propriétés spécifiques des cellules souches, auto-renouvellement ou différenciation. La voie de signalisation Hedgehog est largement impliquée dans l’auto-renouvellement des cellules souches et est également activée dans de nombreuses tumeurs. Dans les tumeurs gliales, elle est indispensable à l’auto-renouvellement des CSC exprimant CD133. Son inhibition par interférence ARN (via la transfection de vecteurs lentiviraux) ou par un inhibiteur spécifique, la cyclopamine, est efficace sur la croissance et l’auto-renouvellement des tumeurs gliales dans un modèle de xénogreffes en comparaison d’ un traitement de référence [
32]. La voie de signalisation NOTCH est également impliquée dans de nombreuses tumeurs dont les tumeurs mammaires. Elle intervient dans l’auto-renouvellement des cellules souches et bloque leur différenciation. Des inhibiteurs de l’ activation des protéines NOTCH, les inhibiteurs de γ-sécrétases, ont montré leur efficacité sur la baisse du taux de prolifération et sur l’altération de la différenciation des cellules souches mésenchymateuses [
33]. Associées à des anticorps neutralisants, ces drogues ont montré leur effet inhibiteur sur la capacité des CSC à former des « tumorosphères » [
34]. Certaines stratégies thérapeutiques consistent à forcer la différenciation qui est bloquée dans certaines tumeurs. Ce blocage peut concerner une part plus ou moins importante des cellules tumorales comme c’est le cas dans un type particulier de leucémie aiguë myéloïde (LAM3) où les cellules leucémiques non différenciées s’accumulent dans la moelle osseuse. Dans ce cas, la différenciation est forcée par l’administration d’acide tout-trans-rétinoïque (ATRA), et cette molécule, associée à une chimiothérapie, a montré son efficacité en termes de survie sans récidive [
35]. Malgré de nombreuses études démontrant le potentiel anti-cancéreux des rétinoïdes dans les tumeurs solides et dans le cancer du sein notamment [
36,
37], les résultats des essais cliniques se sont révélé décevants [
38]. L’administration d’ATRA dans les tumeurs solides se heurte à des phénomènes de résistances complexes [
39]. De nouvelles thérapeutiques combinées utilisant des agents bloquants du métabolisme de l’acide rétinoïque pourraient se révéler prometteuses [38]. Enfin, une stratégie pour cibler les CSC en thérapeutique pourrait être d’utiliser des marqueurs spécifiques de ces CSC. Dans la leucémie aiguë myéloïde, l’administration d’un anticorps monoclonal anti-CD44 a prouvé son efficacité dans la réduction du pool de cellules souches leucémiques dans un modèle de xénogreffes chez la souris NOD/SCID [
40]. Cette stratégie pourrait s’avérer efficace dans le cancer du sein. Les cellules tumorales disséminées dans la moelle osseuse (micrométastases) de patientes porteuses d’un cancer du sein non métastatique ont en grande partie un phénotype de CSC CD44+/CD24- [10]. Cibler ces CSC pourrait être une stratégie innovante et constituer une perspective intéressante des thérapies ciblées. Celles-ci ne cibleraient plus un type particulier de tumeur mais un type particulier de cellules tumorales. Stratégie classique et stratégie anti-CSC pourraient être complémentaires. C’est ce que suggèrent les études concernant la résistance à l’une des premières thérapies ciblées, l’Herceptin® (Trastuzumab), un anticorps monoclonal humanisé ciblant une population tumorale surexprimant l’oncoprotéine ERBB2. La résistance à cette thérapeutique pourrait être au moins en partie conférée par un défaut de la voie PTEN (phosphatase and tensin homolog). Cette voie est importante pour l’auto-renouvellement des CSN et son inactivation conduit à une expansion de la population de cellules souches dans le système hématopoïétique ou intestinal [
41,
42]. Cette expansion pourrait être à l’origine de la résistance thérapeutique. Des modulateurs de l’inactivation de la voie PTEN comme les inhibiteurs des PI3-kinases pourraient forcer la résistance à l’Herceptin® [
43]. Enfin, l’étude des CSC, facilitée par les nouvelles techniques d’isolement et de caractérisation cellulaires, permettra sans doute de mettre à jour de nouvelles cibles thérapeutiques spécifiques des CSC et de développer ainsi de nouvelles drogues plus efficaces pour lutter contre le cancer du sein. |
Cette idée ancienne [
44], énoncée il y a 150 ans, selon laquelle une population rare de cellules pourrait piloter l’ensemble de la masse tumorale, tend à être prouvée par les études de ces dernières années. L’existence des cellules souches cancéreuses va modifier considérablement, à différents niveaux, la compréhension physiopathogénique du cancer mais aussi la prise en charge thérapeutique des patientes. Tout d’abord, au niveau de la compréhension de l’origine du cancer et de la transformation maligne, avec des implications concrètes pour la détection précoce de la maladie et sa prévention. Ensuite, au niveau de l’évolution du cancer et notamment des phénomènes de résistance aux traitements, débouchant sur de nouvelles perspectives thérapeutiques plus ciblées sur la cellule responsable de la maladie. Enfin, au niveau de la propagation de la maladie, en éclairant d’un jour nouveau le processus métastatique afin de pouvoir en améliorer la détection et le traitement. |
Footnotes |
1. Birnbaum D, Bertucci F, Ginestier C, et al. Basal and luminal breast cancers: basic or luminous ? Int J Oncol 2004; 25 : 249–58. 2. Smith GH. Label-retaining epithelial cells in mouse mammary gland divide asymmetrically and retain their template DNA strands. Development 2005; 132 : 681–7. 3. Deugnier MA, Petit V, Taddei de la Housseraye I, et al. Vers la caractérisation des cellules souches de la glande mammaire adulte. Med Sci (Paris) 2007; 23 : 1125–32. 4. Shackleton M, Vaillant F, Simpson KJ, et al. Generation of a functional mammary gland from a single stem cell. Nature 2006; 439 : 84–8. 5. Dontu G, Abdallah WM, Foley JM, et al.
In vitro propagation and transcriptional profiling of human mammary stem/progenitor cells. Genes Dev 2003; 17 : 1253–70. 6. Kuperwasser C, Chavarria T, Wu M, et al. Reconstruction of functionally normal and malignant human breast tissues in mice. Proc Natl Acad Sci USA 2004; 101 : 4966–71. 7. Reya T, Morrison SJ, Clarke MF, Weissman IL. Stem cells, cancer, and cancer stem cells. Nature 2001; 414 : 105–11. 8. Krivtsov AV, Twomey D, Feng Z, et al. Transformation from committed progenitor to leukaemia stem cell initiated by MLL-AF9. Nature 2006; 442 : 818–822. 9. Wicha MS, Liu S, Dontu G. Cancer stem cells: an old idea: a paradigm shift. Cancer Res 2006; 66 : 1883–90. 10. Balic M, Lin H, Young L, et al. Most early disseminated cancer cells detected in bone marrow of breast cancer patients have a putative breast cancer stem cell phenotype. Clin Cancer Res 2006; 12 : 5615–21. 11. Sheridan C, Kishimoto H, Fuchs RK, et al. CD44+/. Breast Cancer Res 2006; 8 : R59. 12. Bonnet D, Dick JE. Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell. Nat Med 1997; 3 : 730–7. 13. Li C, Heidt DG, Dalerba P, et al. Identification of pancreatic cancer stem cells. Cancer Res 2007; 67 : 1030–7. 14. Prince ME, Sivanandan R, Kaczorowski A, et al. Identification of a subpopulation of cells with cancer stem cell properties in head and neck squamous cell carcinoma. Proc Natl Acad Sci USA 2007; 104 : 973–8. 15. Al-Hajj M, Wicha MS, ito-Hernandez A, et al. Prospective identification of tumorigenic breast cancer cells. Proc Natl Acad Sci USA 2003; 100 : 3983–3988. 16. Collins AT, Berry PA, Hyde C, et al. Prospective identification of tumorigenic prostate cancer stem cells. Cancer Res 2005; 65 : 10946–51. 17. Fang D, Nguyen TK, Leishear K, et al. A tumorigenic subpopulation with stem cell properties in melanomas. Cancer Res 2005; 65 : 9328–37. 18. Matsui W, Huff CA, Wang Q, et al. Characterization of clonogenic multiple myeloma cells. Blood 2004; 103 : 2332–6. 19. O’Brien CA, Pollett A, Gallinger S, Dick JE. A human colon cancer cell capable of initiating tumour growth in immunodeficient mice. Nature 2007; 445 : 106–10. 20. Ricci-Vitiani L, Lombardi DG, Pilozzi E, et al. Identification and expansion of human colon-cancer-initiating cells. Nature 2007; 445 : 111–5. 21. Singh SK, Clarke ID, Terasaki M, et al. Identification of a cancer stem cell in human brain tumors. Cancer Res 2003; 63 : 5821–8. 22. Lou H, Dean M. Targeted therapy for cancer stem cells: the patched pathway and ABC transporters. Oncogene 2007; 26 : 1357–60. 23. Kondo T, Setoguchi T, Taga T. Persistence of a small subpopulation of cancer stem-like cells in the C6 glioma cell line. Proc Natl Acad Sci USA 2004; 101 : 781–6. 24. Patrawala L, Calhoun T, Schneider-Broussard R, et al. Side population is enriched in tumorigenic, stem-like cancer cells, whereas ABCG2+ and ABCG2-cancer cells are similarly tumorigenic. Cancer Res 2005; 65 : 6207–19. 25. Ginestier C, Hur MH, Charaffe-Jauffret E, et al. ALDH1 is a marker of normal and malignant human mammary stem cells and a predictor of poor clinical outcome. Cell Stem Cell 2007; 1 : 555–67. 26. Corti S, Locatelli F, Papadimitriou D, et al. Identification of a primitive brain-derived neural stem cell population based on aldehyde dehydrogenase activity. Stem Cells 2006; 24 : 975–85. 27. Ponti D, Costa A, Zaffaroni N, et al. Isolation and in vitro propagation of tumorigenic breast cancer cells with stem/progenitor cell properties. Cancer Res 2005; 65 : 5506–11. 28. Robey RW, Polgar O, Deeken J, et al. ABCG2: determining its relevance in clinical drug resistance. Cancer Metastasis Rev 2007; 26 : 39–57. 29. Bao S, Wu Q, McLendon RE, et al. Glioma stem cells promote radioresistance by preferential activation of the DNA damage response. Nature 2006; 444 : 756–60. 30. Hambardzumyan D, Squatrito M, Holland EC. Radiation resistance and stem-like cells in brain tumors. Cancer Cell 2006; 10 : 454–6. 31. Phillips TM, McBride WH, Pajonk F. The response of CD24 (-/low)/CD44+ breast cancer-initiating cells to radiation. J Natl Cancer Inst 2006; 98 : 1777–85. 32. Clement V, Sanchez P, de TN, et al. HEDGEHOG-GLI1 signaling regulates human glioma growth, cancer stem cell self-renewal, and tumorigenicity. Curr Biol 2007; 17 : 165–72. 33. Vujovic S, Henderson SR, Flanagan AM, Clements MO. Inhibition of gamma-secretases alters both proliferation and differentiation of mesenchymal stem cells. Cell Prolif 2007; 40 : 185–95. 34. Farnie G, Clarke RB, Spence K, et al. Novel cell culture technique for primary ductal carcinoma in situ: role of Notch and epidermal growth factor receptor signaling pathways. J Natl Cancer Inst 2007; 99 : 616–27. 35. Tallman MS, Nabhan C, Feusner JH, Rowe JM. Acute promyelocytic leukemia: evolving therapeutic strategies. Blood 2002; 99 : 759–67. 36. Van HJ, Van GR, Bruwiere H, et al. Inhibition of all-TRANS-retinoic acid metabolism by R116010 induces antitumour activity. Br J Cancer 2002; 86 : 605–11. 37. Wouters W, van DJ, Dillen A, et al. Effects of liarozole, a new antitumoral compound, on retinoic acid-induced inhibition of cell growth and on retinoic acid metabolism in MCF-7 human breast cancer cells. Cancer Res 1992; 52 : 2841–6. 38. Patel JB, Mehta J, Belosay A, et al. Novel retinoic acid metabolism blocking agents have potent inhibitory activities on human breast cancer cells and tumour growth. Br J Cancer 2007; 96 : 1204–15. 39. Parisotto M, Brodeur H, Bhat PV, Mader S. Retinoid metabolism and cancer. Med Sci (Paris) 2006; 22 : 1101–6. 40. Jin L, Hope KJ, Zhai Q, et al. Targeting of CD44 eradicates human acute myeloid leukemic stem cells. Nat Med 2006; 12 : 1167–74. 41. Cheung AM, Mak TW. PTEN in the haematopoietic system and its therapeutic indications. Trends Mol Med 2006; 12 : 503–5. 42. He XC, Yin T, Grindley JC, et al. PTEN-deficient intestinal stem cells initiate intestinal polyposis. Nat Genet 2007; 39 : 189–98. 43. Nagata Y, Lan KH, Zhou X, et al. PTEN activation contributes to tumor inhibition by trastuzumab, and loss of PTEN predicts trastuzumab resistance in patients. Cancer Cell 2004; 6 : 117–27. 44. Durante F. Nesso fisio-pathologico tra la struttura dei nei materni e la genesi di alcuni tumori maligni. Arch Memor Observ Chir Pract 1874; 11 : 217–26. |