| |
| Med Sci (Paris). 2007 December; 23(12): 1091–1094. Published online 2007 December 15. doi: 10.1051/medsci/200723121091.Métabonomique et cartographie génétique Dominique Gauguier1,2* and Marc-Emmanuel Dumas3,4* 1Wellcome Trust Centre for Human Genetics, Université d’Oxford, Oxford OX3 7BN, Royaume-Uni. 2Inserm U561, Hôpital Saint-Vincent de Paul, 82, avenue Denfert Rochereau, 75014 Paris, France. 3Imperial College London, Département de Médecine Biomoléculaire, Londres SW7 2AZ, Royaume-Uni. 4École Normale Supérieure de Lyon, Centre de RMN à Très Hauts Champs FRE 3008, Laboratoire de Chimie UMR 5182, 46, allée d’Italie, 69364 Lyon cedex 7, France. MeSH keywords: Cartographie chromosomique, Fréquence d'allèle, Génomique, Humains, Hyperglycémie, Hypertension artérielle, Métabolisme |
L’étude des déterminants génétiques des maladies complexes, particulièrement le diabète, l’obésité, l’hypertension artérielle et l’asthme, connaît un essor toujours croissant, qui reflète l’augmentation de la prévalence de ces maladies dans la population générale. Leur succès incontestable est démontré par la localisation chromosomique de nombreux locus de prédisposition et, dans un nombre de cas, l’identification des gènes responsables [
1,
2,
14]. Ces études illustrent le progrès des technologies de génotypage et, paradoxalement, les difficultés du phénotypage des patients et des contrôles qui, pour des raisons éthiques ou pragmatiques, emploie des traits pathologiques souvent simples, par exemple l’hyperglycémie ou l’hypertension. Les outils de phénotypage à haut débit, parmi lesquels les technologies de génomique fonctionnelle, permettant d’étudier la régulation de l’expression du génome, peuvent jouer un rôle prépondérant dans la caractérisation du contrôle génétique de marqueurs prédictifs de maladies complexes. Le transcriptome a été appliqué aux études de liaison génétique chez l’homme et dans les modèles animaux [
3], mais l’effet physiopathologique de modifications transcriptionnelles est difficile à établir. En revanche, les changements métaboliques qualitatifs ou quantitatifs sont un reflet plus direct d’une pathologie telle que le diabète, dans laquelle le développement de l’hyperglycémie implique des anomalies de l’expression de gènes dans de nombreux organes (pancréas endocrine, foie, tissu adipeux, muscle) que le transcriptome ne peut interroger qu’individuellement. |
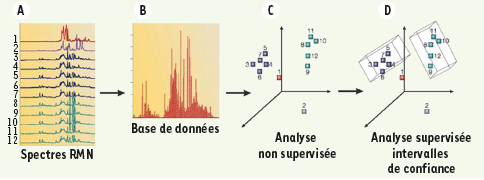
La « métabonomique » produit des phénotypes métaboliques utilisables en génétique quantitative Dans une expérience typique de métabonomique [
4] (Figure 1), la spectroscopie de résonance magnétique nucléaire (RMN) ou la spectroscopie de masse produit des profils métaboliques afin de mesurer sans hypothèse a priori les métabolites de faible poids moléculaire dans des échantillons biologiques. L’information contenue dans ces spectres à haute résolution est alors analysée par des modèles chimiométriques1 afin d’identifier les molécules associées aux caractéristiques physiopathologiques ou à une réponse à un traitement [
5,
6]. L’utilisation de ces informations dans le contexte d’une étude génétique revêt une importance particulière pour sélectionner des marqueurs de prédisposition. Ce type d’étude a été entrepris chez des rats hybrides F2 après le croisement de rats spontanément diabétiques de la souche Goto-Kakizaki (GK) et de contrôles de la souche Brown Norway (BN), qui montrent des divergences phénotypiques importantes [
7]. Les spectres de RMN du plasma sanguin de chacun des 123 rats F2 ont été analysés de manière à produire 38 724 signaux quantitatifs à partir du spectre de chaque animal pour l’étude de liaison génétique.  | Figure 1.
Approche métabonomique classique. La métabonomique est une méthodologie intégrant plusieurs techniques analytiques et statistiques afin de détecter des variations liées à l’exposition à une substance à partir d’échantillons biologiques analysés par RMN ou par spectrométrie de masse. Après acquisition des spectres RMN caractérisant les échantillons, les données des spectres (A) sont importées dans une base de données (B), l’information spectrale est ensuite résumée à l’aide de modèles multidimensionnels tels que l’analyse par composantes principales ou à l’aide d’arbres hiérarchiques (C), puis des modèles statistiques, tels que des réseaux de neurones, l’analyse discriminante, ou la régression PLS (moindres carrés partiels), sont développés pour déterminer des biomarqueurs statistiquement significatifs (D) (d’après [ 4]). |
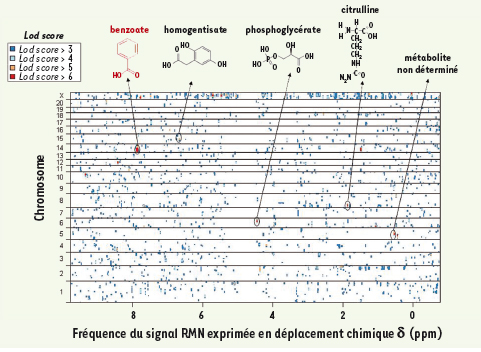
Les analyses statistiques de liaison génétique utilisant l’approche des « quantitative trait loci » (QTL) ont identifié plus de 2 000 QTL (LOD > 3) associés à des variations d’abondance de métabolites (Figure 2) [7]. Des effets pléïotropiques, polygéniques ou épistatiques du contrôle de certains QTL illustrent la complexité des mécanismes de régulation métabolique. Plus puissante que la génétique du transcriptome qui renseigne sur le taux de transcrits de séquences connues, l’approche systématique de l’analyse des spectres RMN offre l’avantage d’étendre l’étude génétique à tous les métabolites de l’échantillon. L’interprétation moléculaire des signaux de RMN fait appel à des méthodes chimiométriques complexes qui ont permis de proposer un ou plusieurs métabolites pour chacun des 197 QTL les plus significatifs (LOD > 4,3) [7].  | Figure 2.
Cartographie génétique de variables métabonomiques dans le croisement F2 (GKxBN). Les analyses statistiques de liaison génétique sont basées sur l’utilisation de deux programmes (QTL Reaper et R/qtl) et l’application de 1 000 (R/qtl) et 10 000 (QTL Reaper) tests de permutation. La fréquence dans le spectre RMN (δ, ppm) est le long de l’axe horizontal. La position chromosomique (cM) est reportée sur l’axe vertical. La couleur de chaque QTL indique la significativité statistique de la liaison génétique entre génotype et signal métabonomique. Les composés chimiques illustrent les métabolites candidats proposés pour des QTL) (adaptée de [ 7]). |
|
Gènes candidats pour le contrôle de traits métabonomiques Une fois effectuée l’annotation métabolique des QTL, une relation de cause à effet entre métabolites et gènes candidats au locus peut être recherchée grâce aux informations génomiques du QTL et aux outils de génomique fonctionnelle interrogeant d’autres niveaux d’expression des gènes (transcriptome, protéome). Le locus associé au signal RMN δ7.86 correspondant au benzoate (δ7,86, LOD = 13,7) (Figure 2) contient plusieurs gènes codant pour des UDP-glucuronosyl transférases qui conjuguent le benzoate en acide glucuronique dans le foie. Des données de transcriptome hépatique et de séquençage démontrent que l’expression très réduite de l’un de ces gènes (Ugt2b) chez le rat GK, explicable par la délétion d’une portion du gène, peut rendre compte de l’accumulation de benzoate identifiée par liaison génétique [7]. Cette stratégie est applicable aux autres QTL et les modèles congéniques décrits plus loin sont des outils efficaces de validation. |
Influences métagénomiques Un résultat important de l’étude génétique du métabolome est la détection de QTL pour des produits du métabolisme bactérien [7], par exemple le benzoate, dont les variations de concentration suggèrent des changements qualitatifs ou quantitatifs de la flore microbienne qui ségrégent dans la population F2. Les interactions symbiotiques entre microflore intestinale et les mécanismes physiologiques et pathologiques chez les Mammifères sont au centre du concept de métagénome et des interactions transgénomiques [
8]. Des études récentes suggèrent une relation entre la composition de la flore microbienne et l’obésité d’une part [
9], et des anomalies hépatiques de l’insulinorésistance d’autre part [
10]. Ces observations soulignent l’importance de l’analyse exhaustive de signaux de spectres RMN, de manière à étendre le champ d’investigations génétiques à l’ensemble des métabolites présents dans un échantillon biologique. |
Validation des QTL métabonomiques et impact physiopathologique L’utilisation d’autres systèmes expérimentaux est nécessaire pour valider les résultats des études génétiques, interpréter les signaux de RMN et, dans le cas de co-localisation de QTL liés à des métabolites et des traits physiopathologiques (hyperglycémie, obésité) [
11,
12], tester l’impact possible de la voie métabolique concernée sur ces phénotypes. Les souches congéniques, qui contiennent une région chromosomique d’un QTL transférée d’une souche sur un autre fond génétique, sont des modèles de choix pour ces études phénotypiques approfondies [
13]. Des expériences chez des souches congéniques, qui portent des QTL du rat GK sur un fond génétique BN, confirment la nature de métabolites associés à des QTL détectés dans le croisement F2 (glucose, glutamate, proline, tyrosine), et démontrent la robustesse de la stratégie d’étude génétique de traits métabonomiques. L’impact de certaines variations métaboliques sur la pathologie diabétique reste à établir. |
Les approches métabonomiques produisent une masse considérable d’informations phénotypiques applicables à la cartographie génétique. Leur utilisation en génétique humaine dans des études longitudinales de cas contrôles pourrait mettre en évidence des biomarqueurs prédictifs de l’apparition de maladies. Dans cette optique, les atouts majeurs des études métabonomiques sont leur caractère non invasif, le volume important de données interprétables sur chaque spectre RMN et la pertinence des traits métaboliques pour des maladies telles que le diabète et l’obésité. En outre, cette approche ouvre des perspectives importantes pour tester le fondement génétique de mécanismes de transgénomique et leur implication dans des pathologies humaines. |
Wellcome Functional Genomics Initiatives BAIR (Biological Atlas of Insulin Resistance ; 066786) et CFG (Cardiovascular Functional Genomics ; 066780), contrat FGENTCARD (Functional genomic diagnostic tools for coronary artery disease ; LSHG-CT-2006-037683) de la Communauté Européenne. D.G. est Professeur de Génétique des Mammifères à l’Université d’Oxford et financé par un Senior Fellowship du Wellcome Trust (057733).
|
Footnotes |
1. Wellcome Trust Case Control Consortium. Genome-wide association study of 14,000 cases of seven common diseases and 3,000 shared controls. Nature 2007; 447 : 661–78. 2. Frayling TM, Timpson NJ, Weedon MN, et al. A common variant in the FTO gene is associated with body mass index and predisposes to childhood and adult obesity. Science 2007; 316 : 889–94. 3. Schadt EE, Monks SA, Drake TA, et al. Genetics of gene expression surveyed in maize, mouse and man. Nature 2003; 422 : 297–302. 4. Nicholson JK, Connelly J, Lindon JC, Holmes E. Metabonomics: a platform for studying drug toxicity and gene function. Nat Rev Drug Discov 2002; 1 : 153–61. 5. Clayton TA, Lindon JC, Cloarec O, et al. Pharmaco-metabonomic phenotyping and personalized drug treatment. Nature 2006; 440 : 1073–7. 6. Brindle JT, Antti H, Holmes E, et al. Rapid and noninvasive diagnosis of the presence and severity of coronary heart disease using 1H-NMR-based metabonomics. Nat Med 2002; 8 : 1439–44. 7. Dumas ME, Wilder SP, Bihoreau MT, et al. Direct quantitative trait locus mapping of mammalian metabolic phenotypes in diabetic and normoglycemic rat models. Nat Genet 2007; 39 : 666–72. 8. Nicholson JK, Holmes E, Wilson ID. Gut microorganisms, mammalian metabolism and personalized health care. Nat Rev Microbiol 2005; 3 : 431–8. 9. Turnbaugh PJ, Ley RE, Mahowald MA, et al. An obesity-associated gut microbiome with increased capacity for energy harvest. Nature 2006; 444 : 1027–31. 10. Dumas ME, Barton RH, Toye A, et al. Metabolic profiling reveals a contribution of gut microbiota to fatty liver phenotype in insulin-resistant mice. Proc Natl Acad Sci USA 2006; 103 : 12511–6. 11. Gauguier D, Froguel P, Parent V, et al. Chromosomal mapping of genetic loci associated with non-insulin dependent diabetes in the GK rat. Nat Genet 1996; 12 : 38–43. 12. Argoud K, Wilder SP, McAteer MA, et al. Genetic control of plasma lipid levels in a cross derived from normoglycaemic Brown Norway and spontaneously diabetic Goto-Kakizaki rats. Diabetologia 2006; 49 : 2679–88. 13. Rogner UC, Avner P. Congenic mice: cutting tools for complex immune disorders. Nat Rev Immunol 2003; 3 : 243–52. 14. Gilgamesh S, Kaprank JC. La compassion et le chacun-pour-soi : deux volets d’un même QTL. Med Sci (Paris) : 2007; 23 : 445–6. |