| |
| Med Sci (Paris). 2007 December; 23(12): 1077–1080. Published online 2007 December 15. doi: 10.1051/medsci/200723121077.Cellules souches et progéniteurs dans la glande mammaire : rôle critique du facteur de transcription Gata-3 Marie-Liesse Asselin-Labat* The Walter and Eliza Hall Institute of Medical Research, Victorian Breast Cancer Research Consortium, 1G Royal Parade, Parkville, VIC 3050 Australie MeSH keywords: Région mammaire, Division cellulaire, Femelle, Facteur de transcription GATA-3, Humains, Régénération, Cellules souches |
La glande mammaire se développe chez l’embryon à partir de la formation de bourgeons mammaires primitifs. Après la naissance, elle subit un grand nombre de changements lors de la puberté, et chez l’adulte au cours de chaque cycle menstruel et des grossesses. Ces modifications sont contrôlées par des stimulations hormonales (œstrogène, progestérone, prolactine) et des facteurs de croissance (EGF, epidermal growth factor…) [
1]. La glande mammaire est composée de canaux formant un réseau de branchements remplissant le coussinet graisseux. La glande est formée de trois épithélium distincts : le myo-épithélium, localisé au niveau basal, entoure les canaux et leur donne leurs propriétés contractiles. L’épithélium luminal fait face au lumen et est subdivisé en cellules longeant les canaux et en cellules alvéolaires responsables de la production et de la sécrétion du lait au cours de la grossesse et de la lactation. Notre groupe s’intéresse à l’identification des cellules souches mammaires et de leur descendance. L’identification d’une hiérarchie cellulaire (cellules souches → progéniteurs → cellules différenciées) et des facteurs de transcription critiques pour la spécification vers un lignage cellulaire constitue une base nécessaire pour la compréhension des phénomènes oncogéniques observés dans les cancers du sein. |
Identification et isolement de la cellule souche mammaire L’importante capacité proliférative et régénérative du tissu mammaire lors de chaque cycle reproductif et l’existence de différents lignages cellulaires ont suggéré l’existence de cellules souches de la glande mammaire (CSMa) [
2]. En se fondant sur l’expression de marqueurs cellulaires membranaires et sur des expériences de transplantation in vivo, notre groupe [
3] et l’équipe de C. Eaves [
4] ont récemment identifié et isolé une sous-population de l’épithélium mammaire murin enrichie en CSMa. La glande mammaire est composée d’une grande diversité de cellules. Par tri en cytométrie de flux (FACS, fluorescence-actived cell sorting), nous avons éliminé les cellules exprimant les marqueurs spécifiques des cellules endothéliales et hématopoïétiques (CD31−CD45−TER119− ou Lin
−) et séparé les populations exprimant le heat stable antigen (HSA ou CD24) selon leur niveau d’expression de l’intégrine β1 (ou CD29): Lin−CD24+CD29lo et Lin−CD24+CD29hi. Elles seront nommées Lum et CSMa respectivement dans la suite du texte. Les cellules Lum expriment un niveau élevé de kératine 18, un marqueur spécifique de l’épithélium luminal, tandis que les CSMa expriment fortement la kératine 14, marqueur spécifique du myo-épithélium. Cultivées in vitro dans une matrice extra-cellulaire (matrigel), les cellules Lum forment des structures à couche cellulaire unique capables de produire du lait après stimulation par l’hormone lactogénique prolactine, alors que les CSMa forment des structures beaucoup plus complexes, à forte densité cellulaire. Seule une petite proportion de ces structures est capable de produire du lait après stimulation par la prolactine. La transplantation des CSMa (marquées par le transgène LacZ) dans le coussinet mammaire graisseux d’une souris pré-pubère dont on a retiré tout épithélium mammaire, aboutit à la formation d’un réseau de canaux possédant toutes les caractéristiques phénotypiques d’une glande mammaire, dont la capacité à se différencier pour produire du lait lors d’une grossesse. Des expériences de transplantation d’un nombre limité de cellules ont montré qu’une cellule Lin−CD24+CD29hi sur 64 est capable de former une glande mammaire. De plus, des expériences de transplantations en série ont prouvé que ces cellules ont la capacité de s’autorenouveler. Ainsi, les cellules Lin−CD24+CD29hi sont enrichies en cellules possédant les caractéristiques définissant une cellule souche : capacité à reformer in vivo tous les lignages de l’épithélium mammaire et capacité d’autorenouvellement. |
Établissement d’une hiérarchie cellulaire L’existence d’une hiérarchie cellulaire a été bien caractérisée dans le système hématopoïétique. Les cellules souches hématopoïétiques perdent progressivement leur capacité d’autorenouvellement pour donner naissance à des progéniteurs dont l’activité est restreinte à un lignage cellulaire spécifique [
5]. De façon similaire, notre but est d’établir une hiérarchie cellulaire dans la glande mammaire et d’identifier les cellules progénitrices, à forte capacité proliférative, capables de former le myoépithélium d’une part, et les épithéliums luminaux des canaux et alvéoles d’autre part. À ce jour, nous avons identifié une population enrichie en progéniteurs des cellules luminales (Figure 1B). En effet, la population Lum peut être subdivisée en deux sous-populations exprimant différents niveaux de l’intégrine β3 ou CD61 [
6]. Alors que toutes les cellules de la population enrichie en CSMa expriment CD61, seulement 30 % des cellules Lum expriment ce marqueur. Les cellules CD61− ne forment qu’un nombre restreint de petites colonies in vitro tandis que les cellules Lum CD61+ prolifèrent activement et ont une forte capacité à former des colonies. Ces colonies sont kératine 18+ et SMA− (smooth muscle actin). L’ensemble de ces résultats suggère que les cellules Lum CD61+ constituent une population de progéniteurs luminaux. De plus, la proportion de ces progéniteurs dans la glande mammaire est élevée au début de la puberté et diminue progressivement au cours de l’élongation des canaux pour atteindre un niveau stable à l’âge adulte. Lors de la phase de différenciation alvéolaire observée pendant la grossesse, le nombre de progéniteurs diminue dramatiquement. Cette population s’amplifie de nouveau après le sevrage pendant le remodelage de la glande. Ces résultats montrent que les cellules Lum CD61+ représentent une population progénitrice commune capable de se différencier en cellules canaliculaires et alvéolaires en fonction des phases de développement régies par les stimulations hormonales.  | Figure 1.
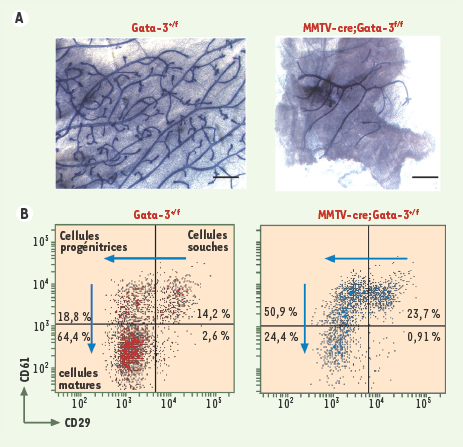
Gata-3 est un facteur clé du développement mammaire. A. Coloration par l’hématoxyline de la glande mammaire d’une souris adulte témoin (Gata-3+/f) ou dont le gène Gata-3 (MMTV-cre;Gata-3f/f) a été excisé, montrant le défaut de formation des canaux mammaires en l’absence de Gata-3. B. Représentation dot plot après analyse en cytométrie de flux, montrant le marquage CD61/CD29 des cellules Lin−CD24+ chez un animal témoin ou en l’absence de Gata-3 (MMTV-cre; ata-3+/f). En l’absence de Gata-3, les cellules progénitrices luminales ne se différencient pas en cellules matures aboutissant à l’accumulation de ces progéniteurs. |
 | Figure 2.
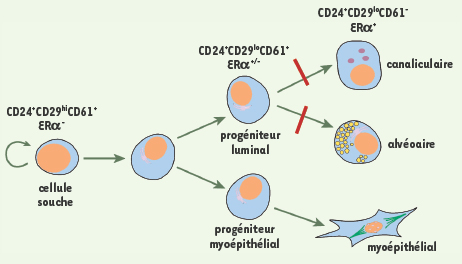
Modèle proposant une hiérarchie cellulaire dans la glande mammaire et indiquant le rôle clé de Gata-3 (barres rouges : inactivation conditionnelle) pour la différenciation des progéniteurs luminaux.
|
|
Gata-3 un facteur clé du développement mammaire La différenciation cellulaire est dépendante de la régulation de l’activité des gènes de sorte que à chaque étape de différenciation, certains gènes sont transcriptionnellement actifs et d’autres sont réprimés. Nous avons étudié le rôle du facteur de transcription Gata-3 lors des différentes phases de différenciation de la glande [6]. Gata-3 est exprimé dès les premières phases embryonnaires du développement mammaire. Après la naissance, Gata-3 est exprimé de façon stable au cours de la puberté, chez l’adulte et pendant la grossesse. Cette expression est restreinte aux cellules de l’épithélium luminal. Grâce au système LoxP/Cre-recombinase, nous avons excisé Gata-3 dans l’épithélium mammaire à différentes phases du développement, en choisissant les promoteurs appropriés pour contrôler l’expression de Cre. La délétion lors de l’embryogenèse (Kératine14-cre/Gata-3f/f) a montré que Gata-3 est nécessaire pour la formation des bourgeons mammaires primaires. Lorsque Gata-3 est excisé pendant la puberté (MMTV-cre/Gata-3f/f), la glande se développe anormalement avec la formation d’un nombre réduit de canaux (Figure 1A). La morphologie de ces canaux est anormale avec notamment une diminution de l’expression du récepteur aux oestrogènes (ERα), marqueur définitif de la différenciation luminale. Les femelles chez lesquelles Gata-3 est inactivé en milieu de grossesse (WAP-cre/Gata-3f/f, WAP whey acidic protein est un composant du petit-lait) sont incapables de nourrir leur progéniture. Les glandes présentent un défaut de différenciation alvéolaire et une absence de production de lait. Gata-3 est donc nécessaire lors de multiples phases du développement mammaire [6,
7]. Ayant précédemment identifié une population enrichie en CSMa, une population de cellules luminales progénitrices (LumCD61+) et une population de cellules différenciées (LumCD61−), nous avons étudié le rôle de Gata-3 lors de la détermination cellulaire luminale. L’expression de Gata-3 augmente graduellement au cours de la différenciation, passant d’un niveau faible dans les CSMa à un niveau élevé dans les cellules luminales matures. De façon intéressante, l’absence de Gata-3 au cours de la puberté (MMTV-cre/Gata-3f/f) induit un blocage de la différenciation des cellules progénitrices LumCD61+ en cellules matures LumCD61−
(Figure 1B). De plus la surexpression de Gata-3 dans les CSMa induit l’expression de protéines du lait en l’absence de stimulation par la prolactine. Ainsi Gata-3 est un facteur critique pour la différenciation cellulaire vers une destinée luminale. |
Origine cellulaire des cancers du sein Les implications cliniques de ce travail peuvent être importantes. Des études de microarray ont permis de subdiviser les cancers du sein en cinq grandes familles ([
8,
9], et voir l’article récent de E. Charaffe-Jauffret et al. dans Médecine/Sciences [
10]). Le phénotype « luminal » (subdivisé en groupes A et B) représente la grande majorité des cancers du sein. Ce type de cancer est ERα+PR+, exprime de forts niveaux de Gata-3 et possède un meilleur pronostic. Les autres sous-types sont appelés « normal-like », « basal » (ERα−PR−ErbB2−) et ErbB2+. Le phénotype “basal” présente le pire pronostic. L’existence de ces différences phénotypiques suggère une origine cellulaire différente pour chaque type de cancer. Nous avons montré que les CSMa possèdent des caractéristiques phénotypiques du sous-type basal (ERα−PR−ErbB2−) pouvant suggérer que les CSMa sont les cibles de mutations oncogéniques induisant ces tumeurs [
11]. Ces dernières pourraient également avoir pour origine un progéniteur bipotent (luminal et myoépithélial), un progéniteur luminal encore non différencié, une cellule épithéliale luminale ayant perdu l’activité de Gata-3 et ainsi perdu l’expression de ERα et de marqueurs luminaux, ou encore une cellule du lignage myoépithélial. Nos travaux montrant le rôle critique de Gata-3 pour la différenciation des cellules luminales normales pourraient expliquer pourquoi les tumeurs luminales ERα+, exprimant de forts niveaux de Gata-3, sont plus différenciées et, de ce fait, ont un meilleur pronostic. L’origine de ces tumeurs peut également être variée. Une petite proportion seulement des cellules progénitrices LumCD61+ expriment ERα tandis que la majorité des cellules différenciées sont ERα+. Ces tumeurs pourraient provenir de cellules progénitrices ou de cellules différenciées ayant acquis une capacité proliférative. L’ensemble de ces questions reste en suspens et l’identification d’une hiérarchie cellulaire mammaire dans le tissu humain pourra apporter certaines réponses. |
M-L A-L est financée par un fellowship Inserm/NHMRC. L’auteur remercie le Dr Jacques Bertoglio pour sa relecture critique du manuscrit.
|
1. Hennighausen L, Robinson GW. Information networks in the mammary gland. Nat Rev 2005; 6 : 715–25. 2. Deome KB, Faulkin LJ Jr, Bern HA, Blair PB. Development of mammary tumors from hyperplastic alveolar nodules transplanted into gland-free mammary fat pads of female C3H mice. Cancer Res 1959; 19 : 515–20. 3. Shackleton M, Vaillant F, Simpson KJ, et al. Generation of a functional mammary gland from a single stem cell. Nature 2006; 439 : 84–8. 4. Stingl J, Eirew P, Ricketson I, et al. Purification and unique properties of mammary epithelial stem cells. Nature 2006; 439 : 993–7. 5. Akashi K, Traver D, Miyamoto T, Weissman IL. A clonogenic common myeloid progenitor that gives rise to all myeloid lineages. Nature 2000; 404 : 193–7. 6. Asselin-Labat ML, Sutherland KD, Barker H, et al. Gata-3 is an essential regulator of mammary-gland morphogenesis and luminal-cell differentiation. Nat Cell Biol 2007; 9 : 201–9. 7. Kouros-Mehr H, Slorach EM, Sternlicht MD, Werb Z. GATA-3 maintains the differentiation of the luminal cell fate in the mammary gland. Cell 2006; 127 : 1041–55. 8. Perou CM, Sorlie T, Eisen MB, et al. Molecular portraits of human breast tumours. Nature 2000; 406 : 747–52. 9. Sorlie T, Perou CM, Tibshirani R, et al. Gene expression patterns of breast carcinomas distinguish tumor subclasses with clinical implications. Proc Natl Acad Sci USA 2001; 98 : 10869–74. 10. Charafe-Jauffret E, Chaffanet M, Bertucci F, et al. Les cancers du sein : vers un modèle cellulaire et moléculaire intégré. Med Sci (Paris) 2007; 23 : 626–32. 11. Asselin-Labat ML, Shackleton M, Stingl J, et al. Steroid hormone receptor status of mouse mammary stem cells. J Natl Cancer Inst 2006; 98 : 1011–4. |