| |
| Med Sci (Paris). 2007 November; 23(11): 968–974. Published online 2007 November 15. doi: 10.1051/medsci/20072311968.La leucémie de l’enfant Une maladie génétique ! Daniel Sinnett,* Nina N’Diaye, Pascal St-Onge, and Jasmine Healy Service d’hématologie-oncologie, Centre de cancérologie Charles-Bruneau, Centre de recherche, Hôpital Sainte-Justine Département de pédiatrie, Université de Montréal, 3175, chemin de la Côte Sainte-Catherine, Montréal, Québec, H3T 1C5, Canada |
La leucémie lymphoblastique aiguë (LLA) est la maladie maligne la plus fréquente avant l’âge de 14 ans ; elle représente environ 25 % de l’ensemble des cancers pédiatriques. Cette maladie résulte de la prolifération incontrôlée des lymphoblastes (cellules progénitrices des lymphocytes T et B) qui envahissent la moelle osseuse, le sang et d’autres organes. La LLA de type pré-B est celle qui affecte le plus fréquemment l’enfant (80 % des patients) comparativement au type pré-T (15 %). La LLA est une maladie complexe résultant de l’effet de plusieurs gènes à « faible pénétrance » dont l’action est tempérée par des facteurs externes qui modifient le risque de développer la maladie. La plupart des études d’épidémiologie génétique concernent les leucémies de l’enfant [
1]. Malgré de nombreux efforts, la pathogenèse de la LLA reste mal comprise de même que les bases génétiques qui expliquent la vulnérabilité de ceux qui en sont victimes. Nous avons démontré que des variants de gènes qui concourent au métabolisme des carcinogènes confèrent aux enfants une plus grande susceptibilité à la LLA [
2]. Cette découverte est venue renforcer le paradigme soulignant l’importance des facteurs de susceptibilité génétique dans la leucémogenèse [
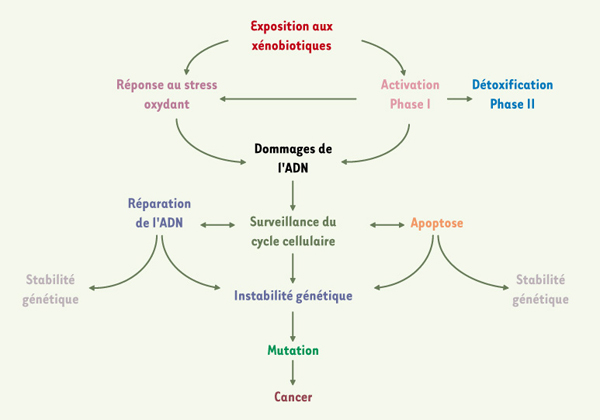
3]. Cependant, la prise en compte d’une seule enzyme (ou voie métabolique) et/ou d’un seul génotype ne saurait expliquer l’étiologie de la leucémie de l’enfant, une telle attitude reviendrait à tenir pour négligeable la complexité des interactions entre l’environnement et la génétique individuelle. Il faut, au contraire, intégrer différentes voies biologiques, telles que la régulation du cycle cellulaire, la réplication et la réparation de l’ADN, ainsi que la biotransformation des xénobiotiques (Figure 1). Nous insisterons particulièrement dans cette synthèse sur les variants génétiques des enzymes (isoformes) du métabolisme des xénobiotiques et sur la réponse au stress oxydant.  | Figure 1.
Illustration schématique du processus de carcinogenèse et des inter-relations entre les différentes voies.
|
|
Métabolisme des xénobiotiques Les carcinogènes chimiques requièrent une étape d’activation métabolique afin de pouvoir interagir avec le matériel génétique et déclencher des mutations menant éventuellement au processus de cancérisation. Cette activation est effectuée par les enzymes de phase I catalysant les réactions d’hydrolyse, de réduction et d’oxydation (Figure 1). Les enzymes de phase II, quant à elles, permettent la détoxification des substances produites pendant la phase I en catalysant les réactions de glucunoconjugaison, de sulfatation, d’acétylation, de méthylation et de conjugaison avec le glutathion ou les acides aminés. Ces types d’opération permettent la conversion des espèces réactives en produits solubles non réactifs qui sont éliminés par l’organisme sous forme d’urine ou de bile. Certaines enzymes se présentent sous plusieurs formes qui sont associées à des phénotypes biochimiques bien définis marqués par l’absence, l’augmentation ou la diminution de l’activité enzymatique. Ces isoformes résultent de polymorphismes présents dans les gènes correspondants ou bien qui y sont associées. Les N-acétyltransférases 1 et 2 (NAT1 et NAT2) sont des enzymes de conjugaison qui métabolisent les arylamines et les amines hétérocycliques amines [
4]. Des variants génétiques dans les gènes NAT1 et NAT2 [
5] sont corrélés avec des phénotypes biochimiques allant d’acétylateur lent à rapide [4]. De nombreuses études font état de liens entre ces variants et le risque de cancers du cou et de la tête, du poumon, du sein, de la vessie ainsi que du côlon [
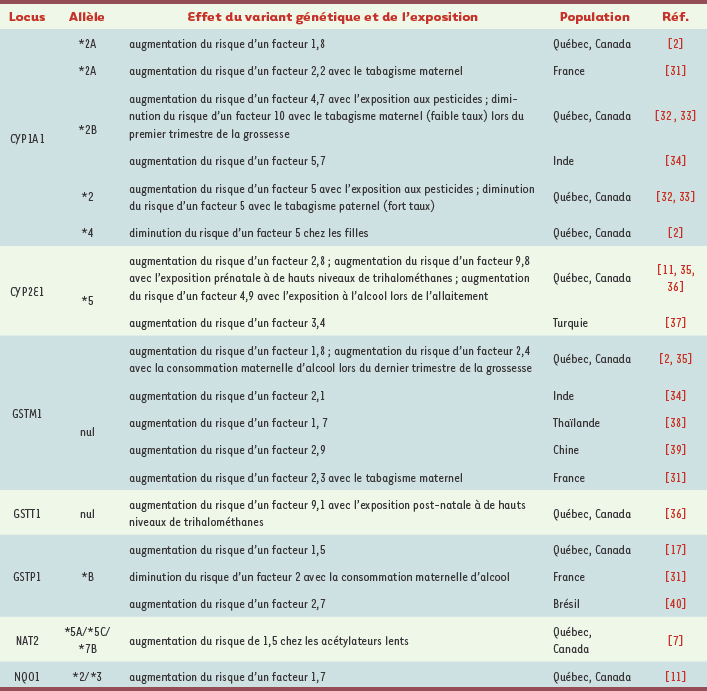
6]. Lors de travaux que nous avons entrepris à l’égard de la LLA de l’enfant, nous avons observé que la distribution de certains allèles de NAT2 était différente entre les patients LLA et le groupe contrôle : l’allèle NAT2*4 était sous-représenté, tandis que NAT2*5A, *5C et *7B étaient surreprésentés chez les patients (Tableau I). En conséquence, les enfants porteurs de génotypes NAT2, prédictifs d’un phénotype acétylateur lent, montraient un risque accru d’être frappés de la LLA (OR = 1,6, 95 % IC 1,1-2,5) [
7]. Ces données sont en accord avec les études effectuées sur les tumeurs solides de l’adulte qui rapportent que les individus possédant un phénotype NAT2 acétylateur lent (déduit à partir du génotype) ont un risque plus élevé d’être atteint d’un cancer du cou et de la tête, du sein, du larynx et de la vessie. L’incapacité de démontrer l’influence de variants de NAT1 dans le risque de LLA, suggère que l’acétylation par cette enzyme joue un rôle peu ou pas important dans la leucémogenèse de l’enfant [7]. 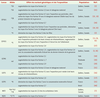 | Tableau I.
Polymorphismes génétiques des enzymes du métabolisme des xénobiotiques et de la réponse au stress oxydant associés à la la LLA chez l’enfant. Les travaux suggérant l’absence d’association ne sont pas présentés dans ce tableau. |
Les cytochromes P450 (CYP) forment une famille d’enzymes codées par plusieurs gènes polymorphes notamment CYP1A1, important dans l’activation des hydrocarbures aromatiques polycycliques, et CYP2E1 qui métabolise différents carcinogènes comme les nitrosamines, le benzène, l’éthanol et les solvants halogénés [
8]. De plus, CYP2E1 réduit efficacement le dioxygène en radicaux libres, contribuant ainsi à la peroxydation des lipides et au stress oxydant [8]. Les isoformes correspondant aux variants CYP1A1 *2A et *2B possèdent une plus grande activité enzymatique et/ou une plus grande inductibilité que l’allèle sauvage (normal ou non muté) et sont associées à des niveaux élevés d’adduits à l’ADN, ainsi qu’à un plus grand risque de formation de carcinomes [
9]. Inversement, les individus porteurs de l’allèle sauvage disposent d’un plus faible potentiel d’activation des carcinogènes et semblent être protégés contre le cancer [
10]. Plusieurs polymorphismes de CYP2E1 ont été décrits [8]. Nous avons démontré que la présence de l’allèle CYP1A1*2A (T6235C) augmentait de 80 % le risque d’apparition de la LLA (OR = 1,8 ; 95 % IC 1,1-3,1 ; p = 0,03) chez les enfants [2]. Nous avons également observé que les enfants porteurs de l’allèle CYP2E1*5 (G1259C) étaient plus susceptibles d’être atteints de LLA (OR = 2,8 ; 95 % IC 1,2-6,7 ; p = 0,03) [
11]. Les glutathion-S-transférases (GST) forment une famille d’enzymes multifonctionnelles qui se divise en plusieurs classes, GSTA1, GSTM1, GSTP1, GSTS1 et GSTT1, chacune ayant une spécificité de substrats plus ou moins stricte et un profil d’expression tissulaire propre [
12]. Dans la population générale, aucune activité GSTM1 ni GSTT1 n’est observée chez 50 % et 20 % des individus respectivement, en raison d’une délétion homozygote (allèle nul) des gènes correspondants [
13]. Le gène GSTP1 est exprimé dans plusieurs tissus humains tels que la moelle osseuse, les cellules sanguines et c’est la principale forme de GST exprimée dans les tissus fœtaux [
14]. Plusieurs polymorphismes sont répertoriés dans la région codante de ce dernier : une transition A vers G à la position 1578 entraîne la substitution d’une isoleucine par une valine au codon 105 (Ile105Val), de même que la substitution d’un C par un T à la position 2293 entraîne le remplacement d’une alanine par une valine à la position 114 (Ala114Val) [
15]. Les isoformes associées aux variants de GSTP1 présentent des activités catalytiques variables [
16] ayant des effets potentiellement différents sur la susceptibilité au cancer [15]. Nous avons démontré que les porteurs de l’allèle nul pour GSTM1 avaient un risque plus élevé de développer une LLA (OR = 1,8 ; 95IC 1,2-2,6 ; p = 0,004) [2]. Dans une autre étude, nous avons observé une augmentation du risque de LLA avec les génotypes GSTP1*B/*B (correspondant au variant Val105/Ala114) et GSTP1*A/*B, mais pas avec le génotype GSTP1*B/*C (OR = 1,5 ; 95 % IC 1,1-2,0 ; p = 0,02) [
17]. L’isoforme GSTP1*B est associée à une réduction de l’activité de conjugaison sur certains substrats tandis que l’activité de GSTP1*C demeure inchangée [
18]. L’impact de l’isoforme correspondant au variant *B semble donc dépendre du substrat [
19]. GSTP1 étant l’enzyme majoritairement exprimée dans le foie, les poumons, le rein et le placenta pendant la vie fœtale [14,
20], il est possible que les différences de spécificité ou d’affinité envers un substrat caractérisant les isoformes de GSTP1 (seules ou associées à d’autres GST) puissent moduler leur capacité à métaboliser les carcinogènes de l’environnement et ainsi modifier la susceptibilité individuelle à la leucémie. |
Réponse au stress oxydant La myéloperoxydase (MPO) est une enzyme lysosomiale fortement exprimée dans la moelle osseuse. Elle active les carcinogènes présents dans la fumée de cigarette tels que le benzo[a]pyrène et les amines aromatiques, transforme les solvants organiques en métabolites hautement réactifs et contribue au stress oxydant en catalysant la formation de radicaux libres [
21]. Une transition A vers G à la position – 463 de la région promotrice du gène MPO serait responsable de la variation de l’expression de l’enzyme pour laquelle il code, en abolissant le site de liaison du facteur de transcription SP1 [
22]. D’ailleurs, un lien de cause à effet a été démontré entre un niveau élevé de transcription de MPO et le risque de leucémie et de cancer du poumon chez l’adulte [
23,
24]. La NAD(P)H : quinone oxydoréductase de type 1 (NQO1) est une enzyme cytosolique qui catalyse la réduction des quinones de deux électrons prévenant ainsi leur participation au cycle redox et donc au stress oxydant. À ce titre, il est probable que les individus ayant une faible activité ou une absence d’activité NQO1 soient plus exposés aux effets toxiques et carcinogènes de certaines quinones (métabolites du benzène) et des composés nitroaromatiques. Les niveaux d’activité de NQO1 peuvent être reliés à au moins deux polymorphismes génétiques, une transition C vers T en position – 465 et une autre transition C vers T en position – 609 responsables, pour l’une, d’une diminution et pour l’autre, d’une perte de fonction [
25]. Nous avons montré que les sujets porteurs des variants NQO1*2 ou *3 présentent un risque plus élevé de développer une LLA (OR : 1,7 ; IC95 % : 1,2-2,4 ; p = 0,004) [11]. De plus, les individus hétérozygotes présentent une activité enzymatique diminuée suggérant ainsi que de faibles niveaux d’activité de NQO1 pourraient conférer une susceptibilité accrue à la LLA. D’autres études ont fait état d’une plus grande prévalence de l’allèle NQO1*2 (T609) dans les leucémies myéloïdes iatrogènes [
26], ainsi que dans certaines formes de leucémies infantiles [
27] appuyant ainsi l’hypothèse selon laquelle NQO1 serait impliquée dans la leucémogenèse. En revanche, nous n’avons pu mettre en évidence la moindre association entre les variants de MPO et la vulnérabilité à la LLA. |
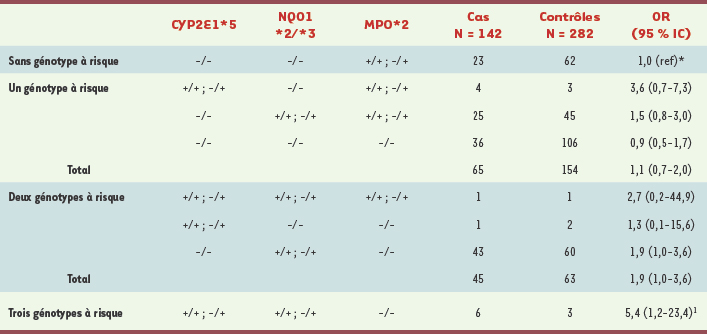
Tel que nous venons de l’illustrer, la contribution de chaque variant commun a une répercussion plutôt modeste sur le risque de maladie. Les causes d’une maladie complexe comme la leucémie de l’enfant s’expliqueraient davantage par la combinaison des effets de différents locus. Considérons l’exemple des glutathion-S-transférases qui participent à des voies métaboliques semblables. Chez les individus pouvant porter plusieurs allèles de susceptibilité, il faut considérer, lors de l’estimation du risque, les possibles interactions au sein des allèles des différents gènes codant pour les GST. Nous avons donc étudié l’effet des variants de GSTP1 en présence de l’un ou l’autre des allèles exempts de GSTM1 et GSTT1 [17]. Le risque relatif de LLA est significativement élevé chez les individus ayant les allèles sans GSTM1 ni GSTP1*B (OR : 2,1 ; IC95 % : 1,3-3,4 ; p = 0,003). L’effet de synergie observé entre ces deux locus s’explique par la convergence de spécificité des substrats et des voies de détoxification (substances retrouvées dans la fumée de cigarette ou parmi les polluants de l’environnement comme les hydrocarbures aromatiques polycycliques). Aucun effet additionnel n’a pu être mis en évidence avec l’allèle sans GSTT1. L’intervention des enzymes CYP2E1, NQO1 et MPO dans des voies métaboliques communes [21] nous a aussi incités à analyser l’effet combiné de leurs génotypes [11]. On observe que le risque total de LLA est accru en présence de plusieurs génotypes porteurs de risque (OR : 1,9 [IC95 % : 1,0-3,6) et 5,4 (IC95 % : 1,2-23,4]) pour deux et trois locus respectivement (Tableau II). Notons que le variant de MPO n’exerce aucun effet à lui seul alors qu’en combinaison avec les allèles CYP2E1 et NQO1, le risque de LLA augmente considérablement (OR : 5,4 ; IC95 % : 1,2-23,4). Une telle étude nécessite cependant une validation externe, particulièrement à cause du petit échantillonnage. Ce résultat est d’autant plus intéressant que les enzymes codées par ces trois gènes catalysent la biotransformation de produits carcinogènes tels que les solvants organiques, les substances contenues dans la fumée de cigarette, les médicaments, les dérivés plastiques ainsi que les pesticides [
28,
29].  | Tableau II.
Effets combinés des génotypes de CYP2E1, NQO1 et MPO sur le risque de LLA chez l’enfant. −/− : absence des allèles. +/+ ; −/+ : présence d’au moins un allèle. *Le groupe de référence comprend des enfants ayant un génotype à « faible risque » à savoir absence de l’allèle CYP2E1*5, absence de l’allèle mutant de NQO1 et présence du variant MPO*2. 1p pour tendance = 0,003 [ 2]. |
Soulignons que l’identification de gènes modifiant le risque de développer une maladie complexe représente un défi de l’épidémiologie génétique, principalement à cause de l’utilisation d’outils traditionnels. Pour aborder ce problème, nous devrons nous tourner vers de nouvelles approches statistiques et informatiques moins limitées par les données de haute dimension afin de mieux discerner les interactions gène-gène. Mentionnons à titre d’exemple, l’approche statistique MDR (Multifactor Dimensionality Reduction) et l’apprentissage machine comme les réseaux de neurones (GPNN, Genetic Programming Neural Network) et les réseaux bayesiens. |
Interactions gène-environnement L’existence d’un pic d’incidence de la maladie entre 2 et 5 ans suggère que le processus de leucémogenèse débute in utero ou très tôt au cours de la petite enfance. Nourrissons et enfants sont particulièrement sensibles aux effets des divers polluants environnementaux en raison d’une plus grande exposition relative et/ou des caractéristiques propres à leur développement physiologique, notamment une croissance accélérée et un grand nombre de divisions cellulaires favorisant l’apparition de mutations. Quelques études d’épidémiologie moléculaire ont mis en corrélation des données génétiques et les degrés d’exposition parentale à des agents cancérigènes avant la conception, durant la grossesse et au cours de la période postnatale afin de mieux comprendre les bases de la LLA chez l’enfant (Tableau I). |
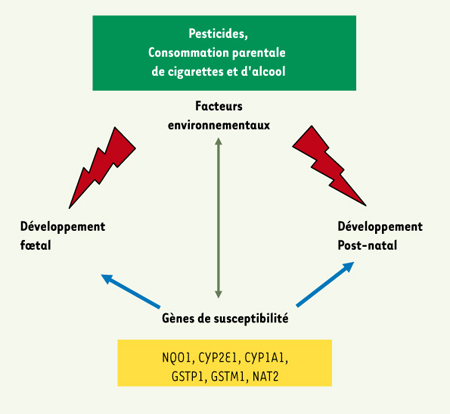
Signification biologique des données d’épidémiologie génétique Plusieurs études épidémiologiques consacrées aux périodes pré- et post-natales ont permis de suggérer un rôle potentiel des expositions à divers facteurs environnementaux dans le déclenchement et le développement de la LLA. Tel que nous l’avons évoqué plus haut, il y a en effet de plus en plus d’arguments en faveur d’une modification du risque attribuable aux variants génétiques des enzymes métabolisant les carcinogènes (Figure 2) [
30]. Cette perspective est d’autant plus probable que ces substances peuvent atteindre le placenta grâce au système circulatoire maternel et y être métabolisées selon des processus similaires à ceux qui existent dans le foie. Ainsi, des modifications du métabolisme placentaire induiraient des variations des niveaux d’exposition du fœtus en réponse à des molécules électrophiles délétères.  | Figure 2.
Illustration des facteurs génétiques et environnementaux associés au risque de LLA. Les expositions pré- et postnatales pourraient être des facteurs déterminants dans l’initiation de la LLA chez l’enfant. L’exposition à des contaminants toxiques s’effectue à différents stades du développement de l’organisme : (1) avant la conception, de par l’exposition des cellules germinales des parents, (2) durant la grossesse, de par les substances transmises par la mère au fœtus et (3) après la naissance, suite à une exposition quotidienne à l’environnement. |
À la lumière des résultats présentés ci-dessus, plusieurs scénarios biologiquement plausibles peuvent être proposés. Par exemple, il est possible qu’un jeune enfant (ou un fœtus) exposé à des carcinogènes ubiquitaires, portant l’allèle sans GSTM1 et les allèles CYP1A1*2A ait une plus grande prédisposition à accumuler des altérations dans son ADN et éventuellement être affecté d’une leucémie. Le variant CYP1A1*2A est hautement inductible, suggérant l’hypothèse qu’existe un lien entre le risque de LLA et une augmentation de l’activité de cette enzyme. Par conséquent, les porteurs de cet allèle seraient plus vulnérables aux effets des carcinogènes. Une association entre l’induction de l’activité placentaire de CYP1A1 et les hydrocarbures aromatiques polycycliques présents dans la fumée de cigarette ou dans les aliments cuits a en effet fait l’objet de publication. À cet égard, nous avons montré que le risque de LLA chez les enfants porteurs de l’allèle CYP1A1*2A ou *2B est augmenté (OR allant de 3,9 à 5,55) selon les niveaux d’exposition aux pesticides pendant la grossesse, illustrant ainsi l’effet des interactions gène-environnement dans l’étiologie de la maladie [30]. Les enzymes CYP2E1 et NQO1 sont présentes dans différents tissus fœtaux et également dans le placenta, alors que MPO est exprimée dans les cellules progénitrices hématopoïétiques de la moelle osseuse, considérées comme étant le site de démarrage du processus leucémique. Les produits carcinogènes de l’environnement métabolisés par ces enzymes seraient donc impliqués dans la leucémogenèse de l’enfant tel que le suggèrent nos études. Il est tout à fait concevable qu’une augmentation de l’activité de CYP2E1 combinée à une réduction de l’efficacité de NQO1 ait des effets plus délétères sur les cellules et/ou entraîne une accumulation de carcinogènes hautement réactifs à la suite d’une exposition à ces produits. |
Étant donné la variété des produits carcinogènes auxquels chaque individu est exposé et la diversité des enzymes qui participent à leur métabolisme, les résultats exposés ici constituent un premier pas dans l’effort d’élucidation des bases moléculaires de la vulnérabilité génétique à la LLA chez l’enfant. Bien que les données obtenues chez l’enfant ne soient pas nécessairement applicables à l’adulte, le modèle pédiatrique pourrait, à bien des égards, s’avérer très utile non seulement dans la compréhension de la leucémogenèse mais aussi de l’oncogenèse en général. L’identification des gènes modifiant le risque de cancer, ainsi qu’une meilleure connaissance des interactions de type gène-gène et gène-environnement revêtent une importance cruciale en termes de santé publique. L’acquisition de telles connaissances devrait grandement améliorer le champ de la médecine préventive, notamment grâce à une meilleure connaissance des facteurs génétiques mesurables qui réduisent le risque de cancer. |
Nous sommes reconnaissants envers les patients qui ont participé à ces études ainsi qu’aux cliniciens et toute l’équipe médicale pour leur collaboration. Ces études sont supportées conjointement par des subventions des Instituts de recherche en santé du Canada et du réseau de médecine génétique appliquée (RMGA) du Fonds de la recherche en santé du Québec. Daniel Sinnett est le titulaire de la chaire de recherche François-Karl-Viau en oncogénomique pédiatrique.
|
1. Stiller CA. Epidemiology and genetics of childhood cancer. Oncogene 2004; 23 : 6429–44. 2. Krajinovic M, Labuda D, Richer C, et al. Susceptibility to childhood acute lymphoblastic leukemia : influence of CYP1A1, CYP2D6, GSTM1, and GSTT1 genetic polymorphisms. Blood 1999; 93 : 1496–501. 3. Sinnett D, Krajinovic M, Labuda D. Genetic susceptibility to childhood acute lymphoblastic leukemia. Leuk Lymphoma 2000; 38 : 447–62. 4. Meyer UA, Zanger UM. Molecular mechanisms of genetic polymorphisms of drug metabolism. Annu Rev Pharmacol Toxicol 1997; 37 : 269–96. 5. Vatsis KP, Weber WW, Bell DA, et al. Nomenclature for N-acetyltransferases. Pharmacogenetics 1995; 5 : 1–17. 6. d’Errico A, Taioli E, Chen X, Vineis P. Genetic metabolic polymorphisms and the risk of cancer : a review of the literature. Biomarkers 1996; 1 : 149–73. 7. Krajinovic M, Richer C, Sinnett H, et al. Genetic polymorphisms of N-acetyltransferases 1 and 2 and gene-gene interaction in the susceptibility to childhood acute lymphoblastic leukemia. Cancer Epidemiol Biomarkers Prev 2000; 9 : 557–62. 8. Daly AK, Fairbrother KS, Smart J. Recent advances in understanding the molecular basis of polymorphisms in genes encoding cytochrome P450 enzymes. Toxicol Lett 1998; 102-103 : 143–7. 9. Kato S, Bowman ED, Harrington AM, et al. Human lung carcinogen-DNA adduct levels mediated by genetic polymorphisms in vivo. J Natl Cancer Inst 1995; 87 : 902–7. 10. Shields PG. Pharmacogenetics : detecting sensitive populations. Environ Health Perspect 1994; 102 (suppl 11) : 81–7. 11. Krajinovic M, Sinnett H, Richer C, et al. Role of NQO1, MPO and CYP2E1 genetic polymorphisms in the susceptibility to childhood acute lymphoblastic leukemia. Int J Cancer 2002; 97 : 230–6. 12. Hayes JD, Pulford DJ. The glutathione S-transferase supergene family : regulation of GST and the contribution of the isoenzymes to cancer chemoprotection and drug resistance. Crit Rev Biochem Mol Biol 1995; 30 : 445–600. 13. Rebbeck TR. Molecular epidemiology of the human glutathione S-transferase genotypes GSTM1 and GSTT1 in cancer susceptibility. Cancer Epidemiol Biomarkers Prev 1997; 6 : 733–43. 14. Cossar D, Bell J, Strange R, et al. The alpha and pi isoenzymes of glutathione S-transferase in human fetal lung : in utero ontogeny compared with differentiation in lung organ culture. Biochim Biophys Acta 1990; 1037 : 221–6. 15. Harries LW, Stubbins MJ, Forman D, et al. Identification of genetic polymorphisms at the glutathione S- transferase Pi locus and association with susceptibility to bladder, testicular and prostate cancer. Carcinogenesis 1997; 18 : 641–4. 16. Hu X, Xia H, Srivastava SK, et al. Activity of four allelic forms of glutathione S-transferase hGSTP1-1 for diol epoxides of polycyclic aromatic hydrocarbons. Biochem Biophys Res Commun 1997; 238 : 397–402. 17. Krajinovic M, Labuda D, Sinnett D. Glutathione S-transferase P1 genetic polymorphisms and susceptibility to childhood acute lymphoblastic leukaemia. Pharmacogenetics 2002; 12 : 655–8. 18. Watson MA, Stewart RK, Smith GB, et al. Human glutathione S-transferase P1 polymorphisms : relationship to lung tissue enzyme activity and population frequency distribution. Carcinogenesis 1998; 19 : 275–80. 19. Sundberg K, Johansson AS, Stenberg G, et al. Differences in the catalytic efficiencies of allelic variants of glutathione transferase P1-1 towards carcinogenic diol epoxides of polycyclic aromatic hydrocarbons. Carcinogenesis 1998; 19 : 433–6. 20. Hiley C, Bell J, Hume R, Strange R. Differential expression of alpha and pi isoenzymes of glutathione S-transferase in developing human kidney. Biochim Biophys Acta 1989; 990 : 321–4. 21. Kettle AJ, Winterbourn CC. Oxidation of hydroquinone by myeloperoxidase. Mechanism of stimulation by benzoquinone. J Biol Chem 1992; 267 : 8319–24. 22. Piedrafita FJ, Molander RB, Vansant G, et al. An Alu element in the myeloperoxidase promoter contains a composite SP1-thyroid hormone-retinoic acid response element. J Biol Chem 1996; 271 : 14412–20. 23. Reynolds WF, Chang E, Douer D, et al. An allelic association implicates myeloperoxidase in the etiology of acute promyelocytic leukemia. Blood 1997; 90 : 2730–7. 24. Cascorbi I, Henning S, Brockmoller J, et al. Substantially reduced risk of cancer of the aerodigestive tract in subjects with variant--463A of the myeloperoxidase gene. Cancer Res 2000; 60 : 644–9. 25. Gaedigk A, Tyndale RF, Jurima-Romet M, et al. NAD(P)H : quinone oxidoreductase : polymorphisms and allele frequencies in Caucasian, Chinese and Canadian Native Indian and Inuit populations. Pharmacogenetics 1998; 8 : 305–13. 26. Larson RA, Wang Y, Banerjee M, et al. Prevalence of the inactivating 609C-T polymorphism in the NAD(P)H : quinone oxidoreductase (NQO1) gene in patients with primary and therapy-related myeloid leukemia. Blood 1999; 94 : 803–7. 27. Wiemels JL, Pagnamenta A, Taylor GM, et al. A lack of a functional NAD(P)H : quinone oxidoreductase allele is selectively associated with pediatric leukemias that have MLL fusions. United Kingdom Childhood Cancer Study Investigators. Cancer Res 1999; 59 : 4095–9. 28. Fairbrother KS, Grove J, de Waziers I, et al. Detection and characterization of novel polymorphisms in the CYP2E1 gene. Pharmacogenetics 1998; 8 : 543–52. 29. Smith MT. Benzene, NQO1, and genetic susceptibility to cancer. Proc Natl Acad Sci USA 1999; 96 : 7624–6. 30. Infante-Rivard C, Labuda D, Krajinovic M, Sinnett D. Risk of childhood leukemia associated with exposure to pesticides and with gene polymorphisms. Epidemiology 1999; 10 : 481–7. 31. Clavel J, Bellec S, Rebouissou S, et al. Childhood leukaemia, polymorphisms of metabolism enzyme genes, and interactions with maternal tobacco, coffee and alcohol consumption during pregnancy. Eur J Cancer Prev 2005; 14 : 531–40. 32. Infante-Rivard C, Sinnett D. Preconceptional paternal exposure to pesticides and increased risk of childhood leukaemia. Lancet 1999; 354 : 1819. 33. Infante-Rivard C, Krajinovic M, Labuda D, Sinnett D. Parental smoking, CYP1A1 genetic polymorphisms and childhood leukemia (Quebec, Canada). Cancer Causes Control 2000; 11 : 547–53. 34. Joseph T, Kusumakumary P, Chacko P, et al. Genetic polymorphism of CYP1A1, CYP2D6, GSTM1 and GSTT1 and susceptibility to acute lymphoblastic leukaemia in Indian children. Pediatr Blood Cancer 2004; 43 : 560–7. 35. Infante-Rivard C, Krajinovic M, Labuda D, Sinnett D. Childhood acute lymphoblastic leukemia associated with parental alcohol consumption and carcinogen-metabolizing genetic polymorphisms. Epidemiology 2002; 13 : 277–81. 36. Infante-Rivard C, Amre D, Sinnett D. GSTT1 and CYP2E1 polymorphisms and trihalomethanes in drinking water : effect on childhood leukemia. Environ Health Perspect 2002; 110 : 591–3. 37. Aydin-Sayitoglu M, Hatirnaz O, Erensoy N, Ozbek U. Role of CYP2D6, CYP1A1, CYP2E1, GSTT1, and GSTM1 genes in the susceptibility to acute leukemias. Am J Hematol 2006; 81 : 162–70. 38. Pakakasama S, Mukda E, Sasanakul W, et al. Polymorphisms of drug-metabolizing enzymes and risk of childhood acute lymphoblastic leukemia. Am J Hematol 2005; 79 : 202–5. 39. Wang J, Zhang L, Feng J, et al. Genetic polymorphisms analysis of glutathion S-transferase M1 and T1 in children with acute lymphoblastic leukemia. J Huazhong Univ Sci Technolog Med Sci 2004; 24 : 243–244. 40. Canalle R, Burim RV, Tone LG, Takahashi CS. Genetic polymorphisms and susceptibility to childhood acute lymphoblastic leukemia. Environ Mol Mutagen 2004; 43 : 100–9. |