| |
| Med Sci (Paris). 2007 November; 23(11): 957–960. Published online 2007 November 15. doi: 10.1051/medsci/20072311957.Antidépresseurs et grossesse Risques et bénéfices pour la mère et l’enfant Anick Bérard* and lodie Ramos Faculté de pharmacie, Université de Montréal, Montréal, Québec, Canada Centre de recherche, CHU Sainte-Justine, 3175, Côte-Sainte-Catherine, Montréal, Québec, H3T 1C5 Canada |
La santé mentale, la grossesse et les antidépresseurs Les troubles psychiatriques ne sont pas rares dans la population générale, ils affectent notamment une proportion non négligeable des femmes en âge de procréer. En effet, la dépression est une maladie qui touche fréquemment les jeunes femmes : les taux de prévalence s’échelonnent entre 10 % et 25 % [
1]. Ce pourcentage égalerait 14 % pendant la grossesse [
2]. Pourtant, la grossesse a longtemps été considérée comme étant une période de la vie capable de protéger les femmes contre les troubles cyclothymiques en raison de la sensation de bien-être qu’elle peut, semble-t-il, leur procurer. Sachant qu’environ 50 % des grossesses ne sont pas planifiées [
3], et connaissant la forte prévalence des troubles psychiatriques pendant la grossesse, l’effet de l’utilisation des antidépresseurs pendant la période de gestation est ainsi d’actualité. Le centre d’informations sur les tératogènes « Info-médicaments en allaitement et grossesse » (IMAGe) basé au CHU Sainte-Justine (Montréal, Québec, Canada) a confirmé tout récemment l’intérêt que manifestent notamment les professionnels de la santé à l’égard de l’emploi ou non des antidépresseurs. On note, en effet, que 18 % des appels reçus ont un lien direct avec l’utilisation des antidépresseurs durant la grossesse [
4]. |
Tendances d’utilisation des antidépresseurs pendant la grossesse Essentiellement pour des raisons éthiques, les données d’efficacité et d’innocuité concernant l’utilisation des antidépresseurs pendant la période de gestation sont rares puisque peu d’essais cliniques sont réalisés chez les femmes enceintes. Leur usage pendant la grossesse va donc généralement rester sujet à controverses. Un rapport national sur la santé mentale publié récemment aux États-Unis [
5] renforce cette idée. Il met en évidence le fait que les médecins prescrivent une posologie en dessous de la normale ou arrêtent les médicaments servant à traiter les états psychiatriques pendant la grossesse, tels que les antidépresseurs, de peur du potentiel tératogène auquel avait pu être associé par le passé l’usage de certains autres médicaments. Cependant, pour être capable d’évaluer l’augmentation de malformations congénitales supposées être la conséquence d’une agression extérieure (médicamenteuse ou toxique) en cours de grossesse, on doit tout d’abord en connaître la fréquence dans la population générale. Globalement, il a déjà été établi qu’entre 1,5 % et 3 % des enfants [
6] naissent avec une malformation congénitale qualifiée de mineure ou majeure. Dans approximativement 70 % des cas, l’étiologie de ces malformations serait inconnue et les causes médicamenteuses ou encore toxiques ne représenteraient que 4 à 5 % de ces cas. Il serait donc erroné d’attribuer l’entière responsabilité des malformations congénitales observées dans la population, aux médicaments. Malgré cela, la prudence continue de s’imposer puisque l’on constate que les médecins continuent à prescrire les antidépresseurs avec une tendance à sous-traiter. Les données scientifiques semblent suggérer aussi que les femmes optent d’elles-mêmes pour une interruption momentanée de leur traitement lorsqu’elles apprennent leur grossesse. Elles s’appuient sur des raisons souvent non fondées, telle qu’une mauvaise perception du risque [
7]. D’ailleurs, Ramos et al. viennent récemment de confirmer ces comportements en rapportant que le pourcentage d’utilisation des antidépresseurs chute de moitié en début de grossesse (6,6 % contre 3,7 %, p < 0,01) [
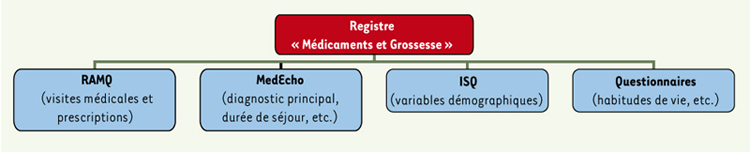
8]. Les auteurs notent également qu’aucune adaptation de traitement durant le premier trimestre de grossesse n’a été tentée alors que cette adaptation aurait été possible en changeant, par exemple, la classe ou le type d’antidépresseurs destinés à ces femmes. Pendant la période de gestation, ils décrivent aussi que 92,3 % des femmes qui maintiennent leur traitement pendant la grossesse reçoivent un dosage adéquat, tandis que 7,7 % reçoivent un sous-dosage et aucune d’entre elles un surdosage [8]. On trouve également qu’une multitude de facteurs (l’âge maternel, le statut socio-économique, l’année de conception ou encore des facteurs cliniques comme la présence d’un diagnostic de dépression avant et/ou pendant la grossesse) favorise le maintien des antidépresseurs en début et en fin de grossesse [8]. Cette étude a par ailleurs été menée à partir de la cohorte « Médicaments et Grossesse », cohorte construite à des fins de recherche et réunissant des informations de nature très différentes sur les femmes de la province de Québec ayant reçu un diagnostic de grossesse entre 1998 et 2003 (Figure 1). Ce registre a été principalement mis sur pieds en jumelant les bases de données administratives de la Régie de l’assurance maladie du Québec (RAMQ), de MedEcho (données hospitalières), et de l’Institut de la statistique du Québec (ISQ), puis complété par l’envoi aux femmes d’un questionnaire personnalisé.  | Figure 1.
Le Registre « Médicaments et Grossesse ».
|
|
Risques et bénéfices associés à l’utilisation des antidépresseurs pendant la période de gestation pour la femme et son enfant Au regard du constat d’un manque de prise en charge adéquat des troubles psychiatriques pendant la période de gestation, la véritable question que l’on peut poser aujourd’hui est la suivante : a-t-on raison d’adopter cette attitude de méfiance vis-à-vis de l’utilisation des antidépresseurs pendant la période de gestation ou bien, au contraire, faudrait-il plutôt envisager l’utilisation de certaines classes d’antidépresseurs n’ayant pas été associées jusqu’à présent à des complications périnatales ? Le contre… Les publications récentes d’un avis émis par Santé Canada [
9], par le Food and Drug Administration (FDA) [
10] ainsi que la publication d’une étude par Chambers et al. [
11] dans le New England Journal of Medicine, peuvent laisser dubitative l’opinion publique quant à la réelle innocuité des antidépresseurs pendant la période de gestation. En effet, les deux organisations gouvernementales ont récemment émis des réserves quant à l’utilisation de la paroxetine (Paxil ®), un inhibiteur sélectif de la recapture de la sérotonine (ISRS), pendant le premier trimestre de grossesse parce qu’elle serait susceptible d’entraîner des malformations cardiaques chez le nouveau-né. De leur côté, Chambers et al. ont annoncé une relation de cause à effet entre l’utilisation des ISRS après la 20 e semaine de grossesse et l’hypertension pulmonaire chez le nouveau-né (ISRS versus aucun antidépresseur : adjusted Odds Ratio (aOR), 6,1 ; Intervalle de Confiance à 95 % (IC), 2,2-16,8) [ 11]. Peu de temps après, Bérard et al. ont confirmé ces craintes en suggérant également l’existence d’un lien entre la dose de paroxetine reçue pendant le premier trimestre de grossesse et la présence de malformations cardiaques (utilisatrices de > 25 mg/jour de paroxetine en moyenne versus utilisatrices de 0 mg/jour de paroxetine durant le premier trimestre de grossesse : aOR : 3,0 ; p < 0,05) [
12]. Par ailleurs, il est également important de mentionner qu’outre les malformations congénitales majeures, on a pu lire dans plusieurs publications spécialisées récentes que l’exposition aux ISRS pendant la grossesse pouvait être associée à la naissance de bébés hypotrophiques (différence entre le groupe exposé aux ISRS pendant la grossesse et le groupe non exposé : 0,033 ; p < 0,05), ainsi que de bébés atteints de détresse respiratoire (différence entre le groupe exposé aux ISRS pendant la grossesse et le groupe non exposé : 0,044 ; p < 0,01) [
13]. D’après ces études, il semble donc que l’exposition aux ISRS pendant la grossesse pourrait avoir un effet néfaste sur le nouveau-né. Le pour… Parallèlement, la publication d’une nouvelle étude, dans le Journal of the American Medical Association, sur le risque de ne pas traiter la dépression pendant la grossesse [
14], a pu semer à nouveau la confusion dans les esprits et renforcer l’idée que le rapport risque/bénéfice concernant l’utilisation des antidépresseurs pendant la période de gestation méritait d’être pris en considération avant d’interrompre inutilement une pharmacothérapie en cours chez la femme enceinte ou manifestant le désir de le devenir. En effet, Cohen et al. [
16] ont décrit les conséquences néfastes que pouvait engendrer un arrêt brusque des antidépresseurs durant la grossesse sur la mère en démontrant la possibilité d’un risque de rechute important pendant et après la gestation, allié à la présence de symptômes sévères de sevrage (femmes continuant leur pharmacothérapie pendant la grossesse contre femmes arrêtant leur traitement : hazard ratio, 5,0 ; 95 % IC, 2,8-9,1 ; p < 001). Les risques associés à une dépression non traitée en peripartum ne sont pas sans conséquences. En effet, les femmes atteintes de dépression ont un appétit moindre et sont plus à même de consommer alcool, tabac et drogues illicites, facteurs pouvant être préjudiciables au fœtus [
15, 16]. Préalablement, d’autres auteurs ont aussi rapporté ces faits et précisaient, de plus, que même après la reprise du traitement, plusieurs semaines pouvaient s’écouler avant que la dépression chez les femmes soit à nouveau totalement maîtrisée [
17]. De même, un traitement inadéquat de la dépression durant la grossesse favoriserait la dépression post-partum [
18] ; à ce sujet, les auteurs rappelaient également combien il était important qu’une femme soit traitée de manière optimale pendant la période périnatale afin qu’elle puisse s’occuper de façon adéquate de son enfant après l’accouchement. En effet, tout comme la dépression non traitée durant la grossesse, il a déjà été démontré qu’une dépression non contrôlée en période post-partum avait aussi des conséquences négatives sur l’enfant et sur sa croissance puisque le rôle de la mère est vital pour ce dernier afin d’en assurer la sécurité, la survie et le bien-être [
19]. De plus, les publications se veulent plutôt rassurantes quant à l’utilisation des antidépresseurs après la grossesse [
20–
22] et cela malgré quelques cas rapportés où des enfants semblaient avoir connu quelques effets transitoires (vomissements, diarrhée, etc.) attribuables sans doute au passage des antidépresseurs, notamment celui des ISRS, dans le lait maternel [
23,
24]. De leur côté, Ramos et al., en utilisant à nouveau le registre « Médicaments et Grossesse », ont publié aussi des résultats très rassurants au sujet de l’utilisation des antidépresseurs pendant la grossesse sur le fœtus. En effet, ils ont démontré tout récemment qu’il ne semblait pas y avoir d’association entre la durée d’exposition aux antidépresseurs pendant le premier trimestre de grossesse, période correspondant à l’organogenèse (période la plus critique pour le développement de l’enfant), et les malformations congénitales majeures, quelle que soit la classe d’antidépresseurs utilisée pendant la gestation (1-30 jours contre 0 jour : aOR, 1,23 ; IC 95 %, 0,77-1,98 ; 31-60 jours contre 0 jour : aOR, 1,03 ; IC 95 %, 0,63-1,69 ; ≥ 61 jours contre 0 jour : aOR, 0,92 ; IC 95 %, 0,50-1,69) [
25]. Cependant, compte tenu de la nature des données disponibles, seuls les antidépresseurs regroupés par classe ont pu être étudiés : il n’a donc pas été possible de les étudier individuellement et d’examiner tout particulièrement le cas préoccupant de la paroxetine. Une prise de position est-elle alors possible ? Enfin, s’il est vrai qu’un certain nombre d’informations sont actuellement disponibles dans les données scientifiques concernant l’exposition aux antidépresseurs pendant la période gestationnelle, il n’en demeure pas moins que la plupart des études comportent des faiblesses qui en altèrent la qualité et qu’une prise de position reste toujours aussi difficile devant des résultats contradictoires. Il suffit de considérer, par exemple, la controverse suscitée par la publication de Chambers et al. soulignée en particulier par un éditorial du Journal of Psychiatry and Neuroscience qui a connu un certain retentissement [
26]. De plus, la difficulté éprouvée par les chercheurs à suivre les enfants sur une longue période après leur naissance et ainsi d’être en mesure d’évaluer l’effet des antidépresseurs sur leur développement cognitif vient compliquer davantage encore la décision à prendre. Oberlander et al. [
27] publient des résultats rassurants à ce sujet en rapportant qu’il n’y a pas de différence, selon le Child Behavior Checklist, entre les enfants exposés in utero aux antidépresseurs et les enfants non exposés en ce qui a trait à leur attention, leur impulsivité, etc. Cependant, à nouveau, cette étude a été vivement critiquée [
28] à cause, entre autres, de la taille trop faible de son échantillon et ainsi de son incapacité à pouvoir détecter une différence significative entre les deux groupes à l’étude (22 enfants exposés aux ISRS et 14 enfants non exposés). Une étude de ce type est d’ailleurs depuis 2006 en cours au CHU Sainte-Justine. Elle vise principalement à recruter, au Canada et aux États-Unis, 400 femmes sous antidépresseurs, à les suivre pendant et après leur grossesse, puis à observer le développement neurocomportemental de leurs enfants entre l’âge de 1 et 6 ans. La comparaison des enfants à l’étude se fera en réalité entre les femmes qui auront continué de prendre leurs antidépresseurs et celles qui auront arrêté leur pharmacothérapie. Enrichir la somme d’informations fiables et, à cette fin, encourager la recherche dans ce sens paraît indispensable pour conduire à une prise de position concernant l’utilisation des antidépresseurs pendant la grossesse qui soit la meilleure possible pour la santé de la mère et celle de son enfant. |
La prescription des antidépresseurs durant la grossesse relève d’un véritable défi. Aucun médicament, qu’il s’agisse ou non d’un antidépresseur, n’est absolument sûr pendant la période de gestation. Dans la mesure où il n’a pas été établi de lien formel de causalité entre les malformations observées et l’utilisation appropriée d’antidépresseurs pendant la grossesse, il convient de ne pas en écarter la prescription. En effet, l’arrêt inopportun des antidépresseurs entraîne un taux certain de rechute provoquant souvent un effet néfaste sur la grossesse et l’enfant. D’une façon générale, il reste souhaitable que chaque femme présentant un profil particulier soit traitée de manière individuelle car le rapport risque/bénéfice demeure toujours prioritaire. Ainsi, l’importante décision à laquelle devront donc faire face les professionnels de la santé sera de sélectionner des traitements qui auront un maximum d’efficacité chez la mère et un minimum d’effets secondaires à la fois chez la mère et son enfant. |
Anick Bérard est détentrice d’une bourse de carrière des Instituts de recherche en santé du Canada (IRSC) et de la Fondation pour la santé du Canada. Elle est également titulaire de la Chaire sur les Médicaments, la grossesse et l’allaitement à la faculté de pharmacie de l’Université de Montréal. Élodie Ramos détient une bourse de doctorat de la Fondation de l’Hôpital Sainte-Justine.
|
1. Wisner KL, Gelenberg AJ, Leonard H, et al. Pharmacologic treatment of depression during pregnancy. JAMA 1999; 282 : 1264–9 2. Gentile S. The safety of newer antidepressants in pregnancy and breastfeeding. Drug Saf 2005; 28 : 137–52. 3. Koren G, Pastuszak A, Ito S. Drugs in pregnancy. N Engl J Med 1998; 338 : 1128–37. 4. Bérard A, Oraichi D. Development of a surveillance and signal detection system to monitor medication exposure during pregnancy and lactation. Pharmacoepidemiol Drug Saf 2004; 13 : S1-334 (253). 6. International Clearinghouse for Birth Defects Monitoring Systems, Annual report Rome : ICBDMS, 2003. 7. Einarson A, Selby P, Koren G. Abrupt discontinuation of psychotropic drugs during pregnancy : fear of teratogenic risk and impact of counselling. J Psychiatry Neurosci 2001; 26 : 44–8. 8. Ramos E, Oraichi D, Rey E, et al. Prevalence and predictors of antidepressant use in a cohort of pregnant women. Br J Obstet Gynecol 2007; 114 : 1055–64. 11. Chambers CD, Hernandez-Diaz S, Van Marter LJ, et al. Selective serotonin-reuptake inhibitors and risk of persistent pulmonary hypertension of the newborn. N Engl J Med 2006; 354 : 579–87. 12. Bérard A, Ramos E, Rey E, et al. First trimester exposure to paroxetine and risk of cardiac malformations in infants : the importance of dosage. Birth Defects Res B Dev Reprod Toxicol 2007; 80 : 18–27. 13. Oberlander TF, Warburton W, Misri S, et al. Neonatal outcomes after prenatal exposure to selective serotonin reuptake inhibitor antidepressants and maternal depression using population-based linked health data. Arch Gen Psychiatry 2006; 63 : 898–906. 14. Cohen LS, Altshuler LL, Harlow BL, et al. Relapse of major depression during pregnancy in women who maintain or discontinue antidepressant treatment. JAMA 2006; 295 : 499–507. 15. Lou HC, Hansen D, Nordentoft M, et al. Prenatal stressors of human life affect fetal brain development. Dev Med Child Neurol 1994; 36 : 826–32. 16. Orr ST, Miller CA. Maternal depressive symptoms and the risk of poor pregnancy outcome. Review of the literature and preliminary findings. Epidemiol Rev 1995; 17 : 165–71. 17. Dominguez RA, Goodnick PJ. Adverse events after the abrupt discontinuation of paroxetine. Pharmacotherapy 1995; 15 : 778–80. 18. Buist A. Perinatal depression : assessment and management. Aust Fam Physician 2006; 35 : 670–3. 19. Beck CT. The effects of postpartum depression on maternal-infant interaction : a meta-analysis. Nurs Res 1995; 44 : 298–304. 20. Yoshida K, Smith B, Craggs M, Kumar RC. Investigation of pharmacokinetics and of possible adverse effects in infants exposed to tricyclic antidepressants in breast-milk. J Affect Disord 1997; 43 : 225–37. 21. Wisner KL, Perel JM. Serum nortriptyline levels in nursing mothers and their infants. Am J Psychiatry 1991; 148 : 1234–6. 22. Wisner KL, Perel JM, Foglia JP. Serum clomipramine and metabolite levels in four nursing mother-infant pairs. J Clin Psychiatry 1995; 56 : 17–20. 23. Wisner KL, Perel JM, Findling RL. Antidepressant treatment during breast-feeding. Am J Psychiatry 1996; 153 : 1132–7. 24. Baum AL, Misri S. Selective serotonin-reuptake inhibitors in pregnancy and lactation. Harv Rev Psychiatry 1996; 4 : 117–25. 25. Ramos E, St-André M, Rey E, Bérard A. Risk of congenital malformations associated with duration of exposure to antidepressants during the gestational period. Br J Psychiatry 2007 (accepté pour publication). 26. Blier P. Pregnancy, depression, antidepressants and breast-feeding. J Psychiatry Neurosci 2006; 31 : 226–8. 27. Oberlander TF, Reebye P, Misri S, et al. Externalizing and attentional behaviors in children of depressed mothers treated with a selective serotonin reuptake inhibitor antidepressant during pregnancy. Arch Pediatr Adolesc Med 2007; 161 : 22–9. 28. Rubinow DR. Antidepressant treatment during pregnancy : between Scylla and Charybdis. Am J Psychiatry 2006; 163 : 954–6. |