| |
| Med Sci (Paris). 2007 October; 23(10): 791–793. Published online 2007 October 15. doi: 10.1051/medsci/20072310791.Réparer ou régénérer,il faut choisir… Daniel Aberdam* INSERTECH, Inserm U634, Faculté de Médecine de Nice, 28, avenue Valombrose, 06107 Nice, France Rappaport Institute of the Technion, 1, Efron Street, PO Box, Haïfa 31096, Israël MeSH keywords: Alopécie, Animaux, Épiderme, Follicule pileux, Humains, Souris, Souris transgéniques, Cellules souches multipotentes, Régénération, Spécificité d'espèce, Protéines de type Wingless, Cicatrisation |
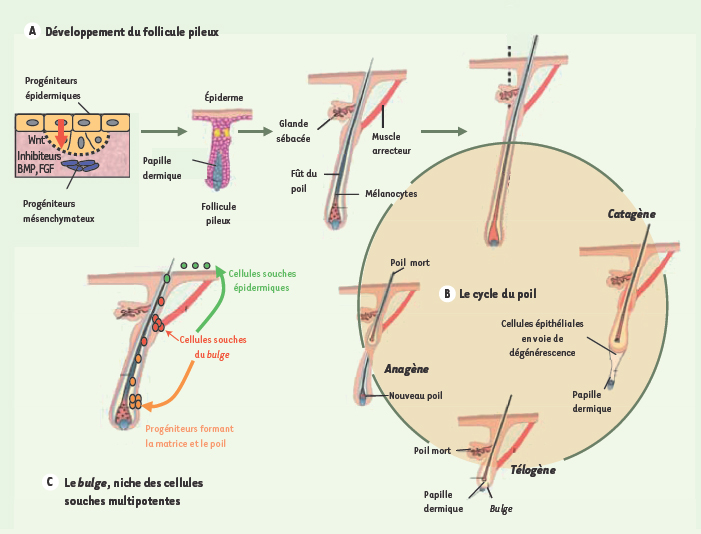
Le dogme : les follicule pileux ne régénèrent pas Le follicule pileux est un organe complexe, constitué d’au moins dix sortes de cellules épithéliales différentes, qui se forme au cours du développement embryonnaire et subit des cycles de croissance, de régression et de repos (Figure 1). À la naissance, notre stock de follicules primordiaux est déjà destiné et en aucun cas de nouveaux follicules pileux ne peuvent être formés de novo. C’est la raison pour laquelle les greffes cutanées déposées sur les grands brûlés sont déficientes en poils. Une fois mort, le follicule pileux n’est pas remplacé. La perte d’un follicule à l’âge adulte était donc considérée jusqu’à récemment comme définitive.  | Figure 1.
Formation et cycle du follicule pileux. A. Chez l’embryon, les progéniteurs épidermiques issus de l’ectoderme sécrètent Wnt (flèche rouge). Certains y répondent également et sont soumis à l’influence du mésenchyme sous-jacent qui sécrète des inhibiteurs de BMP et du FGF. La combinaison de ces signaux enclenche la formation de la placode, à l’origine du futur follicule, par invagination des cellules épidermiques dans le derme. B. À maturation, en période post-natale, le follicule pileux subit un cycle de 3 phases : catagène, correspondant à l’apoptose et à la régression de la partie inférieure du follicule ; pendant la phase dite télogène, la papille dermique vient au contact du bulge ; puis, la phase anagène correspond à l’activation (via des facteurs diffusibles) des cellules souches du bulge et à la formation d’un nouveau poil. C. Le bulge (« rondeur » en anglais) correspond à la niche des cellules souches multipotentes. Celles-ci vont donner naissance d’une part aux cellules souches interfolliculaires épidermiques, activées par les blessures superficielles de la peau, et aux progéniteurs folliculaires, activés au cours de la phase anagène du cycle du follicule, et responsables de la formation du nouveau fût contenant le poil, et des poils eux-mêmes (adapté de [
5] avec la permission d’Elaine Fuchs et MacMillan Publishers Ltd, Nature © 2007). |
Or, une étude récente du groupe de G. Cotsarelis démontre que la peau cicatricielle de souris blessées produit de nouveaux poils sur la zone endommagée [
1]. Cette découverte est importante car elle démontre pour la première fois la capacité régénératrice de novo d’un organe chez les mammifères. En effet, contrairement à certains amphibiens, les mammifères ont une capacité très limitée de régénération d’organes ou de cellules. Les blessures se réparent par simple cicatrisation et l’amputation d’un membre est irréversible. Même le foie, dont on connaît la remarquable efficacité à reconstituer son volume lorsqu’il est partiellement amputé, ne pourrait en aucun cas se régénérer après une amputation totale. Alors que certains amphibiens sont capables de régénérer des membres complets en cas d’amputation, probablement par reprogrammation de cellules différenciées en cellules souches, sans parler de l’hydre qui possède des cellules pluripotentes lui permettant de se reconstituer même à partir d’un petit fragment. Une des hypothèses pour expliquer cette différence entre les espèces (dont l’homme) qui réparent, et celles qui régénèrent, est que nous ne disposerions pas de cellules souches en quantité et qualité suffisantes, ou que nous serions incapables de transmettre ou de reconnaître des signaux chimiques régénératifs. La découverte de G. Cotsarelis remettrait donc en cause ce dogme bien ancré. Le follicule pileux est une annexe cutanée qui résulte d’interactions épithélio-mésenchymateuses établies au cours de la vie embryonnaire, par invagination de l’ectoderme dans le derme sous-jacent (Figure 1A). Poils et cheveux sont ainsi formés avant la naissance. Le follicule pileux a l’unique propriété de se renouveler de façon cyclique, asynchrone et aléatoire, à partir d’un réservoir de cellules souches localisées dans le bulge du follicule [
2]. Le cycle pileux est constitué de différentes phases : la phase de croissance, la phase d’involution ou de régression et la phase de repos (Figure 1B). Chaque cheveu a son propre cycle, indépendant de celui des cheveux voisins. Le follicule apparaît donc comme un organe complexe et autonome, avec son propre contrôle endocrinien autocrine et paracrine, son cycle et sa propre homéostasie. |
Chute du dogme : néoformation de follicules pileux à partir de cellules souches épidermiques Pour déterminer expérimentalement l’origine des cellules participant à la réparation cutanée, l’équipe américaine a produit et croisé des souris transgéniques dans lesquelles on peut induire de façon inductible une marque génétique (gène LacZ) soit dans les cellules souches du bulge folliculaire soit dans celles de l’épiderme interfolliculaire (Figure 1C). Les souris adultes ont été blessées par de larges plaies sur le dos (1 à 2 cm2) que l’on a laissé cicatriser spontanément sans suture. La surprise a été d’observer, dès la troisième semaine, la formation de nouveaux poils au centre de la blessure. En histologie, on retrouve les différentes étapes de la formation folliculaire qui normalement n’a lieu que durant l’embryogenèse (Figure 1A). Des placodes apparaissent, suivies de nouveaux follicules pileux complets contenant des poils et autre glande sébacée jusqu’à se confondre avec les poils de l’animal. Hormis l’absence de pigmentation (due à l’absence de migration des mélanocytes), la structure du poil, son orientation et son cycle de régénération/repos sont identiques à ceux de la souris hôte. Étonnamment, ces structures expriment des marqueurs spécifiques du follicule embryonnaire comme la cytokératine K17, lef1, Wnt10a and Shh (sonic hedgehog) et contiennent au niveau de leur bulge un stock de cellules souches. De manière surprenante, les nouveaux follicules ne sont pas produits à partir de cellules souches du bulge présentes sur les berges de la plaie, comme l’on pouvait s’y attendre, mais par des cellules souches épidermiques présentes dans la couche basale de l’épiderme et qui, en temps normal, ne produisent pas de poils. Ces observations sont d’autant plus étonnantes qu’il est maintenant clairement établi que, si les cellules souches du bulge sont multipotentes et participent à la régénération non seulement du follicule pileux pendant le cycle mais également, dans le cas de blessure, à celle de l’épiderme, à l’inverse, les cellules souches épidermiques ne participent qu’au renouvellement de l’épiderme interfolliculaire [
3,
4]. On peut donc penser que l’environnement cicatriciel reproduit l’environnement qui prévaut à un stade embryonnaire, y compris les signaux chimiques qui accompagnent le développement in utero des futurs poils. |
Wnt est un acteur crucial de la régénération du follicule pileux chez l’adulte De nombreuses études utilisant des modèles murins transgéniques ont démontré le rôle majeur de la voie de signalisation Wnt, et plus particulièrement de son effecteur la β-caténine, dans la destinée folliculaire de l’épiderme embryonnaire [5] (Figure 1A). Il en est de même dans la production de poils après blessure : lorsque la voie de Wnt est bloquée par son inhibiteur naturel Dkk1 (dickkopf 1), ou que le gène de la β-caténine a été inactivé, le nombre de nouveaux poils après cicatrisation est considérablement réduit. Au contraire, l’activation de cette voie par le ligand purifié soluble Wnt7a stimule la régénération d’un nombre supérieur de nouveaux poils. C’est donc la première démonstration que des ligands solubles de Wnt sont capables de stimuler la néoformation de follicules pileux. En inactivant par transgenèse la voie de Wnt spécifiquement dans les cellules épidermiques, les auteurs confirment que ce sont bien les cellules souches de l’épiderme, et non celles du bulge, qui assurent cette régénération. Dès lors que la blessure est suffisamment importante, la cicatrisation déclencherait donc un processus de régénération couplé à la réparation. Cette observation exceptionnelle confirme que l’environnement dans lequel sont nichées les cellules souches est primordial pour leur destinée et l’expression de leur plasticité. Ce phénomène a été reproduit par les auteurs sur trois lignées de souris de fond génétique différent mais n’a pas pu être reproduit sur des souris BalbC. |
Comment est-on passé à côté de cette observation importante ? En général, on évite de laisser de larges plaies ouvertes en suturant et stimulant la fermeture de la plaie. On favorise ainsi de manière globale la réparation, au détriment donc d’une possible régénération, en particulier des annexes cutanées. Chez les mammifères, le risque vital qu’entraînent de larges plaies a certainement amplifié ce déséquilibre entre réparation et régénération. On savait déjà que les cicatrices sont dues à la fermeture trop rapide des plaies, empêchant ainsi une réparation complète et efficace, contrairement à la cicatrisation fœtale [
6]. De plus, dans l’étude de G. Cotsarelis, l’efficacité de la repousse des nouveaux poils dépend de la taille (importante) de la zone de peau cicatrisée. Or, en général, les blessures infligées aux souris sont plus petites, ce qui explique peut-être pourquoi ce potentiel de régénération avait été ignoré. En fait, des observations similaires de régénération spontanée de follicules pileux après blessures cutanées avaient été rapportées dans les années 1950 chez les mammifères, mais les technologies appropriées n’étant pas disponibles à l’époque, la preuve d’une régénération complète des follicules n’avait pas été établie [
7]. |
Ces découvertes, concluent les chercheurs, pourraient ouvrir de nouvelles perspectives dans le traitement de la chute de cheveux (alopécie) en contrôlant la voie Wnt. Cependant, de nombreux points restent à vérifier avant d’envisager une application chez l’homme, ce d’autant que la physiopathologie est très différente entre la souris et l’homme. Pire, l’activation de la voie de Wnt/β-caténine produit, chez la souris transgénique, des tumeurs folliculaires [
8]. Comme on peut difficilement modifier le contexte individuel de l’alopécie (testostérone, contexte héréditaire…), il est peu probable que l’on puisse, par simple activation de Wnt, empêcher à nouveau la perte des cheveux éventuellement néoformés. Il faut également rappeler que la peau des brûlés ne produit jamais de follicules pileux lorsqu’elle cicatrise. Enfin, il paraît difficile d’imaginer transposer les conditions peu enviables de cette approche d’une large plaie, sans sutures, restée ouverte jusqu’à la cicatrisation. Donc, attention, amis lecteurs chauves, ne vous scalpez pas le crâne pour quelques cheveux ! |
1. Ito M, Yang Z, Andl T, et al. Wnt-dependent de novo hair follicle regeneration in adult mouse skin after wounding. Nature 2007; 447 : 316–20. 2. Cotsarelis G. Epithelial stem cells : a folliculocentric view. J Invest Dermatol 2006; 126 : 1459–68. 3. Claudinot S, Nicolas M, Oshima H, et al. Long-term renewal of hair follicles from clonogenic multipotent stem cells. Proc Natl Acad Sci USA 2005; 102 : 14677–82. 4. Levy V, Lindon C, Zheng Y, et al. Epidermal stem cells arise from the hair follicle after wounding. FASEB J 2007; 21 : 1358–66. 5. Fuchs E. Scratching the surface of skin development. Nature 2007; 445 : 834–42. 6. Schäfer M, Werner S. Transcriptional control of wound repair. Annu Rev Cell Dev Biol 2007 online. 7. Kligman AM, Strauss JS. The formation of vellus hair follicles from human adult epidermis. J Invest Dermatol 1956; 27 : 19–23. 8. Owens DM, Watt FM. Contribution of stem cells and differentiated cells to epidermal tumours. Nat Rev Cancer 2003; 3 : 444–51. |