| |
| Med Sci (Paris). 2006 December; 22(12): 1028–1031. Published online 2006 December 15. doi: 10.1051/medsci/200622121028.Les canalopathies calciques Bilan et perspectives Philippe Lory,* Isabelle Bidaud, Alexandre Mezghrani, and Arnaud Monteil Département de Physiologie, Institut de Génomique Fonctionnelle (IGF), CNRS UMR 5203, Inserm U661, Universités de Montpellier I et II, 141, rue de la Cardonille, 34094 Montpellier Cedex 05, France MeSH keywords: Animaux, Calcium, Canaux calciques, Canaux calciques de type P, Canaux calciques de type Q, Canalopathies, Humains, Modèles biologiques, Mutation |
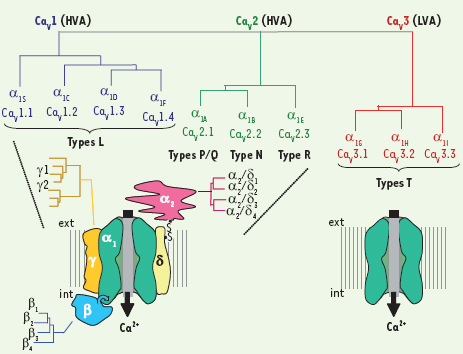
Les canalopathies calciques représentent un groupe hétérogène de maladies héréditaires comprenant paralysie périodique, migraine, ataxie, rétinite pigmentaire, épilepsie et autisme. Souvent de transmission dominante, elles ont en commun d’être associées à des mutations dans les gènes des canaux calciques activés par la dépolarisation membranaire (canaux CaV) (Figure 1) et, comme la plupart des canalopathies, présentent un caractère épisodique ou sporadique des manifestations de la maladie : une signature clinique caractéristique d’une atteinte électrophysiologique. Toutefois, bon nombre des mutations conduisent à des altérations électrophysiologiques discrètes, rendant l’interprétation des relations génotype-phénotype difficile. L’objectif des études actuelles est multiple tant sur le plan fondamental que clinique : précision du diagnostic, compréhension du dysfonctionnement des canaux, développement de stratégies thérapeutiques. Toutefois, le chemin est long depuis l’interprétation du dysfonctionnement du canal jusqu’à la compréhension des mécanismes physiopathologiques chez le patient et leur traitement. Nous tentons d’identifier ici quelques faits marquants et les défis actuels des études des canalopathies calciques.  | Figure 1.
Les trois grandes familles de canaux calciques CaV comprenant : les canaux à haut seuil d’activation (HVA) CaV1 de type L (
long lasting
), les canaux CaV2 neuronaux (types N, P/Q et R) et les canaux à bas seuil d’activation (LVA) CaV3 de type T (
transient ou tiny
). Le répertoire des protéines codant pour les dix sous-unités canalaires (CaV ou α1) est identifié depuis la fin des années 1990. Par opposition aux canaux CaV3 de type T pour lesquels on ne connaît pas de sous-unités associées, les canaux HVA forment un complexe hétéromultimérique associant les sous-unités régulatrices α2/δ, β et γ, dont de nombreux gènes et isoformes sont identifiés. |
|
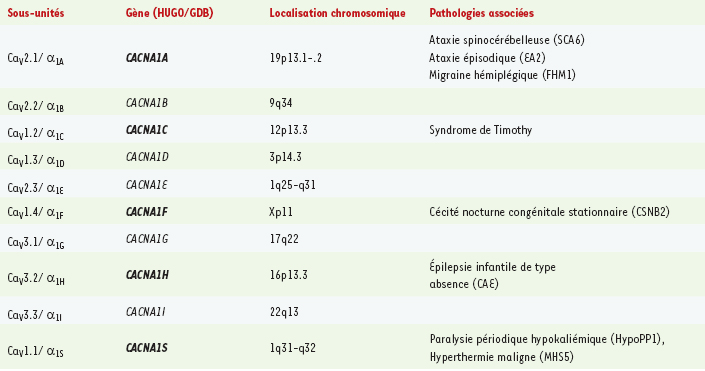
Canaux Ca V de type L (Ca V1) La paralysie périodique hypokaliémique (HypoPP1) fut la première maladie génétique humaine autosomale dominante associée à des mutations d’un canal CaV (CaV1.1) du muscle squelettique (Tableau I). Toutefois, il n’a pas été possible jusqu’à ce jour d’établir une corrélation claire entre ces mutations faux-sens et le tableau clinique observé [
1].  | Tableau I.
Localisation chromosomique des dix gènes codant les sous-unités canalaires CaV. Des mutations ont été découvertes dans les trois grandes familles de canaux CaV (en gras : les gènes porteurs de mutations). L’ensemble des caractéristiques de ces gènes et des pathologies indiquées est consultable sur les sites de HUGO/GDB : http://www.gdb.org/hugo/ ou http://www.gene.ucl.ac.uk/nomenclature/ et de OMIM : http://www.ncbi.nlm.nih.gov/entrez/query.fcgi ?db=OMIM
|
Tout récemment, des mutations responsables du syndrome de Timothy ont été identifiées dans le gène CACNA1C codant pour la sous-unité CaV1.2 [
2]. Cette maladie très rare comporte un trouble de la conduction cardiaque (LQT8), une syndactylie des mains et des pieds, des anomalies morphologiques faciales, un déficit immunitaire et des troubles neuropsychiatriques s’apparentant à l’autisme. La gravité de ce syndrome peut s’expliquer par le caractère ubiquitaire et la précocité de l’expression de ce canal. Ces mutations réduisent de façon importante l’inactivation du courant calcique : un mécanisme protégeant d’une surcharge calcique les cellules exprimant ce canal. Les deux mutations identifiées à ce jour impliquent un épissage différentiel de deux exons (8 et 8A). Alors que les conséquences électrophysiologiques des deux mutations sont proches en expression hétérologue, les patients atteints par l’une ou l’autre des mutations présentent des signes cliniques distincts, probablement lié à l’expression différentielle des exons 8 et 8A dans les nombreux tissus et cellules où le canal CaV1.2 est actif. À l’image de la sous-unité CaV1.1, spécifique du muscle squelettique, CaV1.4 code pour un canal L presque exclusivement au niveau de la rétine. Plus de 20 mutations ont été identifiées dans CACNA1F, le gène correspondant. Elles sont associées à une forme de cécité nocturne congénitale stationnaire (CSNB2), une dysfonction rétinienne non évolutive et concernant préférentiellement les bâtonnets. Bon nombre sont des mutations non-sens et entraînent une perte de fonction dans la mesure où les protéines canalaires sont tronquées et incapables de permettre un influx de Ca2+ dans la cellule. Leurs conséquences fonctionnelles précises sont encore mal connues. Chez la souris, l’inactivation du gène cacna1f affecte le profil électrorétinographique, la transmission synaptique et l’organisation cellulaire de la rétine [
3], des atteintes proches de celles observées chez les patients CSNB2. |
Canaux Ca V de type P/Q (Ca V2.1) Le gène CACNA1A codant pour la sous-unité CaV2.1 des canaux neuronaux P/Q est porteur de nombreuses mutations responsables de plusieurs maladies neurologiques à transmission dominante : FHM1, EA2 et SCA6 (Table 1), ainsi que de nombreuses formes intermédiaires de ces pathologies. Les études effectuées en expression hétérologue ne permettent pas toujours une interprétation aisée des relations génotype-phénotype pour certaines de ces mutations [
4]. Une récente étude chez l’animal apporte un éclairage nouveau sur le mécanisme physiopathologique : l’introduction in vivo d’une mutation FHM1 (R192Q) par une stratégie de knock-in [
5] résulte en une augmentation significative de la densité de courant P/Q dans les neurones du cervelet, une augmentation de la neurotransmission à la jonction neuromusculaire et un seuil abaissé de dépression corticale qui sous-tend l’aura migraineuse. Ces données suggèrent qu’une augmentation de l’activité des canaux P/Q, donc un gain de fonction, serait à la base de FHM1. Une augmentation de l’adressage membranaire et/ou une distribution neuronale anormale des canaux FHM1 sont également envisagées. Concernant les mutations EA2, un certain nombre d’entre elles engendrent des formes tronquées de CaV2.1 qui ne produisent pas de canaux fonctionnels. D’autres sont des mutations faux-sens qui affectent considérablement la densité de courant calcique, suggérant que les mutations EA2 sont « perte de fonction ». L’hypothèse jusqu’à présent avancée pour expliquer l’effet fonctionnel des mutations EA2 est l’haplo-insuffisance : la présence d’un allèle porteur d’une mutation EA2 réduirait de ~ 50 % le nombre de canaux P/Q fonctionnels. Cette explication n’est pas satisfaisante au regard des données obtenues sur les souris inactivées pour le gène cacna1a puisque les animaux hétérozygotes ne sont pas ataxiques [4]. EA2 étant de transmission dominante, une alternative récemment proposée est que les formes EA2 de CaV2.1 joueraient un rôle dominant négatif, réduisant significativement la fraction de canaux P/Q fonctionnels à la membrane plasmique [
6]. Un défi actuel est d’identifier le mécanisme moléculaire impliqué dans ce phénomène de dominance négative à la base de l’EA2. Une autre étude suggère que certaines formes CaV tronquées pourraient interagir avec le canal pleine longueur et activer un stress cellulaire enclenchant un processus protecteur de type unfolded protein response, affectant la synthèse protéique [
7]. Une autre énigme concerne la dégénérescence progressive des cellules de Purkinje du cervelet dans SCA6. Les mutations SCA6 affectent un domaine polyglutamine de l’extrémité C-terminale de CaV2.1 (exon 47). La taille normale de la répétition est de 18 codons CAG au plus, alors qu’une répétition égale ou supérieure à 20 codons entraîne une expression de la maladie. Plusieurs études ont identifié le caractère toxique des formes SCA6 de CaV2.1, la formation d’aggrégats intracellulaires et une altération des propriétés électrophysiologiques [
8]. Une étude récente montre que la région carboxy-terminale de CaV2.1 peut être clivée et adressée au noyau [
9] et qu’une région carboxy-terminale porteuse d’expansion polyglutamine s’avère particulièrement toxique pour la cellule. |
Canaux Ca V de type T (Ca V3.2) Les canaux calciques de type T sont activés par de faibles dépolarisations membranaires (LVA) et sont codés par trois gènes CACNA1G, CACNA1H et CACNA1I récemment caractérisés (Table 1). Des mutations du gène CACNA1H codant CaV3.2 ont été identifiées chez des patients CAE dans la population chinoise [
10]. L’étude in vitro de ces mutations ne révélant pas d’altération majeure des propriétés électrophysiologiques [
11], l’éventuel dysfonctionnement des canaux CaV3.2 doit être recherché ailleurs. Les mutations CAE favoriseraient l’adressage membranaire de CaV3.2, suggérant que l’atteinte primaire de ces canaux mutés concerne leur trafic cellulaire plutôt que les propriétés électrophysiologiques. |
Perspectives offertes par l’étude des mutations des canaux calciques Les canalopathies calciques sont des maladies génétiques rares. L’identification grandissante de mutations dans les gènes codant pour les canaux calciques a favorisé le développement de leur diagnostic génétique, mais il reste toutefois un pas immense entre diagnostic et traitement. L’effort effectué sur le plan de la génétique clinique, la recherche de mutations et leur analyse fonctionnelle a favorisé les interactions entre cliniciens et chercheurs, organisés en réseaux pour une meilleure interprétation des relations génotype-phénotype de ces pathologies. L’intérêt de ces études se situe à plusieurs niveaux. Elles permettent une meilleure compréhension des bases moléculaires du fonctionnement des canaux CaV. L’étude in vitro des mutations est assimilable à une forme d’étude structure-fonction « inverse » du canal puisque les conséquences in vivo sont connues. L’étude des canalopathies génétiques ouvre aussi des perspectives intéressantes pour la compréhension des mécanismes potentiellement mis en jeu dans les formes communes, ou acquises, de ces pathologies (exemple : migraine, épilepsie) et indique également l’intérêt potentiel d’évaluer ces canaux comme candidats dans des pathologies plus complexes, à caractère multigénique (exemple : autisme, épilepsie). Par ailleurs, l’étude des mécanismes moléculaires impliqués dans la dégénérescence neuronale dans les formes EA2 ou SCA6 pourrait renseigner sur les mécanismes mis en jeu dans le vieillissement. Toute évolution dans la compréhension mécanistique des canalopathies calciques devrait à terme ouvrir sur des perspectives thérapeutiques mieux définies. Pour cela, il convient de développer les modèles d’études mimant au mieux les pathologies humaines. Suite aux études in vitro, en expression hétérologue, le développement de modèles animaux porteurs des mutations humaines (knock-in) présente un grand potentiel [5], non seulement pour l’étude du mécanisme et de l’évolution des pathologies, mais également pour la recherche de molécules, ou d’autres stratégies thérapeutiques, capables de corriger ou d’atténuer les défauts identifiés. |
1. Miller TM, Dias da Silva MR, Miller HA, et al. Correlating phenotype and genotype in the periodic paralyses. Neurology 2004; 63 : 1647–55. 2. Splawski I, Timothy KW, Decher N, et al. Severe arrhythmia disorder caused by cardiac L-type calcium channel mutations. Proc Natl Acad Sci USA 2005; 102 : 8089–96 3. Mansergh F, Orton NC, Vessey JP, et al. Mutation of the calcium channel gene Cacna1f disrupts calcium signaling, synaptic transmission and cellular organization in mouse retina. Hum Mol Genet 2005; 14 : 3035–46. 4. Pietrobon D. Calcium channels and channelopathies of the central nervous system. Mol Neurobiol 2002; 25 : 31–50. 5. Van den Maagdenberg AM, Pietrobon D, Pizzorusso T, et al. A Cacna1a knockin migraine mouse model with increased susceptibility to cortical spreading depression. Neuron 2004; 41 : 701–10. 6. Jeng CJ, Chen YT, Chen YW, et al. Dominant-negative effects of human P/Q-type Ca2+ channel mutations associated with episodic ataxia type 2. Am J Physiol Cell Physiol 2006; 290 : C1209–20. 7. Page KM, Heblich F, Davies A, et al. Dominant-negative calcium channel suppression by truncated constructs involves a kinase implicated in the unfolded protein response. J Neurosci 2004; 24 : 5400–9. 8. Gomez CM. Polyglutamine aggregates in SCA6 Purkinje cells: a tail of two toxicities. Neurology 2001; 56 : 1618–9. 9. Kordasiewicz HB, Thompson RM, Clark HB, et al. Carboxyl termini of P/Q-type Ca2+ channel-1A subunits translocate to nuclei and promote polyglutamine-mediated toxicity. Hum Mol Genet 2006; 15 : 1587–99. 10. Chen Y, Lu J, Pan H, et al. Association between genetic variation of CACNA1H and childhood absence epilepsy. Ann Neurol 2003; 54 : 239–43. 11. Vitko I, Chen Y, Arias JM, et al. Functional characterization and neuronal modeling of the effects of childhood absence epilepsy variants of CACNA1H, a T-type calcium channel. J Neurosci 2005; 25 : 4844–55. |