| |
| Med Sci (Paris). 2006 November; 22(11): 1003–1006. Published online 2006 November 15. doi: 10.1051/medsci/200622111003.Cibler CD44 pour éradiquer les cellules souches leucémiques ? Florence Smadja-Joffe1* and Laure Coulombel2* 1Inserm U718, Hôpital Saint-Louis, 16, rue de la Grange aux Belles, 75010 Paris, France 2médecine/sciences et Inserm U602, Hôpital Paul Brousse, Villejuif, France MeSH keywords: Antigènes CD, Antigènes CD44, Adhérence cellulaire, Humains, Leucémies, Transduction du signal, Cellules souches |
La découverte récente, parmi les cellules leucémiques des patients atteints de leucémies aiguës myéloïdes (LAM) et de leucémies myéloïdes chroniques (LMC), d’une organisation hiérarchique calquée sur celle de l’hématopoïèse normale, incluant une petite sous-population de cellules souches leucémiques (CSL), a modifié notre réflexion thérapeutique. Ces CSL, qui donnent naissance à l’ensemble du clone malin, sont les cibles thérapeutiques essentielles, mais leur quiescence les rend insensibles à la chimiothérapie, expliquant les récidives. L’identification de propriétés spécifiques de ces CSL, qui les distingueraient des CSH normales, est donc essentielle à la mise au point de nouvelles thérapeutiques éradiquant les CSL, tout en épargnant au maximum les cellules souches de l’hématopoïèse normale (CSH normales). Un domaine de recherche privilégié est celui des relations du microenvironnement de la moelle osseuse, ou niche hématopoïétique, avec les CSL et les CSH. Deux articles récents publiés dans Nature Medicine [
1,
2] montrent pour la première fois qu’in vivo dans des modèles murins, la molécule d’adhérence CD44 est essentielle au développement des CSL tant dans les LAM que dans les LMC. Le ciblage du CD44 (par des anticorps monoclonaux, spécifiques dans les LAM, et l’utilisation de CSH CD44−/−
dans les LMC) permet d’éradiquer sélectivement les CSL tout en épargnant les CSH normales. L’article cosigné par les équipes de J. Dick et de F. Smadja-Joffe [1] fait suite à presque une décennie de travail du groupe français dont la démonstration, en 1999 que certains anticorps anti-CD44 étaient capables de lever le blocage de différenciation des blastes de LAM des sous-types les plus fréquents (M1 à M51), ouvrant ainsi une perspective thérapeutique novatrice [
3]. Ces auteurs franchissent une étape supplémentaire et suggèrent aujourd’hui que ces AcM anti-CD44 pourraient éradiquer les CSL à l’origine du clone malin et de sa résurgence après chimiothérapie conventionnelle. C’est donc très logiquement que le développement de l’anticorps anti-CD44 « médicament » est en cours et son utilisation pour la thérapie des LAM déjà programmée par l’équipe française. |
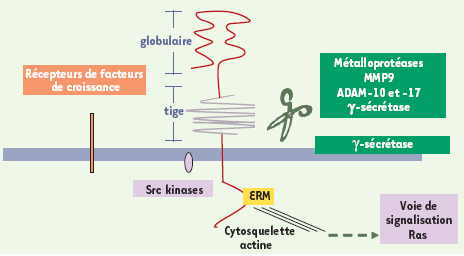
CD44 : une diversité de molécules et de fonctions Les molécules CD44 (PM 80-200 kDa), très polymorphes, et présentes à la surface de la plupart des cellules, sont codées par un seul gène comprenant 20 exons [
4]. La diversité des isoformes provient de l’épissage alternatif de 10 exons (dits exons variants, « v »), en grande partie contrôlé par les facteurs mitogènes. À cette diversité de la structure protéique s’ajoute celle des motifs de glycosylations post-translationnelles, très abondants, contribuant pour plus de 50 % au PM apparent des molécules CD44 (Figure 1). L’isoforme CD44 standard (CD44s), majoritaire dans les cellules hématopoïétiques normales, est dépourvue de séquences peptidiques variantes. C’est une glycoprotéine transmembranaire, dont la partie extracellulaire comprend un domaine linéaire (« tige ») juxta-membranaire où s’insèrent des séquences peptidiques additionnelles, codées par des exons variants (CD44v), et un domaine globulaire amino-terminal de liaison à l’acide hyaluronique (AH). CD44 peut aussi lier d’autres molécules de la matrice extracellulaire. Le domaine intracytoplasmique, bien que dépourvu d’activité kinase intrinsèque, est capable, lors de l’activation de CD44, de recruter des partenaires de signalisation - Src kinases notamment, mais aussi protéines de la famille ERM (Ezrin, radixin, moesin), merline, et ankyrine - qui connectent CD44 au cytosquelette et, indirectement, à la voie de signalisation Ras. De plus, l’activation de CD44 peut entraîner le recrutement de récepteurs de facteurs de croissance et de métalloprotéases à la surface cellulaire, formant ainsi une véritable plate-forme de signalisation dont les composants diffèrent selon le type cellulaire et l’état normal ou pathologique de la cellule, expliquant que CD44 intervient dans de multiples fonctions cellulaires - alors que paradoxalement, la délétion du gène n’entraîne pas d’anomalies majeures du développement.  | Figure 1.
Structure de la molécule CD44 et organisation d’une plateforme de signalisation. A. Après activation du CD44 par l’acide hyaluronique (fixation au niveau du domaine globulaire) ou des anticorps de type activateurs, une signalisation intracellulaire est transduite, via le recrutement de différents partenaires de signalisation, transmembranaires, intracellulaires, notamment les molécules ERM (Ezrine-Radixine-Moésine). Un clivage de CD44 par des métalloprotéases, puis par une γ-sécrétase pourrait être nécessaire à l’induction de la signalisation. La protéine standard (CD44s), commune à toutes les isoformes, codée par les 10 exons standard est représentée en rouge, et les séquences peptidiques additionnelles caractérisant les isoformes variantes (CD44v) en gris. |
|
Un rôle spécifique de CD44 dans les leucémies ? CD44 et LAM CD44s et, plus modestement, l’isoforme variante CD44-v6, sont exprimées à la surface des CSH normales, mais les Ac anti-CD44 ont peu d’effet sur la différenciation myéloïde normale [
5]. L’équipe de F. Smadja-Joffe avait montré en 1998 que CD44s et de nombreux variants étaient très exprimés à la surface des blastes de LAM, et que l’expression du variant v6 était corrélée à un pronostic défavorable [ 5,
6]. Surtout en 1999 cette équipe publiait dans Nature Medicine que, in vitro, certains anticorps anti-CD44 reconnaissant toutes les isoformes du CD44 et de type activateur (il en existe qui peuvent produire des effets distincts, voire opposés), entraînaient la différenciation en monocytes ou polynucléaires fonctionnels de blastes provenant directement de la moelle ou du sang de patients atteints de LAM [ 3]. Il existe généralement une excellente corrélation entre la réponse des cellules de patients in vitro et celle du patient lui-même. Il était donc raisonnable d’envisager une possible thérapie dite « différenciatrice » efficace, à l’instar de l’acide rétinoïque - seule molécule différenciatrice efficace in vivo - qui agit exclusivement dans le sous-type promyélocytaire (M3, moins de 10 % des cas de LAM). C’est dans cette perspective qu’a été entrepris le développement pharmacologique d’un de ces AcM. Indépendamment du mécanisme d’action des AcM activateurs [
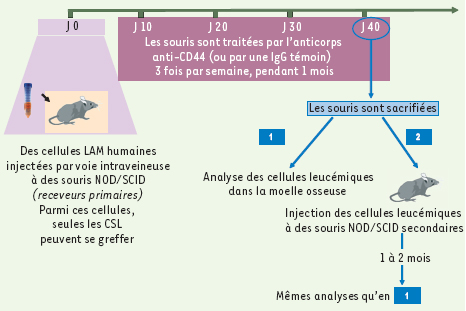
7], l’analyse in vivo de leur action était un préalable à leur éventuelle exploitation thérapeutique. Les modèles murins de LAM humaines s’y prêtent, malgré leurs imperfections (seule une fraction des LAM établit une leucémie in vivo). Les cellules leucémiques sont greffées par voie intraveineuse à des souris sévèrement immunodéprimées (souris NOD-SCID), elles migrent dans la moelle osseuse (et la rate) où la fraction CD34+CD38- contenant les CSL recrée un processus leucémique actif pendant des semaines. Ces CSL s’autorenouvellent comme en témoigne le succès de greffes leucémiques à des receveurs secondaires [
8]. Dans ce modèle, les équipes de F. Smadja-Joffe et de J. Dick ont réussi non seulement à reproduire in vivo l’activité différenciatrice de l’anticorps anti-CD44 sur les blastes, mais aussi à éradiquer les CSL (Figure 2). Plusieurs arguments le démontrent : la diminution de la population leucémique et des CSL CD34+CD38- dans la moelle des souris, et l’échec constant de la transplantation de cette LAM à un receveur secondaire [1]. L’AcM anti-CD44 a probablement deux actions : (1) inhibition partielle de la migration (homing) des CSL dans la niche médullaire (riche en acide hyaluronique, ligand physiologique de CD44) suggérant un rôle de CD44 dans l’interaction adhésive CSH ou CSL-niche ; (2) action directe de l’anticorps sur les propriétés d’ autorenouvellement/prolifération/différenciation des CSL.  | Figure 2.
Schéma expérimental utilisé dans l’étude [ 1]. |
Il semble que l’Ac anti-CD44 affecte la migration des CSL au moins à deux niveaux : (1) du sang circulant vers la moelle osseuse, probablement au niveau du processus d’extravasation, car in vitro, il inhibe partiellement leur migration à travers une membrane vers un gradient de SDF-1 ; (2) de la moelle osseuse vers d’autres sites. Ainsi, l’ajout d’un anti-CD44 à des blastes injectés directement dans le fémur des souris diminue significativement (mais pas totalement) la prolifération leucémique locale, et prévient toute dissémination des cellules hors du fémur greffé, même 8 semaines après la fin du traitement, excluant la possibilité que l’anticorps lui-même puisse bloquer cette dissémination. En se fondant sur des résultats publiées par ailleurs [
9], les auteurs ont considéré que la meilleure interprétation de leurs résultats était que l’anticorps anti-CD44 soit inhibe directement la capacité de repopulation des CSL, soit induit leur différenciation en progéniteurs LAM incapables de s’autorenouveler et de migrer vers d’autres os, bien qu’ils soient capable, in situ, de proliférer. Dans ces expériences, l’anti-CD44 ne diminuait que très légèrement la capacité de repopulation à partir de CSH humaines normales, identifiant ainsi une différence dans le contrôle du comportement in vivo des CSL et des CSH. Celle-ci peut résulter d’une différence des partenaires de signalisation présents dans les cellules, puisque, comme nous l’avons évoqué ci-dessus, la signalisation du CD44 est très spécifique du contexte moléculaire d’une cellule. Il est aussi probable que la plus grande abondance de CD44 sur les CSL versus les CSH normales exacerbe leur sensibilité à l’action de l’anticorps. Quoi qu’il en soit, cette spécificité d’action de l’anticorps anti-CD44 sur les CSL, avec des conséquences minimales sur les CSH normales, est particulièrement favorable à une utilisation thérapeutique. CD44 et LMC CD44 et ses variants sont aussi très fortement exprimés sur les progéniteurs exprimant Bcr-abl 2, [ 5,
10], et l’étude publiée simultanément dans Nature Medecine [ 2] démontre, dans un modèle murin syngénique où Bcr-abl, selon les conditions d’infection, induit une leucémie de type soit myéloïde (LMC), soit lymphoblastique, que CD44 est nécessaire au développement de la première, mais pas de la seconde [ 2]. Lorsque bcr-abl est introduit dans des CSH implantées par voie IV chez un receveur « sauvage », 90 % des souris receveuses meurent de LMC. Cette proportion n’est que de 13 % si bcr-abl est transduit dans des CSH CD44−/−
et, si les souris receveuses meurent, c’est tardivement et de leucémies lymphoïdes. L’explication est un défaut de homing des cellules bcr-abl +/ CD44−/−
dans la moelle osseuse des receveurs, ce que prouve l’analyse phénotypique quelques heures après greffe, et le faible nombre de clones bcr-abl + dans la moelle (1,5 versus 6). La prolifération vigoureuse des cellules bcr-abl +/ CD44−/−
injectées directement en intrafémoral, la survie importante des souris greffées avec des cellules sauvages bcr-abl + préincubées avec un anti-CD44, et la restauration partielle du potentiel leucémique après transduction d’un ADNc codant hCD44 sont autant de confirmations. Curieusement, CD44 n’interfère pas avec le développement de leucémies lymphoïdes B bcr-abl +, identifiant un autre niveau de sélectivité au sein des hémopathies [
11]. L’absence de CD44 (ici par délétion génique) n’affectant pas le développement de la myélopoïèse normale, cette équipe suggère que des anticorps anti-CD44 pourraient donc être utilisés pour éliminer sélectivement les CSL (en particulier dans le contexte d’autogreffe de cellules de moelle osseuse). |
Ces deux études confirment in vivo le rôle clé de CD44 dans la greffe d’un processus leucémique. Il faut cependant souligner plusieurs points : (1) l’existence d’une certaine confusion quant au rôle de CD44 dans l’hématopoïèse in vivo, certaines études rapportant un blocage de la migration de cellules CD34+ normales vers la moelle osseuse de souris NOD-SCID en présence d’anticorps anti-CD44 [
12]. Ces contradictions apparentes s’expliquent en grande partie par le choix des anticorps utilisés, selon qu’ils activent ou inhibent la voie de signalisation en aval. Bien peu d’épitopes ont été caractérisés, et il est donc encore difficile de corréler un domaine de la molécule à une fonction [3] ; (2) chez l’homme, où l’émergence du clone leucémique se produit dans la moelle osseuse, on cherchera moins un effet sur le homing qu’une élimination des CSL (par apoptose ou différenciation) et un blocage de leur dissémination, et à ce titre, les anticorps anti-CD44 testés dans ces études apparaissent prometteurs. |
Footnotes |
1. Jin L, Hope KJ, Zhai Q, Smadja-Joffre F, et al. Targeting of CD44 eradicates human acute myeloid leukemic stem cells. Nat Med 2006; 12 : 1167–74. 2. Krause DS, Lazarides K, von Adrian UH, van Etten RA. Requirement for CD44 in homing and engraftment of BCR-ABL-expressing leukemic stem cells. Nat Med 2006; 12 : 1175–80. 3. Charrad RS, Li Y, Delpech B, et al. Ligation of the CD44 adhesion molecule reverses blockage of differentiation in human acute myeloid leukemia. Nat Med 1999; 5 : 669–76. 4. Ponta H, Sherman L, Herrlich PA. CD44: from adhesion molecules to signalling regulators. Nat Rev Mol Cell Biol 2003; 4 : 33–45. 5. Ghaffari S, Smadja-Joffe F, Oostendorp R, et al. CD44 isoforms in normal and leukemic hematopoiesis. Exp Hematol 1999; 27 : 978–93. 6. Legras S, Gunthert U, Stauder R, et al. A strong expression of CD44-6v correlates with shorter survival of patients with acute myeloid leukemia. Blood 1998; 91 : 3401–13. 7. Gadhoum Z, Leibovitch MP, Qi J, Dumenil D, Durand L, Leibovitch S, Smadja-Joffe F. CD44: a new means to inhibit acute myeloid leukemia cell proliferation via p27Kip1. Blood 2004; 103 : 1059–68. 8. Hope KJ, Jin L, Dick JE. Acute myeloid leukemia originates from a hierarchy of leukemic stem cell classes that differ in self-renewal capacity. Nat Immunol 2004; 5 : 738–43. 9. McKenzie JL, Gan OI, Doedens M, et al. Individual stem cells with highly variable proliferation and self-renewal properties comprise the human hematopoietic stem cell compartment. Nat Immunol 2006 online. 10. Ghaffari S, Dougherty GJ, Lansdorp PM, et al. Differentiation-associated changes in CD44 isoform expression during normal hematopoiesis and their alteration in chronic myeloid leukemia. Blood 1995; 86 : 2976–85. 11. Bendall LJ, Kirkness J, Hutchinson A, et al. Antibodies to CD44 enhance adhesion of normal CD34+ cells and acute myeloblastic but not lymphoblastic leukaemia cells to bone marrow stroma. Br J Haematol 1997; 98 : 828–37. 12. Avigdor A, Goichberg P, Shivtiel S, et al. CD44 and hyaluronic acid cooperate with SDF-1 in the trafficking of human CD34+ stem /progenitor cells to bone marrow. Blood 2004; 103 : 2981–9. |