| |
| Med Sci (Paris). 2006 November; 22(11): 906–908. Published online 2006 November 15. doi: 10.1051/medsci/20062211906.La cystéamine rétablit les dynamiques intracellulaires
et la sécrétion du BDNF dans la maladie de Huntington Frédéric Saudou* and Sandrine Humbert* Institut Curie, CNRS UMR 146, 91405 Orsay Cedex, France MeSH keywords: Facteur neurotrophique dérivé du cerveau, Mercaptamine, Humains, Maladie de Huntington, Transglutaminases |
La maladie de Huntington (HD) est une maladie neurodégénérative caractérisée par des mouvements incontrôlés (chorée) et des désordres psychiques et intellectuels qui conduisent à une incapacité totale et à la démence [
1]. La lésion neuropathologique dans HD est une dégénérescence spécifique de certains neurones du cerveau, en particulier les neurones du striatum, structure impliquée dans le contrôle du mouvement. Le gène responsable de la maladie a été identifié, il code une protéine de 350 kDa appelée huntingtine qui n’a aucune homologie avec des protéines connues. Le gène huntingtine contient dans sa séquence codante une répétition polymorphique du trinucléotide, CAG traduite en une répétition de glutamines (polyQ) au niveau protéique. Lorsque le nombre de ces répétitions excède 35, le gène code une version de la huntingtine qui conduit à l’apparition de la maladie. À l’heure actuelle, il n’existe pas de traitement pour prévenir l’apparition des symptômes ou ralentir la progression de la maladie, et la mort survient chez les patients entre 10 à 20 ans après l’apparition des premiers symptômes. La cystamine est une molécule qui pourrait avoir un intérêt thérapeutique car elle possède des propriétés protectrices dans HD [
2,
3]. Les travaux de Borrell-Pagès et al. décrivent le mode d’action de cette molécule qui agit, au moins en partie, en augmentant la sécrétion du facteur neurotrophique brain-derived neurotrophic factor (BDNF) [
4]. La forme réduite de la cystamine, la cystéamine, qui a fait l’objet d’une autorisation de mise sur le marché, possède des propriétés identiques et pourrait donc représenter un traitement pour HD. |
La cystamine augmente les niveaux de BDNF La cystamine est à l’origine connue pour son rôle inhibiteur de la transglutaminase (TGase). Cette enzyme assure la liaison entre des protéines contenant d’un part des résidus glutamines et, d’autre part, une lysine. Plusieurs études ont montré que la TGase pourrait intervenir dans HD [
5]. Des peptides contenant des séquences polyQ ainsi que la huntingtine-polyQ sont des substrats de la TGase. De plus, les niveaux protéiques de TGase sont augmentés chez les patients et dans des modèles murins de HD. Effectivement, des souris HD traitées par la cystamine présentent moins de perte neuronale, de meilleures performances motrices ainsi qu’une meilleure survie. Cependant, jusqu’à présent, le mode d’action de la cystamine n’était pas complétement élucidé. L’étude de Borrell-Pagès montre que la cystamine augmente les concentrations de la protéine chaperon HSJ1b, majoritairement neuronale. Les concentrations de cette protéine sont diminuées dans des extraits post-mortem de cerveaux de patients HD par rapport à des cerveaux témoins. Les auteurs ont déterminé l’effet de HSJ1b dans un modèle cellulaire qui récapitule les caractéristiques de HD. Ce modèle consiste à transfecter des neurones striataux en culture primaire par la huntingtine sauvage ou mutante. La huntingtine mutante conduit à la formation d’agrégats caractéristiques et à la mort neuronale. Dans ce modèle, HSJ1b inhibe la mort induite par la huntingtine-polyQ. Cependant, alors que les chaperons ont été particulièrement étudiés dans HD car ces protéines inhibent l’agrégation, HSJ1b n’a pas d’effet sur l’agrégation de la huntingtine-polyQ. De la même façon, chez le nématode Caenorhabditis elegans, HSJ1b bloque le dysfonctionnement neuronal sans effet majeur sur les inclusions intranucléaires. Comment la cystamine est-elle neuroprotectrice ? La cystamine agit en augmentant la sécrétion du facteur neurotrophique, BDNF. Ce facteur, absolument indispensable pour la croissance et la survie des neurones du striatum, voit ses concentrations diminuées dans le cerveau de patients atteints de HD [
6,
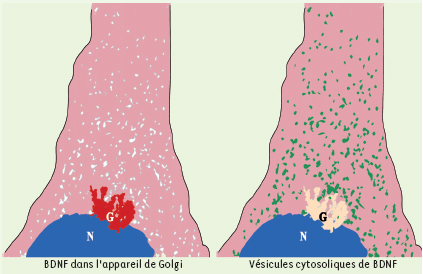
7]. L’augmentation de la sécrétion de BDNF de l’appareil de Golgi vers le cytoplasme des cellules met en jeu au niveau moléculaire, à la fois HSJ1b et la transglutaminase (Figures 1 et 2).  | Figure 1.
Le facteur BDNF dans la cellule. Schéma représentant le BDNF dans l’appareil de Golgi et les vésicules cytosoliques de BDNF. La mesure de la répartition du BDNF dans ces deux compartiments a permis de montrer que la cystéamine stimule le passage du BDNF du Golgi vers le cytoplasme (schéma, Fabrice P. Cordelières, Institut Curie, Orsay, France). |
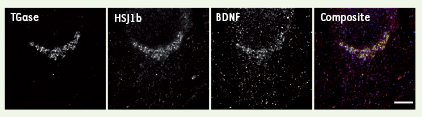
 | Figure 2.
La transglutaminase (TGase), le chaperon HSJ1b et le BDNF sont localisés au niveau de l’appareil de Golgi. Les cellules sont fixées et immunomarquées pour ces trois protéines puis analysées par microscopie à déconvolution. Le composite représente la superposition des trois images obtenues. Barre d’échelle : 10 µm (photo, Fabrice P. Cordelières, Institut Curie, Orsay, France). |
Les auteurs ont ensuite analysé la conséquence de l’augmentation de la sécrétion de BDNF. Dans des cellules en culture, la cystamine augmente les niveaux de BDNF libérés, ce qui se traduit chez une souris traitée par cette molécule par une augmentation du BDNF dans le cerveau. Enfin, les concentrations sanguines de BDNF sont également augmentées reflétant ainsi la situation au niveau cérébral. |
La cystéamine récapitule les propriétés de la cystamine La forme réduite de la cystamine - son précurseur métabolique - la cystéamine, est utilisée pour traiter une maladie rare de l’enfant, la cystinose. Ainsi, la cystéamine pourrait être testée directement en phase II d’études cliniques chez des patients HD. Borrell-Pagès et al. ont montré que cette molécule produit des effets biologiques similaires à la cystamine in vitro et in vivo. La cystéamine est neuroprotectrice dans un modèle murin de HD et cet effet dépend de la production de BDNF chez ces animaux. La cystéamine, comme la cystamine, augmente les niveaux de BDNF dans le cerveau ainsi que dans le sang de souris et de rats traités. Les niveaux de BDNF sont réduits dans le cerveau de patients HD [6, 7]. Les travaux de Borrell-Pagès et al. montrent que les concentrations sanguines de BDNF sont réduites dans un modèle murin de HD, mais aussi et surtout dans un modèle primate, plus proche de la pathologie humaine. Lorsque ces primates sont traités par la cystéamine, le niveau sanguin de BDNF est augmenté. Ainsi, la cystéamine représenterait un traitement pour HD et les niveaux sanguins de BDNF pourraient servir de biomarqueurs pour suivre l’efficacité de ce traitement. |
Rétablir les dynamiques intracellulaires dans HD comme piste thérapeutique Les mécanismes moléculaires exacts par lesquels la huntingtine-polyQ conduit au dysfonctionnement et à la mort de neurones ne sont pas encore totalement compris. Le gain d’une nouvelle fonction toxique de la protéine mutante a été largement étudié dans HD du fait du caractère dominant de cette maladie. Cependant, il apparaît de plus en plus clairement que la perte des fonctions de la huntingtine pourrait aussi intervenir [
8]. En bon accord avec cette hypothèse, la huntingtine stimule le transport de BDNF le long des microtubules [6]. Par la nature de ses interacteurs, il est probable que le rôle de la huntingtine dans les dynamiques intracellulaires ne se limite pas au transport microtubule-dépendant. Des travaux récents montrent effectivement que la huntingtin-associated protein 40, HAP40 et la huntingtine forment un complexe régulant l’endocytose et que cette fonction est perturbée dans HD [
9]. Des dérèglements des dynamiques intracellulaires dans les neurones ont des conséquences dramatiques sur la viabilité cellulaire. Dans ce contexte, des approches de biologie cellulaire telles que celle décrite dans l’étude de Borrell-Pagès et al. devraient permettre d’identifier des molécules capables de corriger les dysfonctionnements dans les dynamiques intracellulaires et, qui présenteraient par conséquent un intérêt thérapeutique. |
1. Young AB. Huntingtin in health and disease. J Clin Invest 2003; 111 : 299–302. 2. Karpuj MV, Becher MW, Springer JE, et al. Prolonged survival and decreased abnormal movements in transgenic model of Huntington disease, with administration of the transglutaminase inhibitor cystamine. Nat Med 2002; 8 : 143–9. 3. Dedeoglu A, Kubilus JK, Jeitner TM, et al. Therapeutic effects of cystamine in a murine model of Huntington’s disease. J Neurosci 2002; 22 : 8942–50. 4. Borrell-Pages M, Canals JM, Cordelieres FP, et al. Cystamine and cysteamine increase brain levels of BDNF in Huntington disease via HSJ1b and transglutaminase. J Clin Invest 2006; 116 : 1410–24. 5. Lesort M, Chun W, Tucholski J, et al. Does tissue transglutaminase play a role in Huntington’s disease ? Neurochem Int 2002; 40 : 37–52. 6. Gauthier LR, Charrin BC, Borrell-Pages M, et al. Huntingtin controls neurotrophic support and survival of neurons by enhancing BDNF vesicular transport along microtubules. Cell 2004; 118 : 127–38. 7. Zuccato C, Ciammola A, Rigamonti D, et al. Loss of huntingtin-mediated BDNF gene transcription in Huntington’s disease. Science 2001; 293 : 493–8. 8. Cattaneo E, Zuccato C, Tartari M. Normal huntingtin function : an alternative approach to Huntington’s disease. Nat Rev Neurosci 2005; 6 : 919–30. 9. Pal A, Severin F, Lommer B, et al. Huntingtin-HAP40 complex is a novel Rab5 effector that regulates early endosome motility and is up-regulated in Huntington’s disease. J Cell Biol 2006; 172 : 605–18. |