| |
| Med Sci (Paris). 2006 October; 22(10): 872–877. Published online 2006 October 15. doi: 10.1051/medsci/20062210872.La PI3-kinase : de la synapse immunologique au contrôle de la prolifération T Stéphanie Fabre,* Valérie Lang, and Georges Bismuth Inserm U567, CNRS UMR 8104, Université Paris 5, Faculté de Médecine René Descartes, Institut Cochin, Département de Biologie cellulaire, 22, rue Méchain, 75014 Paris, France |
Activation de la PI3-kinase à la synapse immunologique L’activation d’un lymphocyte T (LT) naïf par les complexes CMH-peptide présents à la surface des cellules présentant l’antigène (CPA) s’accompagne de la mise en place, à l’interface entre les deux cellules, d’une jonction spécialisée caractérisée par une ségrégation spatiale plus ou moins organisée des récepteurs à l’antigène (TCR), de molécules d’adhésion et de costimulation [
1]. La formation de cette jonction, baptisée synapse immunologique, requiert d’importants remaniements du cytosquelette de la cellule T et est associée à des cascades de phosphorylation sur tyrosine conduisant au recrutement et à l’activation séquentielle de nombreuses molécules de signalisation. L’interaction mise en place reste stable pendant plusieurs heures, une caractéristique remarquable révélée par de nombreuses études in vitro et confirmée plus récemment in vivo au sein du ganglion lymphatique par des approches de microscopie bi-photonique en temps réel [
2]. Cette interaction prolongée est un paramètre critique nécessaire à l’activation des réponses biologiques T-spécifiques telles que la production d’IL-2 ou d’IFN-γ, mais aussi à la prolifération cellulaire [
3,
4]. L’activation des phosphoinositide-3-kinases (PI3K) lors de la formation de la synapse immunologique a été récemment rapportée [
5,
6]. Il apparaît aujourd’hui que l’activation soutenue dans le temps de cette voie métabolique est un élément de signalisation essentiel dans les cellules T, à l’origine de conséquences fonctionnelles majeures. Les PI3K forment une vaste famille d’enzymes phosphorylant des phospholipides membranaires, les phosphoinositides (PI), sur la position 3 du groupement inositol. Elles sont réparties en trois classes majeures sur la base de leur structure et de la spécificité de leurs substrats, et sont généralement constituées d’une sous-unité catalytique et d’une sous-unité régulatrice. Les PI3K impliquées dans l’activation lymphocytaire sont les PI3K de classe I. Elles utilisent comme substrats le PdtIns(4)P (phosphatidylinositol 4-phosphate), le PtdIns(4, 5)P2 ou le PtdIns(5)P et sont subdivisées en deux sous-groupes : IA, activées en aval de récepteurs couplés à des tyrosine kinases tels que les récepteurs B et T à l’antigène, les récepteurs aux cytokines et certaines molécules de costimulation ; IB, activées en aval de récepteurs couplés aux protéines G tels que les récepteurs aux chimiokines [
7]. Les PI3K de classe IA sont des enzymes hétérodimériques constituées d’une sous-unité régulatrice (p85α, la plus abondante, et ses deux variants d’épissage p55α et p50α, p85β ou p55γ) et d’une sous-unité catalytique (p110δ essentiellement leucocytaire, p110α ou p110β, ubiquitaires). Elles sont activées grâce au recrutement des domaines SH2 de la sous-unité régulatrice sur des motifs consensus YxxM phosphorylés lors de l’engagement d’un récepteur couplé à des tyrosine kinases. La p110, ainsi adressée à la membrane, catalyse la synthèse de PtdIns(3,4)P2 et de PtdIns(3, 4, 5)P3, deux 3’-phosphoinositides (3’-PI) quasiment indétectables dans la membrane plasmique à l’état basal et qui recrutent sélectivement des protéines à domaine PH (Pleckstrin homology) comme la sérine/thréonine kinase Akt, les kinases de la famille Tec ou les facteurs d’échange pour les petites protéines G de la famille Rho (Figure 1). Ces protéines activent à leur tour un grand nombre d’effecteurs impliqués dans le contrôle de la survie, de la prolifération et de la mobilité cellulaire. Le domaine PH d’Akt fusionné à la GFP a été utilisé comme biosenseur pour visualiser les sites de production de 3’-PI au cours des processus biologiques. Cette approche a permis de démontrer l’existence d’une production massive de 3’-PI lors de la formation d’un contact entre des cellules T primaires et des CPA en présence d’antigène. Toutefois, le LT échappe au paradigme classique de régulation des 3’-PI tel qu’il a été décrit pour les neutrophiles ou les fibroblastes en migration dans un gradient chimiotactique. Alors que ces cellules présentent une augmentation transitoire du niveau de 3’-PI restreinte au bord migrant, les cellules T stimulées par l’antigène montrent une accumulation des 3’-PI dans l’ensemble de leur membrane plasmique, bien au-delà de la synapse, et ce pendant plusieurs heures [6]. Afin de préciser les bases moléculaires régissant ce métabolisme particulier des 3’-PI, nous avons récemment analysé la localisation en temps réel de la sous-unité p85α fusionnée à la GFP dans les cellules T humaines primaires stimulées par l’antigène. Notre étude révèle un recrutement massif et polarisé de la PI3K à l’interface T/CPA dès l’initiation du contact [
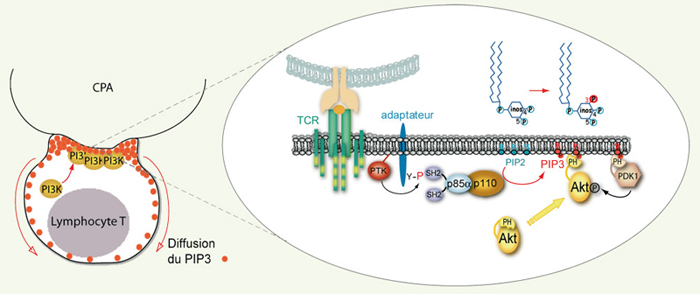
8]. Nous avons montré que ce recrutement est stable pendant plusieurs heures et qu’il est corrélé à une accumulation prolongée de phosphotyrosines (pTyr) à la synapse, ce qui suggère une implication majeure des PI3K de classe IA activées via un mécanisme dépendant des interactions pTyr-SH2. En outre, des expériences de photobleaching nous ont permis de démontrer la diffusion rapide des 3’-PI au sein de la membrane plasmique de la cellule T, permettant de concilier une activation polarisée de la PI3K exclusivement synaptique et une redistribution étendue des 3’-PI dans toute la membrane.  | Figure 1.
Activation des PI3K de classe IA à la synapse immunologique. Lors d’un contact entre un lymphocyte T et une CPA, la PI3K est recrutée, grâce aux domaines SH2 de sa sous-unité régulatrice p85α, au niveau d’adaptateurs phosphorylés sur des résidus tyrosine par les kinases activées en aval du TCR. À ce jour, plusieurs adaptateurs candidats ont été proposés dont CD28 et LAT. La sous-unité catalytique p110, ainsi adressée à la membrane, phosphoryle les phosphoinositides membranaires sur la position 3 du groupement inositol, engendrant en particulier du PtdIns(3, 4, 5)P3 (PIP3) qui diffuse alors dans l’ensemble de la membrane plasmique. Le PtdIns(3, 4, 5)P3 est reconnu spécifiquement par le domaine PH de PDK1, une sérine-thréonine kinase qui phosphoryle et active Akt. CPA : cellule présentatrice de l’antigène ; TCR : récepteur T de l’antigène ; PTK : protéine tyrosine kinase ; PdtIns : phosphatidylinositol ; PIP2 : phosphatidylinositol-(4,5)-biphosphate ; PIP3 : phosphatidylinositol-(3,4,5)-triphosphate ; PH : pleckstrin homology ; SH2 : Src-homology domain 2 ; PDK1 : phosphoinositide-dependent kinase 1. |
|
Les PI3K, des acteurs majeurs de l’homéostasie lymphocytaire Il ne fait aucun doute qu’un tel mécanisme, par la diversité des voies de signalisation qu’il engage, joue un rôle fondamental dans l’activation T et dans l’élaboration des réponses immunes. De nombreuses études génétiques ont en effet révélé l’importance des PI3K dans le fonctionnement et l’homéostasie du système immunitaire. Ainsi, l’invalidation du gène PIK3r1, qui code la p85α et ses variants d’épissage, provoque une réduction du nombre de cellules B matures en périphérie, une diminution des immunoglobulines sériques et une inhibition des réponses B prolifératives in vitro [
9] ; l’absence de phénotype T clair serait liée à des redondances fonctionnelles entre les sous-unités régulatrices. Une autre étude introduisant une mutation dans le gène de la p110δ et provoquant une perte de sa fonction catalytique a mis en évidence des défauts des réponses B et T à l’antigène in vitro et in vivo ainsi qu’une réduction de la population de cellules T mémoire en périphérie, témoignant du rôle joué par la PI3K dans la survie et/ou la différenciation des cellules T effectrices [
10]. Enfin, l’invalidation conditionnelle dans les lymphocytes T de PTEN, l’une des principales phosphatases hydrolysant les 3’-PI, induit un syndrome lymphoprolifératif létal, des anomalies de la sélection thymique et un accroissement de la résistance des cellules T périphériques aux stimuli apoptotiques [
11]. Ces données corroborent d’autres études utilisant des inhibiteurs pharmacologiques de la PI3K et démontrant que les effets positifs de certaines cytokines comme l’IL-7, l’IL-2 ou l’IL-12 sur la survie et la prolifération des cellules T sont dépendants de la voie PI3K [
12–
14]. Enfin, il a été rapporté que l’inhibition de la PI3K, bien que n’empêchant pas la synapse immunologique de se mettre en place et n’inhibant pas certains évènements liés à l’activation, comme l’augmentation des tyrosines phosphorylées, l’expression de CD25 ou la production d’IL-2, bloque la transformation blastique des cellules T induite par l’antigène [5, 6]. C’est cet impact relativement sélectif de la PI3K sur la prolifération T en réponse à l’antigène que nous avons essayé de comprendre. Quoique peu d’études aient été conduites dans les lymphocytes jusqu’à présent, un grand nombre d’effecteurs en aval de la PI3K pourraient expliquer ce phénomène (Figure 2). Parmi ceux-ci, la sérine-thréonine kinase Akt joue un rôle majeur. Akt peut, en effet, inactiver des inhibiteurs du cycle cellulaire comme p27kip1 ou p21cip [
15], des composants de la machinerie apoptotique tels que Bad [
16], ou la kinase pro-apoptotique GSK-3 impliquée également dans l’inhibition de la prolifération et de la production d’IL-2 induites par l’antigène [
17]. De plus, Akt régule le trafic nucléo-cytoplasmique de certains facteurs de transcription, contrôlant ainsi de manière indirecte l’expression d’une myriade de régulateurs cellulaires. Ainsi, dans les cellules T, Akt stimule le complexe IKK et promeut l’activation de NF-κB en réponse à la stimulation du TCR. Ce mécanisme contribue à l’effet protecteur d’Akt contre l’apoptose induite par Fas dans la mesure où NF-κB régule des gènes de survie cellulaire tels que les inhibiteurs de caspases ou Bcl-xL [
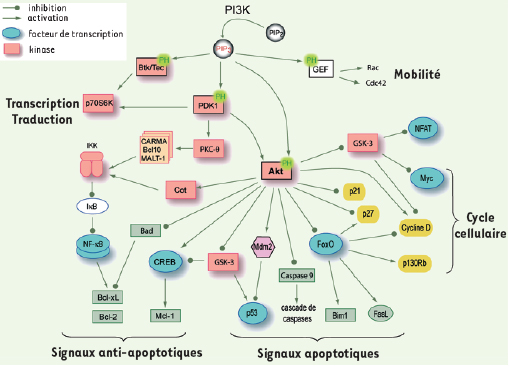
18]. D’autres régulateurs centraux de l’homéostasie des systèmes cellulaires, les facteurs transcriptionnels FoxO (Forkhead box subgroup O) sont régulés négativement par Akt. C’est sur eux qu’a porté notre attention. 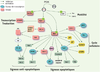 | Figure 2.
Fonctions pléiotropes d’Akt. La sérine-thréonine kinase Akt activée en aval de la PI3K régule de multiples cibles cellulaires impliquées dans le contrôle de la survie et de la prolifération cellulaire. PIP2 : phosphatidylinositol-(4,5)-biphosphate ; PIP3 : phosphatidylinositol-(3,4,5)-triphosphate ; PH : pleckstrin homology ; GEF : guanine nucleotide exchange factor ; IKK : I kappa B kinase complex. |
|
Les facteurs FoxO contrôlent la quiescence cellulaire en aval de la PI3K Au nombre de quatre chez les mammifères, FoxO1 (FKHR), FoxO3a (FKHRL1), FoxO4 (AFX) et FoxO6 sont les cibles de nombreuses kinases dont Akt qui les phosphoryle sur trois positions consensus. Cette phosphorylation favorise l’association des FoxO avec la protéine 14-3-3, ce qui inhibe leur liaison à l’ADN, stimule leur export nucléaire et bloque leur import par masquage d’un signal de localisation nucléaire (voir Figure 3 et revue en [
19]). D’autres auteurs ont mis en évidence une ubiquitination et une dégradation de FoxO1 par le protéasome 26S après sa phosphorylation par Akt [
20]. L’ensemble de ces mécanismes concourt à diminuer la transactivation par les FoxO de leurs gènes cibles, impliqués essentiellement dans l’inhibition du cycle cellulaire et l’induction de l’apoptose [
21]. La nature des gènes régulés par les FoxO dépend à la fois de l’isoforme impliquée, du type cellulaire et des associations éventuelles avec différents cofacteurs. Elle pourrait aussi être modulée par le niveau d’acétylation des FoxO. Ainsi, l’association de FoxO3a avec la désacétylase SIRT1 favorise, en conditions de stress oxydatif, la transcription des gènes de résistance au stress tels que Gadd45 ou MnSOD, au détriment des gènes pro-apoptotiques [
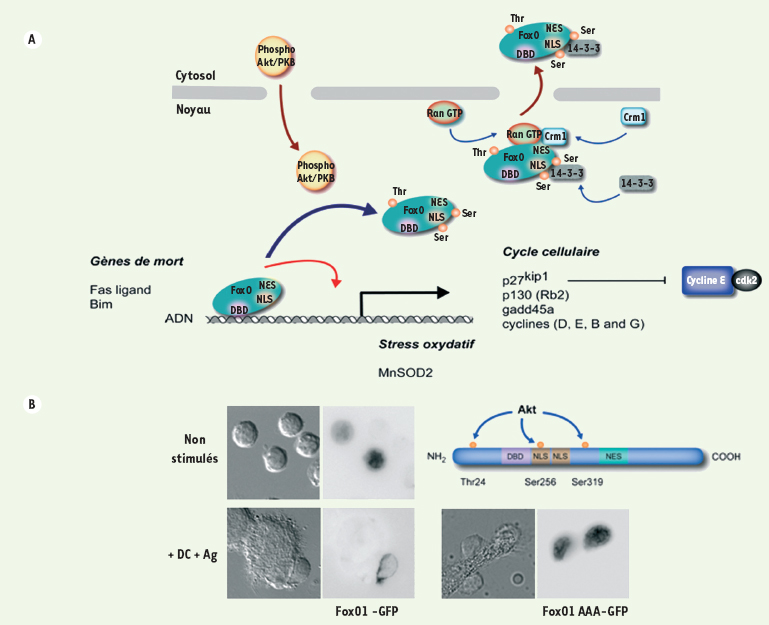
22]. Ce phénomène pourrait s’avérer essentiel dans le maintien d’un phénotype quiescent stable en évitant l’accumulation de lésions cellulaires. 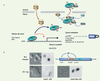 | Figure 3.
Akt régule l’exclusion nucléaire de FoxO1 dans les cellules T. A. La forme active d’Akt phosphoryle les facteurs transcriptionnels FoxO sur trois positions consensus (Thr14, Ser256 et Ser319 pour FoxO1), ce qui stimule leur prise en charge par la machinerie d’export nucléaire dépendante de la GTPase Ran et leur rétention dans le cytoplasme via leur association à 14-3-3. NES : nuclear export sequence ; NLS : nuclear localisation sequence ; DBD : DNA binding domain. B. Distribution d’une protéine de fusion FoxO1-GFP dans les lymphocytes T humains primaires au repos (en haut à gauche) et après 20 minutes de contact avec des cellules dendritiques chargées en super-antigène (en bas à gauche). Une forme de FoxO1 mutée sur les trois résidus phosphorylés par Akt demeure constitutivement nucléaire après stimulation (en bas à droite). |
L’activation transcriptionnelle des gènes pro-apoptotiques FasL et Bim par FoxO3a est l’une des mieux documentées dans les cellules T [
13, 21]. Ainsi, Stahl et al. ont montré, dans la lignée T CTLL-2, que l’induction de Bim consécutive à la privation en IL-2 induit une forte apoptose pouvant être mimée par des inhibiteurs de la PI3K ou par la surexpression d’une forme constitutivement nucléaire de FoxO3a [13]. Cette voie de signalisation joue probablement un rôle crucial dans l’homéostasie du système immunitaire dans la mesure où Bim apparaît comme un régulateur majeur de la survie lymphocytaire in vivo. En effet, les souris bim−/− présentent une pathologie rénale autoimmune, un développement T anormal et une hyperprolifération lymphoïde et myéloïde [
23]. Les FoxO peuvent également stimuler l’apoptose en induisant Bcl-6, un répresseur transcriptionnel de Bcl-xL [
24] ; à l’inverse, une induction de Bcl-xL a été rapportée dans des cellules T murines transgéniques exprimant une forme constitutivement active d’Akt [18]. Les facteurs FoxO activent aussi la transcription de protéines impliquées dans le maintien d’un état de quiescence cellulaire, parmi lesquelles l’inhibiteur des cdk p27kip1 [13,
25], p130/Rb qui séquestre le facteur transcriptionnel E2F-4 nécessaire à l’entrée en phase G1 [
26], et la cycline G2 abondante dans les lymphocytes où elle bloque le cycle en phase G0 [
27]. La surexpression d’une forme active de FoxO induit ainsi un arrêt du cycle cellulaire dans les cellules T leucémiques Jurkat et dans la lignée murine CTLL-2, ce qui est corrélé à une expression accrue de p27kip1. À l’inverse, l’expression d’un transgène codant un mutant dominant négatif de FoxO1 accroît la prolifération des thymocytes [
28]. En accord avec la nature de leurs cibles cellulaires, les FoxO apparaissent donc comme de puissants gènes suppresseurs de tumeurs et sont d’ailleurs fréquemment affectés par des translocations chromosomiques dans des pathologies cancéreuses, notamment des rhabdomyosarcomes de l’enfant et des leucémies aiguës. Leur importance in vivo a été confirmée par le fait que des souris déficientes en FoxO3a présentent des désordres lymphoprolifératifs et un syndrome inflammatoire systémique associés à une activité accrue de NF-κB [
29]. FoxO3a inhiberait en effet NF-κB en stimulant l’expression de IκBβ et IκBε. Les FoxO constituent donc un carrefour majeur entre plusieurs voies de signalisation et jouent un rôle central dans l’homéostasie du système immunitaire et dans le maintien de la tolérance T. Néanmoins, aucune étude directe de la localisation de ces facteurs au cours de la stimulation des cellules T n’avait été réalisée jusqu’à récemment. |
L’exclusion nucléaire de FoxO1 en aval de la synapse immunologique est requise pour l’entrée en cycle des cellules T Nous avons montré en vidéo-microscopie que la stimulation antigénique de cellules T humaines primaires induit l’exclusion nucléaire du facteur transcriptionnel FoxO1 selon un processus rapide et non polarisé initié cinq à dix minutes après l’établissement du contact avec la CPA [8]. A l’image de l’activation de la PI3K, ce processus est maintenu pendant plusieurs heures et réversible par l’ajout d’un inhibiteur de la PI3K. En outre, une forme de FoxO1 mutée sur les trois résidus phosphorylés par Akt reste confinée dans le noyau, attestant du rôle joué par la voie PI3K/Akt dans le processus d’exclusion (Figure 3). Ce phénomène est fonctionnellement important puisque la surexpression du mutant constitutivement nucléaire bloque la croissance cellulaire induite par l’antigène in vitro. Dans ce cas, l’absence de cellules blastiques n’est pas due à un défaut d’activation précoce des cellules T, ni à un accroissement significatif de l’apoptose mais est corrélée à une réduction du contenu en acides nucléiques témoignant d’un blocage de l’entrée en cycle. Des résultats analogues ont été obtenus avec des cellules B murines infectées par des rétrovirus codant les formes actives de FoxO1 et FoxO3a [
30]. |
L’activation prolongée de la PI3K au sein de la synapse immunologique permet de déplacer le trafic nucléo-cytoplasmique de FoxO1 en faveur de la forme cytoplasmique inactive, et ce pendant de longues périodes, ce qui permet aux cellules T d’entrer en cycle. La longue durée de vie des signaux issus du TCR et/ou de molécules de costimulation constitue donc probablement un moyen direct permettant aux LT et aux CPA de maintenir les cascades métaboliques dépendantes de la PI3-K afin de mettre en place les différentes étapes nécessaires à l’expansion clonale des cellules T en réponse à l’antigène. |
Nous tenons à remercier le comité organisateur du Congrès des Jeunes Chercheurs de l’Université Paris5-René Descartes qui est à l’origine de cette collaboration avec la revue médecine/sciences. Nos travaux ont bénéficié du soutien financier du Ministère de l’Enseignement supérieur et de la Recherche (S.F.), de la Ligue Nationale contre le Cancer, de l’Inserm et du CNRS.
|
Footnotes |
1. Van der Merwe PA. Formation and function of the immunological synapse. Curr Opin Immunol 2002; 14 : 293–8. 2. Germain RN, Jenkins MK. In vivo antigen presentation. Curr Opin Immunol 2004; 16 : 120–5. 3. Huppa JB, Gleimer M, Sumen C, Davis MM. Continuous T cell receptor signaling required for synapse maintenance and full effector potential. Nat Immunol 2003; 4 : 749–55. 4. Hurez V, Saparov A, Tousson A,et al. Restricted clonal expression of IL-2 by naive T cells reflects differential dynamic interactions with dendritic cells. J Exp Med 2003; 198 : 123–32. 5. Harriague J, Bismuth G. Imaging antigen-induced PI3K activation in T cells. Nat Immunol 2002; 3 : 1090–6. 6. Costello PS, Gallagher M, Cantrell DA. Sustained and dynamic inositol lipid metabolism inside and outside the immunological synapse. Nat Immunol 2002; 3 : 1082–9. 7. Koyasu S. The role of PI3K in immune cells. Nat Immunol 2003; 4 : 313–9. 8. Fabre S, Lang V, Harriague J,et al. Stable activation of phosphatidylinositol 3-kinase in the T cell immunological synapse stimulates Akt signaling to FoxO1 nuclear exclusion and cell growth control. J Immunol 2005; 174 : 4161–71. 9. Fruman DA, Snapper SB, Yballe CM,et al. Impaired B cell development and proliferation in absence of phosphoinositide 3-kinase p85alpha. Science 1999; 283 : 393–7. 10. Okkenhaug K, Bilancio A, Farjot G,et al. Impaired B and T cell antigen receptor signaling in p110delta PI 3-kinase mutant mice. Science 2002; 297 : 1031–4. 11. Suzuki A, Yamaguchi MT, Ohteki T,et al. T cell-specific loss of Pten leads to defects in central and peripheral tolerance. Immunity 2001; 14 : 523–34. 12. Yoo JK, Cho JH, Lee SW, Sung YC. IL-12 provides proliferation and survival signals to murine CD4+ T cells through phosphatidylinositol 3-kinase/Akt signaling pathway. J Immunol 2002; 169 : 3637–43. 13. Stahl M, Dijkers PF, Kops GJ,et al. The forkhead transcription factor FoxO regulates transcription of p27Kip1 and Bim in response to IL-2. J Immunol 2002; 168 : 5024–31. 14. Sade H, Sarin A. IL-7 inhibits dexamethasone-induced apoptosis via Akt/PKB in mature, peripheral T cells. Eur J Immunol 2003; 33 : 913–9. 15. Blain SW, Massague J. Breast cancer banishes p27 from nucleus. Nat Med 2002; 8 : 1076–8. 16. Del Peso L, Gonzalez-Garcia M, Page C,et al. Interleukin-3-induced phosphorylation of BAD through the protein kinase Akt. Science 1997; 278 : 687–9. 17. Ohteki T, Parsons M, Zakarian A,et al. Negative regulation of T cell proliferation and interleukin 2 production by the serine threonine kinase GSK-3. J Exp Med 2000; 192 : 99–104. 18. Jones RG, Parsons M, Bonnard M, et al. Protein kinase B regulates T lymphocyte survival, nuclear factor kappaB activation, and Bcl-X(L) levels in vivo. J Exp Med 2000; 191 : 1721–34. 19. Birkenkamp KU, Coffer PJ. FOXO transcription factors as regulators of immune homeostasis : molecules to die for ? J Immunol 2003; 171 : 1623–9. 20. Matsuzaki H, Daitoku H, Hatta M,et al. Insulin-induced phosphorylation of FKHR (Foxo1) targets to proteasomal degradation. Proc Natl Acad Sci USA 2003; 100 : 11285–90. 21. Brunet A, Bonni A, Zigmond MJ,et al. Akt promotes cell survival by phosphorylating and inhibiting a Forkhead transcription factor. Cell 1999; 96 : 857–68. 22. Brunet A, Sweeney LB, Sturgill JF,et al. Stress-dependent regulation of FOXO transcription factors by the SIRT1 deacetylase. Science 2004; 303 : 2011–5. 23. Bouillet P, Metcalf D, Huang DC,et al. Proapoptotic Bcl-2 relative Bim required for certain apoptotic responses, leukocyte homeostasis, and to preclude autoimmunity. Science 1999; 286 : 1735–8. 24. Tang TT, Dowbenko D, Jackson A,et al. The forkhead transcription factor AFX activates apoptosis by induction of the BCL-6 transcriptional repressor. J Biol Chem 2002; 277 : 14255–65. 25. Medema RH, Kops GJ, Bos JL, Burgering BM. AFX-like Forkhead transcription factors mediate cell-cycle regulation by Ras and PKB through p27kip1. Nature 2000; 404 : 782–7. 26. Kops GJ, Medema RH, Glassford J,et al. Control of cell cycle exit and entry by protein kinase B-regulated forkhead transcription factors. Mol Cell Biol 2002; 22 : 2025–36. 27. Martinez-Gac L, Marques M, Garcia Z,et al. Control of cyclin G2 mRNA expression by forkhead transcription factors : novel mechanism for cell cycle control by phosphoinositide 3-kinase and forkhead. Mol Cell Biol 2004; 24 : 2181–9. 28. Leenders H, Whiffield S, Benoist C, Mathis D. Role of the forkhead transcription family member, FKHR, in thymocyte differentiation. Eur J Immunol 2000; 30 : 2980–90. 29. Lin L, Hron JD, Peng SL. Regulation of NF-kappaB, Th activation, and autoinflammation by the forkhead transcription factor Foxo3a. Immunity 2004; 21 : 203–13. 30. Yusuf I, Zhu X, Kharas MG,et al. Optimal B-cell proliferation requires phosphoinositide 3-kinase-dependent inactivation of FOXO transcription factors. Blood 2004; 104 : 784–7. |