| |
| Med Sci (Paris). 2006 May; 22(5): 472–473. Published online 2006 May 15. doi: 10.1051/medsci/2006225472.Des bactéries pour prévenir et traiter le cancer du col de l’utérus induit par le papillomavirus humain de type 16 Luis Bermudez-Humaran and Philippe Langella* Equipe « Interactions des probiotiques avec l’hote », Unite d’Ecologie et de Physiologie du Systeme Digestif, INRA, Domaine de Vilvert, 78352 Jouy-en-Josas Cedex, France MeSH keywords: Adjuvants immunologiques, Animaux, Antigènes viraux, Vecteurs de médicaments, Femelle, Papillomavirus humain de type 16, Interleukine-12, Lactococcus lactis, Souris, Protéines E7 des Papillomavirus, Infections à papillomavirus, Tumeurs du col de l'utérus, Vaccins antiviraux |
Le papillomavirus humain de type 16 (HPV-16) est un des virus à potentiel oncogène que l’on retrouve (avec le type 18) dans plus de 90 % des cancers du col de l’utérus (300 000 décès par an dans le monde) [
1]. Les stratégies actuelles pour prévenir ou traiter l’infection par ce virus sont prometteuses mais coûteuses. Des vaccins prophylactiques fondés sur des VLP (virus-like particles) ont récemment induit des baisses significatives des infections à l’HPV-16 et 18 et des cancers associés à ces infections en essais cliniques humains [
2,
3]. Cependant, ces vaccins agissent seulement au niveau de l’infection et n’ont aucun effet thérapeutique. Par ailleurs, ils demeurent d’un coût très élevé qui limite leur utilisation dans les pays en voie de développement où l’on dénombre environ 80 % de ce type de décès. Dans ce travail, nous avons utilisé une bactérie non pathogène, Lactococcus lactis, pour délivrer deux protéines d’intérêt médical : (1) l’antigène E7 du HPV-16 (E7), protéine retrouvée systématiquement dans des carcinomes provoqués par des infections par des HPV et un des antigènes candidats pour le développement d’une thérapie anti-HPV ; et (2) l’interleukine-12 (IL-12), une molécule stimulatrice de la réponse immunitaire cellulaire lors d’infections. L. lactis est une bactérie à Gram positif de statut alimentaire largement utilisée dans la production d’aliments fermentés et considérée comme une alternative attractive aux pathogènes atténués. Depuis une dizaine d’années, de nombreux travaux décrivent l’utilisation de L. lactis pour délivrer des antigènes au niveau des muqueuses [
4]. Notre but était d’induire ainsi l’immunité au niveau des muqueuses qui sont les sites d’entrée dans l’organisme de la plupart des agents pathogènes (comme l’HPV-16). De plus, de tels vaccins mucosaux, plus faciles à administrer et moins coûteux à produire que les vaccins injectables, seraient tout à fait adaptés à des campagnes massives de vaccination dans les pays en voie de développement. |
Construction et caractérisation in vivo des souches vaccinales Nous avons construit deux souches de L. lactis : la première produisant E7 (LL-E7) et la seconde produisant l’IL-12 (LL-IL12). L’IL-12 est une cytokine qui induit les cellules Th1 (T-helper 1), augmente le taux de maturation des lymphocytes T-cytotoxiques et induit la production d’IFN-γ. Elle est également capable de bloquer in vivo l’angiogenèse, notamment observée dans les développements de tumeurs. Cette cytokine a déjà été utilisée avec succès en immunothérapie pour traiter certains cancers et en tant qu’adjuvant de vaccins à ADN. Elle n’avait jusqu’alors jamais été produite chez une bactérie à Gram positif. Nous avons pu mettre en évidence une réponse immune spécifique d’E7 chez des souris à la suite de l’administration de LL-E7 [
5,
6]. Par ailleurs, nous avons constaté que la co-administration de LL-E7 et de LL-IL-12 améliorait significativement la réponse immune spécifique d’antigène [
7]. |
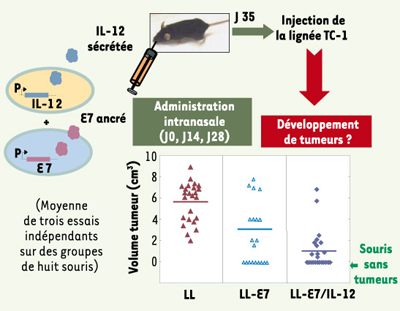
La vaccination à titre préventif : 50 % des souris vaccinées sont protégées de façon durable Nous avons testé in vivo les effets de la co-administration de ces bactéries chez des souris développant des tumeurs cancéreuses induites par une lignée tumorale exprimant E7 de l’HPV-16 (TC-1) [
8]. Pour cela, nous avons inoculé la lignée TC-1 à des souris immunisées avec LL-E7 seule ou avec LL-IL12. Nous avons observé que 50 % des souris vaccinées avec les deux souches n’ont développé aucune tumeur, contre 35 % chez les souris immunisées avec seulement LL-E7 [
9]. Par ailleurs, chez les 50 % restants, le volume des tumeurs était largement réduit (1/6 de celui des tumeurs des souris témoins vaccinées avec LL, la souche témoin ne produisant ni E7, ni l’IL-12), ce qui suggère une synergie de l’action prophylactique des deux protéines exprimées (Figure 1). De plus, les souris immunisées avec LL-E7 et LL-IL12 sont capables de résister à un second défi (2 mois après la première immunisation) suggérant que l’immunité induite est durable [9].
 | Figure 1.
La vaccination intranasale avec les deux souches LL-E7 et LL-IL-12 induit une protection contre des tumeurs induites par l’HPV-16 chez 50% des souris vaccinées. Des cellules d’une lignée tumorale exprimant l’antigène E7 (TC-1) ont été injectées en sous-cutané (à J35 après la première administration) à des souris vaccinées avec soit une souche sauvage de L. lactis (LL), soit la souche LL-E7, soit les deux souches LL-E7 et LL-IL-12. Le volume des tumeurs chez ces souris a été mesuré une fois par semaine ; 50 % des souris vaccinées avec LL-E7/IL-12 ne présentent pas de tumeurs. Trois mois plus tard, des cellules TC-1 ont été injectées à dix de ces souris vaccinées et à dix souris témoins non vaccinées : aucune des souris vaccinées n’a développé de tumeurs. |
|
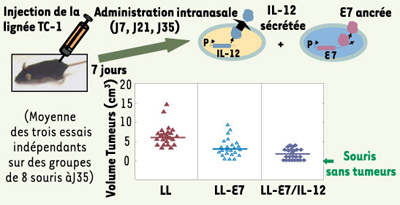
La vaccination à titre curatif : 35 % des souris traitées sont guéries Dans ce cas, la lignée TC-1 a d’abord été injectée aux souris et une fois constatée l’apparition de tumeurs (au bout de 7 jours), nous avons administré LL-E7 et LL-IL-12. Nous avons observé que 35 % des souris traitées avec les deux bactéries étaient capables d’inhiber le développement tumoral après quelques semaines et que leur volume était diminué chez les 65 % restant (aucune guérison constatée chez les souris traitées avec la souche LL-E7 ou la souche LL) (Figure 2) [9]. Un tel mode de vaccination aurait donc un potentiel curatif. Le mode d’administration joue lui aussi un rôle important. En effet, des travaux ont montré que seule la voie intranasale stimule efficacement la prolifération des lymphocytes T CD4 au niveau local, elle-même influant sur la production de lymphocytes B et T cytotoxiques [
10]. La combinaison E7/IL-12 induit donc deux réponses immunitaires parallèles, humorales et cellulaires, qui agissent ensemble pour induire une réponse efficace anti-HPV. Ces effets antitumoraux sont la conséquence d’une réponse cytotoxique dépendante des lymphocytes T CD4+ et CD8+ [9].
 | Figure 2.
La vaccination intranasale avec les deux souches LL-E7 et LL-IL-12 induit la régression des tumeurs induites par l’HPV-16 chez 35 % des souris traitées. Afin d’évaluer les effets thérapeutiques des deux souches LL-E7/IL12, des cellules TC-1 ont été injectées à des souris. Sept jours après l’injection, 100 % des souris avaient développé des tumeurs palpables. Les différentes souches de lactocoques ont alors été administrées à ces souris. Les tumeurs ont rapidement régressé chez 35 % des souris traitées avec les deux souches LL-E7/IL-12. Les souris traitées avec la seule souche LL-E7 présentent des tumeurs de taille inférieure à celles traitées avec la souche témoin LL. |
|
Conclusions et perspectives Nous démontrons ici l’efficacité de stratégies prophylactiques et thérapeutiques fondées sur des bactéries alimentaires non invasives contre les tumeurs induites par le HPV-16. Par rapport à des vaccinations plus conventio nnelles, notre stratégie présente les avantages suivants : (1) faible coût de production et administration aisée sans recours nécessaire à un personnel qualifié ; (2) réduction des effets secondaires liés à l’injection systémique d’adjuvants ; et (3) diminution du risque sanitaire lié à l’utilisation de seringues. La simplicité de sa fabrication (une simple culture de bactéries), son administration sous forme de spray nasal et ses propriétés curatives font de ce vaccin un candidat idéal pour lutter contre les infections au HPV 16 dans les pays en voie de développement en regard des vaccins et traitements actuels. |
1. Parkin DM, Bray FI, Devesa SS. Cancer burden in the year 2000: the global picture. Eur J Cancer 2001; 37 (suppl 8) : S4–66. 2. Koutsky LA, Ault KA, Wheeler CM, et al. Proof of principle study investigators. A controlled trial of a human papillomavirus type 16 vaccine. N Engl J Med 2002; 347 : 1645–51. 3. Harper DM, Franco EL, Wheeler C, et al. Efficacy of a bivalent L1 virus-like particle vaccine in prevention of infection with human papillomavirus types 16 and 18 in young women : a randomised controlled trial. Lancet 2004; 364 : 1757–65. 4. Hanniffy S, Wiedermann U, Repa A, et al. Potential and opportunities for use of recombinant lactic acid bacteria in human health. Adv Appl Microbiol 2004; 56 : 1–64. 5. Cortes-Perez NG, Bermúdez-Humarán LG, Le Loir Y, et al. Mice immunization with recombinant Lactococcus lactis displaying a cell-wall anchored human papillomavirus type 16 E7 protein. FEMS Microbiol Lett 2003; 229 : 37–42. 6. Bermúdez-Humarán LG, Cortes-Perez NG, Alcocer-González JM, et al. An inducible surface presentation system improves cellular immunity against E7 antigen after nasal administration with recombinant lactococci. J Med Microbiol 2004; 53 : 1–7. 7. Bermúdez-Humarán LG, Langella P, Cortes-Perez NG, et al. Intranasal immunization with recombinant Lactococcus lactis secreting murine interleukin-12 enhances antigen-specific Th1 cytokine production. Infect Immun 2003; 71 : 1887–96. 8. Lin KY, Guarnieri FG, Staveley-O’Carroll KF, et al. Treatment of established tumors with a novel vaccine that enhances major histocompatibility class II presentation of tumor antigen. Cancer Res 1996; 56 : 21–6. 9. Bermúdez-Humarán LG, Cortes-Perez NG, Lefèvre F, et al. A novel mucosal vaccine based on live lactococci expressing E7 antigen and IL-12 induces systemic and mucosal immune responses and protects mice against human papillomavirus type 16-induced tumors. J Immunol 2005; 175 : 7297–302. 10. Liu XS, Abdul-Jabbar I, Qi YM, et al. Mucosal immunisation with papillomavirus virus-like particles elicits systemic and mucosal immunity in mice. Virology 1998; 252 : 39-45.EDK 25/2/06 |