| |
| Med Sci (Paris). 2006 April; 22(4): 437–443. Published online 2006 April 15. doi: 10.1051/medsci/2006224437.Terutroban et récepteurs TP endothéliaux dans l’athérogenèse Tony J. Verbeuren* Division d’Angiologie, Institut de Recherche Servier, 11, rue des Moulineaux, 92150 Suresnes, France |
Le récepteur TP est le récepteur du thromboxane A2 (TXA2), l’un des principaux métabolites de l’acide arachidonique. L’activation des récepteurs TP par le TXA2, ou par d’autres ligands, provoque l’agrégation des plaquettes, la vasoconstriction et la bronchoconstriction. Les récepteurs TP interviennent également dans la prolifération cellulaire, l’apoptose et l’angiogenèse. Le terutroban (S 18886) est un antagoniste puissant et sélectif des récepteurs TP ; actif par voie orale et présentant une longue durée d’action, il est actuellement en phase III de son développement clinique pour le traitement et la prévention des maladies cardiovasculaires. Il a également permis, au cours de récentes expériences menées dans des modèles d’athérosclérose, de montrer l’importance des récepteurs TP endothéliaux dans les mécanismes d’adhérence cellulaire pathologique. |
De la découverte du TXA2 aux récepteurs TP En 1975, Samuelson et ses collaborateurs ont rapporté l’existence d’un métabolite instable de l’acide arachidonique, le thromboxane A2, dérivé oxane produit par les plaquettes sanguines (les thrombocytes) [
1]. L’enzyme responsable de sa synthèse est la thromboxane synthétase [
2]. L’aspirine bloque la synthèse du TXA2 [2] en inhibant la cyclo-oxygénase (COX) (dont il existe deux isoformes, COX-1 et COX-2), une enzyme responsable de la formation des endoperoxydes de l’acide arachidonique [
3]. Métabolite dominant de l’acide arachidonique (Figure 1) produit par les plaquettes activées, le TXA2 est considéré comme l’un des plus puissants activateurs des plaquettes et agents vasoconstricteurs. Un dérèglement de sa synthèse ou de son action est retrouvé dans de nombreuses maladies (maladies cardiovasculaires, asthme). L’aspirine, l’un des traitements majeurs dans la prévention des pathologies vasculaires coronaires et cérébrales, agit ainsi en inhibant la synthèse du TXA2 [3].  | Figure 1.
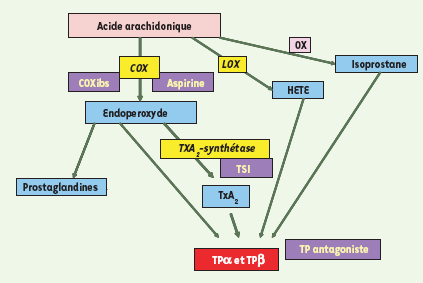
Des métabolites de l’acide arachidonique, formés par des voies différentes, peuvent activer les récepteurs TP. Le thromboxane A2 (TXA2) et son précurseur, l’endoperoxyde (PGH2), sont formés par la voie de la cyclo-oxygénase (COX), tandis que les HETE (hydroxyeicosatetraenoic acids) sont formés par la voie de la lipoxygénase (LOX). Les isoprostanes sont, quant à elles, issues de l’oxydation non enzymatique (OX) de l’acide arachidonique. Les inhibiteurs de la COX, aspirine et Coxibs (inhibiteurs sélectifs de la COX), préviennent la formation de l’endoperoxyde, tandis que les inhibiteurs de la TXA2 synthétase (TSI) préviennent spécifiquement la synthèse du TXA2. Les antagonistes des récepteurs TP (TPr) bloquent de façon spécifique l’action du TXA2 sur son récepteur. |
Le TXA2 se lie avec des récepteurs membranaires spécifiques (Figure 1), les récepteurs TP, qui appartiennent à la classe des récepteurs des prostanoïdes (P) et possèdent une haute affinité pour le TXA2 (T) [
4]. Deux isoformes, TPα et TPβ, existent chez l’homme, mais probablement pas chez les autres espèces ; dérivées d’un épissage alternatif, elles sont identiques pour leurs 328 résidus aminoterminaux [4–
6]. Le mode de signalisation majeur du récepteur TP est l’activation des β-isozymes de la phospholipase C, qui aboutit à un turnover de phosphatidylinositol et à la libération de calcium ; au moins 9 protéines G peuvent être impliquées. La différence principale entre les deux isoformes des récepteurs TP siège dans la modulation de l’adénylyl cyclase, activée par TPα mais inhibée par TPβ [
7]. La caractérisation moléculaire et fonctionnelle complète des récepteurs TP nécessite encore des études complémentaires. |
Le terutroban (S 18886), un antagoniste sélectif des récepteurs TP Une fois l’importance du TXA2 comme vasoconstricteur puissant et activateur des plaquettes reconnue, et le lien entre l’action de l’aspirine et l’inhibition de la synthèse du TXA2 établi, la recherche de composés capables d’inhiber de façon plus spécifique la synthèse ou l’action du TXA2 a débuté. Les inhibiteurs de la thromboxane synthétase (TSI) (Figure 1) ont montré une activité assez décevante dans les études cliniques [
8,
9]. Quant aux premiers antagonistes sélectifs des récepteurs TP (Figure 1) décrits, ils appartenaient à une série d’acides 13-azaprostanoïques bloquant les actions pharmacologiques de l’U46619, un agoniste puissant et sélectif des récepteurs TP [8]. Le premier antagoniste des récepteurs TP de structure non prostanoïde décrit a été le BM 13177, ou sulotroban ; plusieurs autres antagonistes ont été développés depuis, comme le daltroban, le ramatroban et le seratrodast. Le terutroban, S 18886 (Figure 2), issu de la recherche du Groupe Servier, appartient à cette famille d’antagonistes des récepteurs TP. 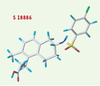 | Figure 2.
Structure du terutroban (S 18886).
|
L’Institut de Recherche Servier (IDRS) s’est engagé dans le domaine de la recherche sur la thrombose au début des années 90, avec pour objectif initial de rechercher un antagoniste des récepteurs TP. Le S 18204 a été découvert en 1993 [
10,
11], et ses propriétés antiplaquettaires et antivasoconstrictrices ont été étudiées : cette substance racémique est un antagoniste des récepteurs TP, puissant, sélectif, actif par voie orale ; il possède une longue durée d’action, et diminue la micro-albuminurie chez le rat diabétique [
12–
14]. Ces résultats ont été confirmés avec le terutroban, son énantiomère actif, qui peut également démasquer les actions relaxantes puissantes des prostaglandines PGI2 et PGD2 [
15]. Le terutroban se lie de façon spécifique et durable aux récepteurs TP plaquettaires [
16]. Une étude clinique a permis de montrer que la concentration plasmatique minimale nécessaire pour obtenir un effet anti-agrégant pendant 24 heures est obtenue dès une dose d’administration de 10 mg [
17]. Le terutroban, administré à cette dose à des patients coronariens déjà traités par l’aspirine, améliorait leur fonction endothéliale [
18] ; le dysfonctionnement endothélial chez ces patients semblait impliquer une production de métabolites de l’acide arachidonique (des isoprostanes) indépendante de la COX, et pouvant activer les récepteurs TP [18]. Une surproduction de substances vasoconstrictrices peut en effet provoquer une dysfonction endothéliale, comme cela a été démontré au cours de l’hypertension [
19]. Plusieurs études précliniques réalisées avec le terutroban ont montré qu’un agoniste des récepteurs TP, produit par l’activité de la COX-1 et libéré par l’endothélium, est à l’origine de ce dysfonctionnement chez le rat hypertendu SHR (spontaneously hypertensive rat) [
20]. Enfin, l’activité antithrombotique du terutroban a été confirmée chez différents modèles animaux (cobaye, chien et porc) [14,
21,
22]. L’ensemble de ces études témoigne que le terutroban, en inhibant les récepteurs TP, possède des effets antivasoconstricteurs et antithrombotiques puissants, compatibles avec le rôle reconnu de ces récepteurs vasculaires et plaquettaires. Mais le terutroban a encore d’autres actions… |
Rôle des récepteurs TP dans l’athérosclérose L’infarctus du myocarde, l’artériopathie des membres inférieurs et l’accident vasculaire cérébral sont largement liés à la formation de plaques d’athérosclérose dans les artères. Ces plaques, nées d’une activation des cellules endothéliales et mettant en jeu l’ensemble du processus d’inflammation, influent également sur l’activité vasomotrice des artères. L’observation de l’absence totale de relaxation dépendante de l’endothélium dans des artères athéromateuses prélevées chez des lapins hypercholestérolémiques [
23,
24] a conduit à de nombreuses études sur le dysfonctionnement endothélial. Il est probable que le manque d’intérêt pour le rôle du TXA2 et des récepteurs TP dans le développement des plaques athéromateuses provient du peu de preuves cliniques ou expérimentales en faveur d’une action de l’aspirine, ou d’autres agents antiplaquettaires, sur l’athérosclérose [
25]. De fait, une étude, seulement, a montré qu’un antagoniste des récepteurs TP, le daltroban, réduit le dépôt de cholestérol et la formation de plaques dans l’artère coronaire de lapins hypercholestérolémiques [
26]. Avec l’équipe de Richard Cohen, nous avons débuté l’évaluation de l’effet du terutroban sur le développement de la maladie athéroscléreuse en 1998. En quoi l’inhibition des récepteurs TP serait-elle supérieure à une inhibition de la COX par l’aspirine ? Notre hypothèse était la suivante : l’activation des récepteurs TP n’intervient pas seulement par le TXA2, mais également par d’autres prostaglandines (PGH2, PGF2α), ainsi que par des métabolites de l’acide arachidonique non dépendants de l’activité de la COX, tels que les acides hydroxy-eicosatétra-énoïques (HETE) [
27] ou les isoprostanes [
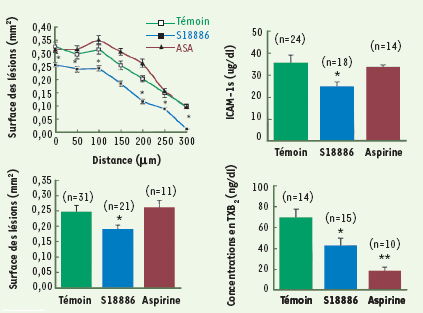
28] (Figure 1). Ces composés, dont la production est augmentée au cours de l’athérosclérose, pourraient accélérer la formation des plaques d’athérome par une activation des récepteurs TP non sensibles à l’aspirine, probablement des récepteurs TP endothéliaux d’isoforme TPβ [25]. Dans une première étude [25], des souris déficientes en apolipoprotéine E (ApoE KO), qui développent des lésions athéromateuses dans la crosse de l’aorte, ont été traitées pendant 12 semaines avec le terutroban (5 mg/kg/j), l’aspirine (30 mg/kg/j) ou un placebo. Aucune modification du poids corporel ou de la cholestérolémie n’a été observée. Le terutroban réduisait la surface des lésions d’environ 25 %, tandis que l’aspirine était sans effet sur ce paramètre, malgré une forte diminution des concentrations sanguines de TXA2
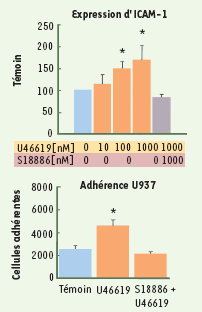
(Figure 3) : l’activation des récepteurs TP contribuait donc à la formation de lésions athéromateuses dans ce modèle, mais sans implication du TXA2 ; en revanche, la production d’une isoprostane pouvait jouer un rôle. Le laboratoire de Richard Cohen a ensuite montré que le terutroban, mais pas l’aspirine, diminuait de 25 % les concentrations d’ICAM1 (intercellular adhesion molecule 1) soluble chez les souris ApoE KO [25] : l’effet du terutroban pouvait donc être lié à l’inhibition de l’expression de molécules d’adhérence (Figure 3), ce qui a été confirmé dans un modèle de cellules endothéliales ombilicales humaines (HUVEC) : l’ agoniste des récepteurs TP, le U 46619, augmente l’expression de l’ICAM-1 à la surface de la membrane des HUVEC [25,
29], ainsi que l’adhérence de monocytes, ces effets étant totalement inhibés par le terutroban à la dose de 1 µM [25] (Figure 4).  | Figure 3.
Le terutroban (S 18886) diminue l’athérosclérose chez la souris déficiente en ApoE. À gauche : le terutroban à la dose de 5 mg/kg/j, contrairement à l’aspirine (30 mg/kg/j), diminue les lésions athéromateuses aortiques sur toute la longueur de l’aorte (en haut), en moyenne de 25 % (en bas). À droite : le terutroban, mais pas l’aspirine, diminue de 30 % les concentrations plasmatiques d’ICAM1 (en haut) ; l’aspirine inhibe fortement, et le terutroban moyennement, les concentrations plasmatiques de TXB 2 (en bas). Ces résultats suggèrent que l’effet anti-athéromateux du terutroban pourrait être lié à son effet sur l’expression des molécules d’adhérence (d’après [ 25]). ASA : acide acétylsalicylique (aspirine) ; TXB 2: thromboxane B 2; ICAM1(s) : intercellular adhesion molecule 1 (soluble). * Valeur S18886 significativement plus basse que la valeur témoin (p < 0,05). ** Valeur aspirine significativement plus basse que la valeur témoin (p < 0,05). |
 | Figure 4.
Le terutroban (S 18886) inhibe l’expression de l’ICAM1 (en haut) et l’adhérence des monocytes (en bas) provoquées par l’agoniste des récepteurs TP, le U 46619. * Augmentation significative obtenue avec le U46619 (p < 0,05) (d’après [ 25]). |
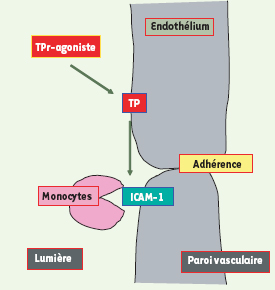
À partir de ces données, nous avons formulé une hypothèse selon laquelle l’athérogenèse dépendrait, au moins en partie, de l’activation, indépendante du TXA2, de récepteurs endothéliaux ; cette activation entraînerait l’expression de molécules d’adhérence et une infiltration subséquente de leucocytes inflammatoires pro-athérogènes dans la paroi artérielle (Figure 5). La suppression de l’expression des récepteurs TP (TP KO) dans un modèle de souris ApoE KO retarde l’athérogenèse, cet effet pouvant être attribué à l’inhibition de l’activité plaquettaire et des interactions entre leucocytes et cellules endothéliales [
30]. 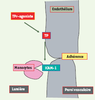 | Figure 5.
Effet de l’activation des récepteurs TP endothéliaux. Le TXA2 active le récepteur TP endothélial, ce qui résulte en une expression de molécules d’adhérence comme ICAM1, et à une adhérence des monocytes à la paroi vasculaire. |
Contrairement au traitement par l’aspirine, l’administration de terutroban à des souris ApoE KO rendues diabétiques permet d’obtenir, de façon très importante, une diminution de l’apparition des plaques d’athérome, sans pour autant influer sur les paramètres métaboliques (Figure 6) [
31]. Le dysfonctionnement endothélial observé chez ces souris est prévenu par le traitement avec le terutroban [31] ; ces résultats concordent avec ceux d’une étude, réalisée chez le lapin hypercholestérolémique, ayant montré que le ramatroban améliore les réponses réduites à l’acétylcholine, probablement en inhibant l’action d’une isoprostane sur des récepteurs TP [
32]. Enfin, l’étude de cellules endothéliales aortiques humaines démontre que la diminution de l’expression de la NO-synthétase endothéliale (eNOS) et l’augmentation de l’expression des molécules d’adhérence ICAM1 et VCAM-1 (vascular cell adhesion molecule 1), provoquées par le U 46619, le TNFα ou une concentration de glucose élevée, n’apparaissent plus dans les cellules traitées par le terutroban [31]. 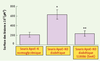 | Figure 6.
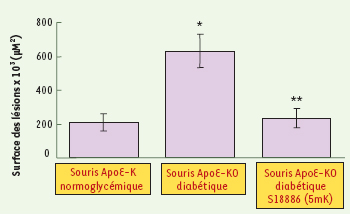
Le terutroban (S 18886) inhibe fortement les lésions athéromateuses dans l’aorte de souris déficientes en ApoE, rendues diabétiques. Les lésions aortiques sont plus importantes chez la souris ApoE diabétique que chez la souris ApoE. Le traitement avec le terutroban à la dose de 5 mg/kg/j (5mK) diminue fortement la formation de ces lésions. * Surface de lésions plus importante chez la souris ApoE-KO diabétique que chez la souris ApoE-KO normoglycémique (p < 0,05). ** Surface de lésions moins importante chez la souris ApoE-KO diabétique traitée avec le S18886 que chez la souris ApoE-KO diabétique non traitée (p < 0,05) (d’après [
37]). |
Le travail initial de Cohen et de ses collaborateurs, montrant l’effet bénéfique du terutroban sur l’athérogenèse, a été confirmé dans plusieurs autres études [
33–
36]. Le rôle de la prostacycline dans les effets bénéfiques du terutroban a également été souligné chez les souris surexprimant le récepteur TP humain (TP OE), ainsi que chez les souris invalidées pour les récepteurs TP (TP KO) [
34]. Quant aux résultats de l’étude d’Egan et de ses collaborateurs [33], ils montrent que les agonistes des récepteurs TP sont impliqués dans la genèse et la progression initiale de l’athérosclérose chez la souris Apobec-1/LDL receptor KO, mais ne jouent pas de rôle important lorsque la maladie est établie dans ce modèle. L’implication des récepteurs TP dans d’autres modèles d’athérosclérose a également été étudiée avec le terutroban. Julie Campbell et ses collaborateurs ont examiné les effets du terutroban sur le développement des stries lipidiques et des lésions athéromateuses plus avancées dans un modèle d’athérosclérose et de resténose chez le lapin : le traitement réduisait les lésions artérielles, l’expression de l’ICAM-1 et l’accumulation des macrophages après deux procédures d’introduction d’un ballonnet dans l’artère [
35]. Les données de cette étude confirment les résultats initiaux de Richard Cohen et de ses collaborateurs, et y ajoutent l’effet sur l’infiltration des macrophages, renforçant ainsi notre hypothèse. Worth et de ses collaborateurs sont arrivés à la conclusion que le terutroban peut favoriser la stabilité des plaques d’athérome en interférant avec le processus inflammatoire qui conduit ultimement à la rupture et à la thrombose [35]. L’étude de Juan Badimon et de ses collaborateurs a, quant à elle, montré que le terutroban peut provoquer la régression des plaques athéromateuses avancées et transformer ces lésions en un phénotype plus stable [36]. Ces résultats concordent avec ceux de l’équipe de Julie Campbell [35] et avec les résultats obtenus dans les modèles de souris [25, 31], l’exception étant l’étude d’Egan et al. [33] qui suggèrent que le terutroban n’aurait pas d’impact sur les lésions avancées. Les données scientifiques confirment généralement les observations initiales quant au rôle joué par l’activation des récepteurs TP dans l’athérogenèse et dans la progression de la maladie, par l’intermédiaire de l’adhérence cellulaire et de l’infiltration des monocytes/macrophages. Les récepteurs TP endothéliaux, contrairement aux récepteurs TP des plaquettes ou des cellules musculaires lisses, n’ont pas encore été étudiés en détail et leurs mécanismes doivent être éclaircis. Une première étude de Cohen et de ses collaborateurs indique que l’activation des récepteurs TP endothéliaux est impliquée dans les phénomènes d’oxydation présents dans la néphropathie diabétique [37]. Il semble évident que les antagonistes des récepteurs TP, en inhibant les récepteurs TP endothéliaux, possèdent des propriétés anti-athéromateuses puissantes, comme l’a montré la recherche menée avec le terutroban. |
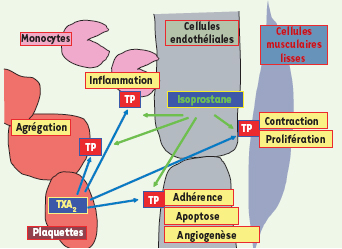
La découverte du terutroban (S 18886) en 1993 a été à l’origine d’une série d’études mettant en évidence le rôle des récepteurs TP (les récepteurs du TXA2) dans le développement des lésions athéromateuses. L’activation des récepteurs TP joue un rôle dans la thrombose (agrégation plaquettaire par les récepteurs TP plaquettaires) et dans les vasospasmes (vasoconstriction par les récepteurs TP des cellules musculaires lisses). Nous savons maintenant que l’adhérence cellulaire et l’infiltration monocytaire sont également sous contrôle des récepteurs TP, localisés sur les cellules endothéliales et appartenant à l’isoforme TPβ (Figure 7). Il convient de signaler que des récepteurs TP monocytaires ont également été décrits [
38] (Figure 7), mais que leur rôle dans la physiologie et la physiopathologie est encore à déterminer. 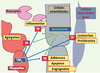 | Figure 7.
Localisation et activité des récepteurs TP vasculaires. L’activation des récepteurs TP présents sur les plaquettes provoque leur agrégation. L’activation des récepteurs TP monocytaires, encore mal étudiée, pourrait être impliquée dans l’inflammation. L’activation des récepteurs TP des cellules musculaires lisses provoque leur contraction et leur prolifération. L’activation des récepteurs TP présents sur les cellules endothéliales provoque l’expression de molécules d’adhérence, impliquant ces récepteurs dans l’athérosclérose ; ces récepteurs TP endothéliaux semblent également être impliqués dans l’apoptose et l’angiogenèse. |
L’activation des récepteurs TP peut conduire à la prolifération des cellules musculaires lisses [
39] et être impliquée dans l’apoptose et dans l’angiogenèse [
40]. Certains de ces effets peuvent aider à expliquer le rôle des récepteurs TP dans l’athérogenèse. Par ailleurs, les processus inflammatoires jouent un rôle essentiel dans le développement des maladies cardiovasculaires, et sont primordiaux dans l’athérogenèse. Des résultats récents plaident pour une activation des récepteurs TP endothéliaux, qui conduirait à l’expression des molécules d’adhérence et à l’infiltration des cellules inflammatoires (Figure 7) au cours de la formation des plaques. En raison de sa capacité à inhiber ces récepteurs TP, le terutroban exerce donc un effet bénéfique protecteur en bloquant la genèse et la progression des lésions athéromateuses [
41]. Les isoprostanes, métabolites de l’acide arachidonique résultant du stress oxydatif, pourraient intervenir dans l’activation des récepteurs TP sans intervention directe du TXA2 [25, 31, 37] ; ainsi, le lien entre les récepteurs TP, le stress oxydatif et l’athérosclérose semble évident [37]. On notera que le terutroban inhibe complètement l’action des isoprostanes, tandis que l’aspirine n’inhibe ni leur production, ni leur action. Les propriétés pro-athérogènes de l’isoprostane F2α-III ont récemment été rapportées dans deux modèles de souris, ApoE KO et LDLr KO, ces effets étant observés à une dose qui double la concentration plasmatique de l’isoprostane [
42]. La triple activité antithrombotique, antivasoconstrictrice et anti-athéromateuse du terutroban, observée dans des études expérimentales précliniques, est confortée par les premiers résultats de développement clinique et positionne le terutroban comme un médicament innovant, au potentiel unique pour le traitement des maladies cardiovasculaires. |
Je remercie mon ami et collègue Gilbert Lavielle qui, avec les membres de son équipe, a réussi la synthèse (complexe) du terutroban en 1993, et m’a aidé à rédiger le présent manuscrit. Mes remerciements aussi à l’équipe d’angiologie de l’IDRS, qui a contribué à l’exploration pharmacologique du terutroban. Un grand remerciement à mon ami Richard Cohen et à son équipe à Boston, pour un travail scientifique remarquable mettant en évidence les propriétés anti-athéromateuses du terutroban. Et je remercie aussi l’équipe de développement de Courbevoie pour les études de pharmacologie qu’ils ont fait réaliser avec le terutroban dans le domaine de l’athérosclérose. Mes remerciements à Mme Christine Lamarche-Arène pour l’aide rédactionnelle. Et, enfin, j’ai apprécié le soutien, les suggestions et les commentaires du Dr Emmanuel Canet, vice-président de la recherche Servier.
|
1. Hamberg M, Svennsson J, Samuelson B. Thromboxanes : a new group of biologically active compounds derived from prostaglandin endoperoxides. Proc Natl Acad Sci USA 1975; 72 : 2994–8. 2. Vane JR, Flower R, Botting RM. The mechanism of action of aspirin. In : Vane JR, Botting RM, eds. Aspirin and other salicylates. London : Chapman and Hall Medical, 1992 : 35–59. 3. Awtry EH, Loscalzo J. Aspirin. Circulation 2000; 101 : 1206–18. 4. Narumiya S, Sugimoto Y, Ushikubi F. Prostanoid receptors : structures, properties, and functions. Physiol Rev 1999; 79 : 1193–226. 5. Halushka PV. Thromboxane A2 receptors : where have you gone ? Prostagl Lipid Med 2000; 60 : 175–89. 6. Hirata M, Ushikubi F, Kakizuka A, et al. Two thromboxane A2 receptor isoforms in human platelets. Opposite coupling to adenylyl cyclase with different sensitivities to Arg60 to Leu mutation. J Clin Invest 1996; 97 : 949–56. 7. Kinsella BT. Thromboxane A2 signalling in humans : a "tail" of two receptors. Biochem Soc Trans 2001 : 29 : 641–54. 8. Hall SE. Thromboxane A2 receptor antagonists. Med Res Rev 1991; 11 : 503–79. 9. Dogné JM, Hanson J, de Leval X, et al. New developments on thromboxane modulators. Mini Rev Med Chem 2004; 4 : 649–57. 10. Verbeuren TJ, Simonet S, Descombes JJ, et al. S 18204 : a new powerful TXA2-receptor antagonist with a long duration of action. Thromb Haemost 1995; 73 : 1324. 11. Cimetière B, Dubuffet T, Muller O, et al. Synthesis and biological evaluation of new tetrahydronaphthalene derivatives as thromboxane receptor antagonists. Bioorg Med Chem Lett 1998; 8 : 1375–80. 12. Verbeuren TJ, Vallez MO, Petit C, et al. Amelioration of albuminuria in the diabetic rat by S 18204, an anti-thromboxane receptor antagonist. Circulation 1995; 92 : 222. 13. Simonet S, Descombes JJ, Vallez MO, et al. S 18886, a new thromboxane (TP)-receptor antagonist is the active isomer of S 18204 in all species, except in the guinea-pig. In : Sinzinger H et al., eds. Recent advances in prostaglandin, thromboxane and leukotriene research. New York : Plenum Press, 1998 : 173–6. 14. Vallez MO, Rupin A, De Nanteuil G, Verbeuren T. Synergistic antithrombotic effects of the TP-receptor antagonist S 18886 and the direct thrombin inhibitor S 31307 in a thrombosis model of the rat abdominal aorta. Thromb Haemost 2001; P1625. 15. Verbeuren T, Descombes JJ, Simonet S, et al. The TP-receptor antagonist S 18886 unmasks vascular relaxation and potentiates the anti-platelet action of PGD2. Thromb Haemost 1997; 693. 16. Descombes JJ, Menant Y, Lavielle G, Verbeuren TJ. Binding properties of a potent, long acting new thromboxane receptor antagonist, [3H] S 18886, on human, rat and dog platelet membranes. Br J Pharmacol 1997; 122 : 381P. 17. Gaussem P, Rény JL, Thalamas C, et al. The specific thromboxane receptor antagonist S 18886 : pharmacokinetic and pharmacodynamic studies. J Thromb Haemost 2005; 3 : 1437–45. 18. Belhassen L, Pelle G, Dubois-Rande JL, Adnot S. Improved endothelial function by the thromboxane A2 receptor antagonist S 18886 in patients with coronary artery disease treated with aspirin. J Am Coll Cardiol 2003; 41 : 1198–204. 19. Taddei S, Virdis A, Ghiadoni L, et al. Endothelial dysfunction in hypertension. J Cardiovasc Pharmacol 2001; 38 : S11–4. 20. Yang D, Félétou M, Levens N, et al. A diffusible substance(s) mediates endothelium-dependent contractions in the aorta of SHR. Hypertension 2003; 41 : 143–8. 21. Maalej N, Osman HE, Shanmuganayagam D, et al. Antithrombotic properties of the thromboxane A2/prostaglandin H2 receptor antagonist S18886 on prevention of platelet-dependent cyclic flow reductions in dogs. J Cardiovasc Pharmacol 2005; 45 : 389–95. 22. Osende JI, Shimbo D, Fuster V, et al. Antithrombotic effects of S 18886, a novel orally active thromboxane A2 receptor antagonist. J Thromb Haemost 2004; 2 : 492–8. 23. Verbeuren TJ, Jordaens FH, Zonnekeyn LL, et al. Effect of hypercholesterolemia on vascular reactivity in the rabbit. I. Endothelium-dependent and endothelium-independent contractions and relaxations in isolated arteries of control and hypercholesterolemic rabbits. Circ Res 1986; 58 : 552–64. 24. Verbeuren TJ. Endothelium and coronary atherosclerosis, an update. Coronary Artery Disease 1993; numéro spécial : 72–87. 25. Cayatte AJ, Du Y, Oliver-Krasinski J, et al. The thromboxane-receptor antagonist, S 18886 but not aspirin inhibits atherogenesis in apolipoprotein E deficient mice : evidence that eicosanoids other than thromboxane contribute to atherosclerosis. Arterioscler Thromb Vasc Biol 2000; 20 : 1724–8. 26. Osborne JA, Lefer AM. Cardioprotective actions of thromboxane receptor antagonism in ischemic atherosclerotic rabbits. Am J Physiol 1988; 255 : H318–24. 27. Van Diest M, Herman AG, Verbeuren TJ. Influence of hypercholesterolemia on the reactivity of isolated rabbit arteries to 15-lipoxygenase metabolites of arachidonic acid : comparison with platelet-derived agents and vasodilators. Prostaglandins Leukot Essent Fatty Acids 1996; 54 : 135–45. 28. Montuschi P, Barnes PJ, Roberts LJII. Isoprostanes : markers and mediators of oxidative stress. FASEB J 2004; 18 : 1791–800. 29. Ishizuka T, Suzuki K, Kawakami M, et al. Thromboxane A2 receptor blockade suppresses intercellular adhesion molecule-1 expression by stimulated vascular endothelial cells. Eur J Pharmacol 1996; 312 : 367–77. 30. Kobayashi T, Tahara Y, Matsumoto M, et al. Roles of thromboxane A2 and prostacyclin in the development of atherosclerosis in apoE-deficient mice. J Clin Invest 2004; 114 : 784–94. 31. Zuccollo A, Shi C, Mastroani R, et al. The thromboxane A2 receptor antagonist, S 18886, prevents enhanced atherogenesis caused by diabetes mellitus. Circulation 2005; 112 : 3001–8. 32. Ishizuka T, Matsui T, Kurita A. Ramatroban, a TP receptor antagonist, improves vascular responses to acetylcholine in hypercholesterolemic rabbits in vivo. Eur J Pharmacol 2003; 468 : 27–35. 33. Egan KM, Wang M, Lucitt MB, et al. Cyclooxygenases, thromboxane, and atherosclerosis : plaque destabilization by cyclooxygenase-2 inhibition combined with thromboxane receptor antagonism. Circulation 2005; 111 : 334–42. 34. Cheng Y, Austin SC, Rocca B, et al. Role of prostacyclin in the cardiovascular response to thromboxane A2.
Science 2002; 296 : 539–41. 35. Worth NF, Berry CL, Thomas AC, Campbell JH. S18886, a selective TP receptor antagonist, inhibits development of atherosclerosis in rabbits. Atherosclerosis 2005; 183 : 65–73. 36. Viles-Gonzalez JF, Fuster V, Corti R, et al. Atherosclerosis regression and TP receptor inhibition : effect of S 18886 on plaque size and composition. A magnetic resonance imaging study. Eur Heart J 2005; 26 : 1557–61. 37. Xu S, Maitland KA, Jiang B, et al. The thromboxane receptor antagonist S18886 attenuates renal oxidant stress and proteinuria in diabetic Apo E-deficient mice. Diabetes 2006; 55 : 110–9. 38. Simmons TR, Cook JA, Moore JN, Halushka PV. Thromboxane A2 receptors in equine monocytes : identification of a new subclass of TXA2 receptors. J Leukoc Biol 1993; 53 : 173–8. 39. Nagata T, Uehara Y, Numabe A, et al. Regulatory effect of thromboxane A2 on proliferation of vascular smooth muscle cells from rats. Am J Physiol 1992; 263 : H1331–8. 40. Gao Y, Yokota R, Tang S, et al. Reversal of angiogenesis in vitro, induction of apoptosis, and inhibition of Akt phosphorylation in endothelial cells by thromboxane A2. Circ Res 2000; 87 : 739–45. 41. Verbeuren TJ, Cohen RA. Role of TP-receptors in atherosclerosis and vascular endothelial dysfunction. In : Abstracts of the Symposium on endothelial factors and coronary disease. Hong Kong, China, 2004 : 22 (abstract). 42. Tang M, Cyrus T, Yao Y, et al. Involvement of thromboxane receptor in the proatherogenic effect of isoprostane F2a-III. Evidence from apolipoprotein E- and LDL receptor-deficient mice. Circulation 2005; 112 : 2867–74. |