| |
| Med Sci (Paris). 2006 April; 22(4): 405–410. Published online 2006 April 15. doi: 10.1051/medsci/2006224405.Ebola et Marburg : les homes contre-attaquent Nathalie Alazard-Dany, Michèle Ottmann Terrangle, and Viktor Volchkov* Laboratoire des Filovirus, Inserm U758, ENS Lyon, IFR 128 BioSciences Lyon-Gerland, Université Claude Bernard Lyon 1, 21, avenue Tony Garnier, 69365 Lyon Cedex 07, France |
« Ebola 2002 & 2003 » et « O trio contra Marburg » ne sont pas les titres de nouveaux films à sensation mettant en scène les dangereux virus Ebola et Marburg, mais de chansons composées par des musiciens locaux lors de récentes épidémies. À leur façon, ces musiciens ont contribué à l’important effort d’information des populations touchées par ces fièvres hémorragiques virales. En effet, les mesures d’isolement des malades et de suivi de leurs proches imposées lors des épidémies sont très mal acceptées. Cette réaction est compréhensible : en l’absence de vaccin ou de traitement, l’entrée dans le pavillon d’isolement est le plus souvent synonyme de mort. L’application stricte des mesures de quarantaine est pourtant indispensable au contrôle des épidémies. L’identification précoce des premiers cas, qui incombe aux réseaux de surveillance et d’alerte, est elle aussi capitale pour limiter le nombre de victimes. En 2005, une épidémie à virus Ebola en République du Congo, détectée très tôt, n’a fait qu’une dizaine de victimes, alors qu’une épidémie à virus Marburg en Angola, détectée plus tardivement, a fait plus de trois cents morts. Adapter au mieux les mesures de quarantaine pour qu’elles soient plus facilement acceptées et améliorer encore les réseaux de veille sanitaire sont les préoccupations constantes des équipes locales et internationales impliquées dans la lutte contre ces fièvres hémorragiques (http://www.who.int). Le virus Marburg et le virus Ebola (qui comprend quatre espèces différentes) sont des virus enveloppés à ARN négatif simple brin qui forment la famille des Filoviridae. Leur réservoir naturel reste mal connu, mais la plupart des épidémies humaines commencent lors d’un contact avec des animaux - eux aussi victimes de ces virus - trouvés morts en forêt [
1] (→). La surveillance des épidémies à virus Ebola qui déciment les populations de grands singes a d’ailleurs déjà permis de prévoir avec plusieurs semaines d’avance l’apparition d’épidémies humaines [
2,
3]. Ces virus se transmettent à la faveur de contacts avec des fluides corporels infectés, et se propagent principalement dans la population lors d’activités de soins ou de rituels funéraires non protégés. Pour combattre et étudier ces virus, le seul moyen de s’en protéger reste donc le port de tenues de protection prévenant tout contact avec les liquides potentiellement contaminés (Figure 1). Les autorités s’inquiètent de l’augmentation du nombre d’épidémies en Afrique [2,
4], mais aussi de l’utilisation potentielle de ces virus à des fins bioterroristes. Cependant, la recherche progresse : deux avancées significatives vers le développement d’un traitement [
5] et d’un vaccin [
6] sont discutées ici.
(→) m/s 2006, n° 1, p.78
 | Figure 1.
Tenues de protection permettant de travailler avec les filovirus. A. Personnel soignant se rendant au pavillon d’isolement lors de l’épidémie à virus Ebola à Mekambo, au Gabon, en 2000 (photo, H. Zeller). L’aspect effrayant de ces tenues contribue à alimenter la méfiance des populations vis-à-vis des équipes qui travaillent au contrôle des épidémies (http://www.who.int). B. Analyse d’échantillons de la faune locale à la recherche du réservoir du virus de Marburg à Durba, République Démocratique du Congo, en 1999 (photo, H. Zeller). Parmi les milliers d’échantillons animaux analysés, seules quelques chauve-souris récemment étudiées ont montré des signes d’infection, ce qui en fait le candidat réservoir le plus probable. C. Chercheurs du Laboratoire des Filovirus, Inserm U758, travaillant en scaphandre pressurisé au laboratoire P4 Inserm Jean Mérieux à Lyon, France, en 2005 (photo, laboratoire P4 : http://www.cervi-lyon.inserm.fr). |
|
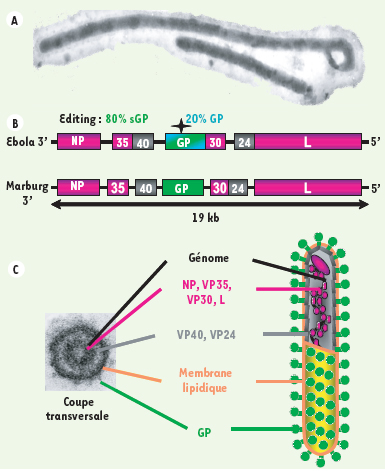
Inhiber l’activité de la glycoprotéine GP pour bloquer le virus Ebola La glycoprotéine (GP) du virus Ebola est la seule protéine transmembranaire exprimée, sous forme de trimères, à la surface des cellules infectées et des virions (Figure 2) ; elle est donc particulièrement exposée au système immunitaire, ce qui en fait une protéine de choix pour le développement de vaccins [6]. La GP est synthétisée sous la forme d’un précurseur clivé par l’endoprotéase furine en deux sous-unités, GP1, extracellulaire, et GP2, transmembranaire, reliées entre elles par des ponts disulfures [
7]. L’expression de la GP du virus Ebola nécessite un phénomène d’édition (RNA editing) lors de la transcription : l’ajout d’un nucléotide non codé par le génome entraîne un décalage du cadre de lecture lors de la traduction (Figure 2) [
8]. Il semble que seule une minorité des ARN messagers (ARNm) (20 %) soient édités et codent pour la GP. Les autres ARNm codent pour une petite glycoprotéine de fonction inconnue, la sGP, qui est sécrétée par les cellules infectées. La principale conséquence du phénomène d’édition est de limiter la quantité de GP produite par les cellules infectées qui produisent le virus ; cette protéine étant connue pour sa forte cytotoxicité, l’édition pourrait ainsi favoriser la production de virus, en réduisant sa toxicité pour les cellules infectées [
9].
 | Figure 2.
Organisation des virions et du génome des filovirus. Les filovirus (Ebola et Marburg) sont des virus enveloppés de l’ordre des Mononegavirales.A. Microscopie électronique d’une particule virale. Les filovirus doivent leur nom à l’aspect filiforme des virions, qui peuvent mesurer plus d’un micromètre de longueur pour 80 nanomètres de diamètre. B. Le génome des filovirus est un ARN simple brin non segmenté, de polarité négative, qui code pour sept protéines structurales. Le virus Ebola produit deux protéines à partir du gène de la GP : la glycoprotéine de surface GP, et la petite glycoprotéine non structurale sécrétée, la sGP. Les protéines de nucléocapside (la nucléoprotéine NP, les protéines virales de 35 kDa et 30 kDa (VP35, VP30) et la polymérase virale L) transcrivent et répliquent l’ARN génomique. La protéine VP40, qui joue un rôle essentiel dans le bourgeonnement viral, et la protéine VP24 sont des protéines de matrice. C. Agencement des protéines dans une particule virale Ebola. Les protéines de nucléocapside entourent l’ARN viral pour former une ribonucléoparticule. Les protéines de matrice sont associées à la membrane. La GP est la seule protéine transmembranaire présente à la surface des virions : elle déclenche la fusion des membranes virale et cellulaire, qui permet l’entrée du virion dans la cellule. Ces différentes protéines sont localisées sur une coupe transversale de virion observée au microscope électronique à transmission. |
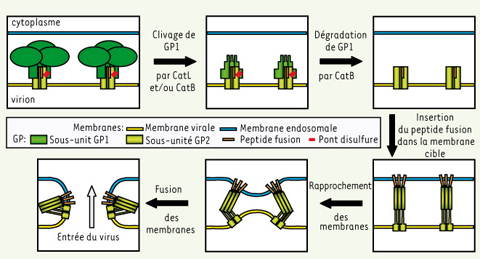
Une autre propriété de la GP en fait une cible privilégiée dans la recherche d’un traitement contre le virus Ebola. Elle est en effet responsable du tropisme cellulaire et de la fusion des membranes virale et cytoplasmique lors de l’entrée du virus dans la cellule : inhiber cette étape devrait permettre de limiter la propagation du virus au sein des organismes infectés. Cependant, les détails du mécanisme de fusion sont longtemps restés inconnus. En raison de similarités de structure et de séquence, la GP a été rattachée à la famille des glycoprotéines virales de fusion de type I, une famille comprenant également les protéines de fusion des orthomyxovirus (virus de la grippe, par exemple) et des rétrovirus (virus de l’immunodéficience humaine, VIH, par exemple) [
10,
11]. Ces protéines possèdent, à l’état inactif, un peptide hydrophobe, le peptide fusion, caché au cœur de leur structure ; ce peptide fusion se retrouve exposé à la faveur d’un changement conformationnel, et peut alors s’insérer dans la membrane cible et déclencher le mécanisme de fusion membranaire [10, 11] : cet événement, postérieur à la liaison au(x) récepteur(s), a lieu lors d’un processus d’activation. Tout comme la glycoprotéine HA du virus de la grippe, l’activité de fusion de la GP du virus Ebola nécessite un pH acide, une propriété caractéristique des protéines réalisant la fusion dans les endosomes [10–
13] ; la diminution du pH est d’ailleurs le déclencheur du changement conformationnel activant la protéine HA. La glycoprotéine du VIH est, quant à elle, activée par sa liaison à un corécepteur [10, 11]. En ce qui concerne la GP du virus Ebola, il n’a pu être démontré que de tels mécanismes soient suffisants pour provoquer son activation. Sans exclure un effet direct du pH sur la conformation de la sous-unité GP2, qui contient le peptide fusion, Chandran et ses collaborateurs viennent de montrer que l’acidité des endosomes est également indispensable au fonctionnement de protéines cellulaires nécessaires à l’activation de la GP. En travaillant sur une souche recombinante (VSV-EboGP) du virus de la stomatite vésiculeuse (VSV), dont la glycoprotéine a été remplacée par celle du virus Ebola, espèce Zaïre [6,
14], ils ont découvert que l’utilisation de quantités croissantes d’inhibiteurs des cathepsines B et L (CatB et L), protéases endosomiques actives uniquement à pH acide, diminuait spécifiquement l’infectiosité des pseudovirus VSV-EboGP [5]. Ils ont ensuite confirmé le rôle de ces protéases dans l’entrée du virus Ebola en montrant que les particules VSV-EboGP sont incapables d’infecter des cellules de souris transgéniques dépourvues de ces deux protéines ; l’infection de ces cellules peut être restaurée partiellement en exprimant CatB, et complètement en exprimant à la fois CatB et L. Les auteurs ont ensuite traité des particules VSV-EboGP avec les protéases CatL et B purifiées : les particules traitées par CatL sont capables d’infecter des cellules dépourvues d’activité CatL, mais nécessitent l’activité de CatB, qui agirait donc en aval. Leurs résultats montrent que la sous-unité GP1 serait clivée par CatL et/ou CatB en un premier fragment, ensuite dégradé par CatB. Le mécanisme d’activation de la GP du virus Ebola par ces clivages protéolytiques serait donc tout à fait original pour une protéine de type I (Figure 3) : même si le mécanisme exact reste encore à préciser, il semble que ces deux protéases coopèrent pour dévoiler le peptide fusion et permettre le déclenchement de l’entrée du virus dans les cellules.
 | Figure 3.
Modèle de fusion membranaire médiée par la glycoprotéine GP du virus Ebola. La GP est produite dans les cellules infectées sous forme d’un précurseur, qui est ensuite clivé par la protéase furine en deux sous-unités, GP1 et GP2 [ 7]. Ces deux sous-unités sont reliées par des ponts disulfures et s’assemblent pour former des trimères. La GP, protéine exprimée à la surface des particules virales Ebola, est responsable de la fusion de la membrane virale avec la membrane cellulaire, qui permet l’entrée du virus dans la cellule. Elle est rattachée à la famille des glycoprotéines de fusion de type I en raison de similarités de séquence et de structure. Ces protéines, après la liaison à leur(s) récepteur(s), subissent un changement conformationnel activateur qui peut être induit par une baisse de pH ou par leur liaison à un corécepteur. Chandran et al. viennent de démontrer que l’activation de la GP serait quant à elle provoquée par des clivages de la sous-unité GP1 opérés par les cathepsines L et B (CatL et B), des protéases endosomales actives uniquement à pH acide. Par analogie avec d’autres glycoprotéines de fusion de type I, le pH acide des endosomes pourrait aussi jouer un rôle direct dans le changement conformationnel de la sous-unité GP2 qui insère le peptide fusion dans la membrane cible. La suite du modèle proposé est dérivé de celui décrit pour les autres glycoprotéines de cette famille (pour revue, voir [ 10, 11]). |
Les stratégies antivirales classiques s’étant révélées inefficaces, différentes approches thérapeutiques novatrices sont à l’étude (pour revue, voir [
15]). La découverte du rôle des cathepsines lors de l’entrée du virus Ebola dans les cellules ouvre une nouvelle perspective : l’utilisation d’inhibiteurs de ces protéases, qui ont déjà été employés in vivo chez la souris à d’autres fins. Chandran et collaborateurs ont d’ailleurs montré que la propagation du virus en culture cellulaire était significativement réduite en présence de tels inhibiteurs [5]. Cependant, ces molécules étant connues pour leur capacité à altérer la réponse immune, on peut se demander si leur action antivirale sera réellement efficace chez des personnes aux défenses immunitaires déjà affaiblies par le virus (→) [
16,
17].
(→) m/s 1999, n° 10, p.1168
|
Vers la mise au point d’un vaccin contre les virus Ebola et Marburg Si les progrès de la recherche ont déjà permis la réalisation de tests diagnostiques de plus en plus précis et rapides [
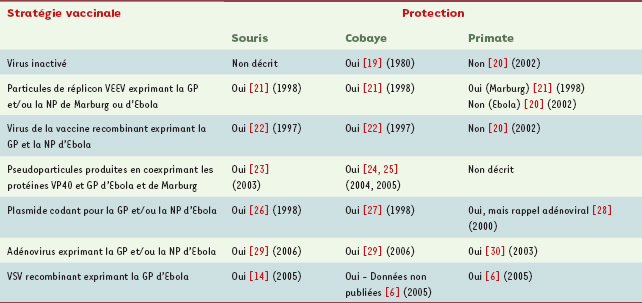
18], un vaccin n’est, en revanche, toujours pas disponible. De nombreuses stratégies vaccinales ont été testées avec succès chez les petits rongeurs depuis les années 80, mais ces résultats prometteurs n’ont, dans la plupart des cas, pas été confirmés chez les singes (Tableau I). Il est donc maintenant admis que les rongeurs, qui développent d’ailleurs des symptômes assez différents des primates, ne constituent pas de bons modèles pour tester l’efficacité de vaccins contre ces virus.
 | Tableau I.
Principaux essais de vaccination contre les filovirus chez l’animal. Ces résultats indiquent clairement que les rongeurs ne sont pas un bon modèle pour anticiper l’efficacité d’un vaccin chez les primates, plus proches de l’homme. Le modèle primate est donc maintenant utilisé en priorité, malgré son coût et les difficultés posées par son utilisation. Un premier vaccin à dose unique efficace chez le primate a été mis au point en 2003 [
30]. Un nouveau vaccin utilisant un vecteur dérivé du virus de la stomatite vésiculeuse (VSV) vient d’être testé avec succès chez le singe [ 6]. Ce dernier résultat est particulièrement intéressant, puisque l’utilisation du VSV chez l’homme comme plate-forme privilégiée pour le développement de vaccins contre les maladies émergentes est fortement envisagée. VEEV : virus de l’encéphalite équine du Vénézuela ; GP : glycoprotéine ; NP : nucléoprotéine. |
Une première approche de vaccin en dose unique à base d’adénovirus recombinant avait déjà permis de vacciner des primates contre le virus Ebola (Tableau I) [
28–30] (→). L’utilité d’un tel vaccin a cependant été remise en question : de nombreuses personnes ont déjà été en contact avec des adénovirus et présentent donc une immunité préexistante contre le vecteur, ce qui limiterait probablement l’efficacité du vaccin [4]. Cela a d’ailleurs été récemment démontré chez la souris [
29]. Ce type de stratégie vaccinale présente cependant l’avantage de stimuler l’apparition d’une réponse immunitaire non seulement humorale (à base d’anticorps qui neutralisent le virus circulant), mais aussi cellulaire (impliquant les cellules T cytotoxiques qui détruisent les cellules infectées). Avec ce type de vecteur, en effet, l’antigène viral est produit par les cellules de l’individu vacciné, et donc présenté au système immunitaire d’une façon stimulant la réponse à médiation cellulaire. L’analyse de la réponse immunitaire de patients lors d’épidémies à virus Ebola avait justement permis de montrer une corrélation entre leur survie et l’apparition précoce d’anticorps et de lymphocytes T cytotoxiques (→)[16, 17].
(→) m/s 2003, n° 19, p.1183
(→) m/s 1999, n° 10, p.1168
Des vecteurs VSV, dont la glycoprotéine a été remplacée par celle du virus Ebola Zaïre ou du virus Marburg, ont récemment été testés avec succès comme vaccins chez les primates [4, 6]. Contrairement aux adénovirus, la prévalence de l’immunité anti-VSV est négligeable chez l’homme. Le vecteur VSV, déjà très utilisé en recherche fondamentale [5], est également employé à des fins vaccinales chez l’animal, et considéré comme un outil prometteur pour le développement de nouveaux vaccins pour l’homme. De nombreux essais vaccinaux utilisant le VSV ont d’ailleurs été réalisés chez l’animal, par exemple contre le VIH et le virus de l’hépatite C [
31] ou encore celui de Lassa [
32]. Les résultats obtenus sont encourageants : le vaccin ne semble pas provoquer d’effets secondaires chez les primates, ni déclencher d’immunité contre les protéines du vecteur après vaccination [6]. Il reste toutefois à valider l’innocuité d’un tel vaccin chez l’homme : l’effort de recherche nécessaire sera important, mais porté par l’espoir de pouvoir vacciner les gens contre de nombreux virus connus, et de développer plus rapidement des vaccins en cas d’émergence de nouveaux virus. Concernant les filovirus, après des résultats préliminaires intéressants obtenus chez les rongeurs [14], Jones et ses collaborateurs ont entrepris la vaccination de six macaques avec une dose de vaccin Ebola Zaïre et de six autres avec une dose de vaccin Marburg [6]. Quatre semaines plus tard, quatre animaux du groupe Ebola ont été infectés par une dose létale de virus Ebola Zaïre et ont survécu, tandis que les deux autres animaux, infectés par une dose létale de virus Marburg, sont rapidement décédés. De la même façon, les quatre animaux vaccinés contre Marburg infectés par ce même virus ont survécu, tandis que les deux infectés par Ebola Zaïre sont morts. Les auteurs ont confirmé que la protection contre le virus Ebola était corrélée au développement précoce d’une forte réponse immunitaire à médiation humorale et cellulaire. En revanche, la protection contre le virus Marburg était essentiellement accompagnée par la production de grandes quantités d’anticorps non neutralisants, un résultat cohérent avec des données obtenues précédemment pour ce virus [
21]. Neuf mois plus tard, les singes vaccinés contre le virus Marburg étaient toujours protégés, même contre une souche très proche de celle dont était issue la GP du vaccin ; ces singes avaient cependant déjà subi une épreuve avec le virus Marburg, ce qui a certainement renforcé leurs défenses immunitaires, à la manière d’un rappel vaccinal. En revanche, le vaccin Ebola espèce Zaïre n’a pas protégé les singes contre une dose létale de virus Ebola espèce Soudan, dont la GP diffère de 50 %, en termes d’acides aminés, de celle utilisée pour le vaccin [6]. Les vaccins VSV semblent prometteurs car ils ont protégé des singes du virus Ebola ou du virus Marburg en une seule injection. Ils sont cependant très spécifiques : l’absence de protection croisée entre les virus Ebola et Marburg ou entre les différentes espèces de virus Ebola ne permettra pas la réalisation de campagnes de vaccination préventive à grande échelle chez l’homme ou les grands singes. En revanche, ces vaccins pourront être utiles pour contrôler ponctuellement les épidémies, s’ils confèrent suffisamment rapidement une protection efficace. |
Une meilleure compréhension des particularités du fonctionnement du virus Ebola, en particulier de sa glycoprotéine, ouvre la voie à un nouveau type d’approche thérapeutique, et des résultats prometteurs en termes de vaccin viennent d’être obtenus. Cependant, il est certain que ces résultats ne seront pas applicables à l’homme avant plusieurs années. En attendant, il faudra continuer à renforcer les réseaux d’alerte et de prévention en Afrique. En plus de leur mission strictement médicale lors des épidémies, les équipes d’intervention devront continuer à prendre autant que possible en compte les appréhensions des populations locales. C’est grâce à des mesures mieux adaptées que les dernières épidémies à virus Ebola au Congo et au Soudan ont fait relativement peu de victimes (http://www.who.int). |
Nous tenons à remercier Hervé Zeller, directeur du Centre National de Référence des Fièvres Hémorragiques Virales de l’Institut Pasteur, ainsi qu’Alain-Jean Georges, directeur du laboratoire P4 Inserm Jean Mérieux et l’équipe biosécurité, notamment pour leur contribution à l’illustration de ce travail.
|
Footnotes |
1. Feldmann H, Wahl-Jensen V, Jones SM, Stroher U. Ebola virus ecology : a continuing mystery. Trends Microbiol 2004; 12 : 433–7. 2. Leroy EM, Rouquet P, Formenty P, et al. Multiple Ebola virus transmission events and rapid decline of central African wildlife. Science 2004; 303 : 387–90. 3. Rouquet P, Froment JM, Bermejo M, et al. Wild animal mortality monitoring and human Ebola outbreaks, Gabon and Republic of Congo, 2001-2003. Emerg Infect Dis 2005; 11 : 283–90. 4. Baize S. A single shot against Ebola and Marburg virus. Nat Med 2005; 11 : 720–1. 5. Chandran K, Sullivan NJ, Felbor U, et al. Endosomal proteolysis of the Ebola virus glycoprotein is necessary for infection. Science 2005; 308 : 1643–5. 6. Jones SM, Feldmann H, Stroher U, et al. Live attenuated recombinant vaccine protects nonhuman primates against Ebola and Marburg viruses. Nat Med 2005; 11 : 786–90. 7. Volchkov VE, Feldmann H, Volchkova VA, Klenk HD. Processing of the Ebola virus glycoprotein by the proprotein convertase furin. Proc Natl Acad Sci USA 1998; 95 : 5762–7. 8. Volchkov VE, Becker S, Volchkova VA, et al. GP mRNA of Ebola virus is edited by the Ebola virus polymerase and by T7 and vaccinia virus polymerases. Virology 1995; 214 : 421–30. 9. Volchkov VE, Volchkova VA, Muhlberger E, et al. Recovery of infectious Ebola virus from complementary DNA : RNA editing of the GP gene and viral cytotoxicity. Science 2001; 291 : 1965–9. 10. Dutch RE, Jardetzky TS, Lamb RA. Virus membrane fusion proteins : biological machines that undergo a metamorphosis. Biosci Rep 2000; 20 : 597–612. 11. Weissenhorn W, Dessen A, LJ Calder, et al. Structural basis for membrane fusion by enveloped viruses. Mol Membr Biol 1999; 16 : 3–9. 12. Takada A, Robison C, Goto H, et al. A system for functional analysis of Ebola virus glycoprotein. Proc Natl Acad Sci USA 1997; 94 : 14764–9. 13. Wool-Lewis RJ, Bates P. Characterization of Ebola virus entry by using pseudotyped viruses : identification of receptor-deficient cell lines. J Virol 1998; 72 : 3155–60. 14. Garbutt M, Liebscher R, Wahl-Jensen V, et al. Properties of replication-competent vesicular stomatitis virus vectors expressing glycoproteins of filoviruses and arenaviruses. J Virol 2004, 78 : 5458–65. 15. Feldmann H, Jones SM, Schnittler HJ, Geisbert T. Therapy and prophylaxis of Ebola virus infections. Curr Opin Investig Drugs 2005; 6 : 823–30. 16. Baize S, Leroy EM, Georges-Courbot MC, et al. Defective humoral responses and extensive intravascular apoptosis are associated with fatal outcome in Ebola virus-infected patients. Nat Med 1999; 5 : 423–6. 17. Baize S, Leroy EM, Georges AJ, et al. Inflammatory responses in Ebola virus-infected patients. Clin Exp Immunol 2002; 128 : 163–8. 18. Grolla A, Lucht A, Dick D, et al. Laboratory diagnosis of Ebola and Marburg hemorrhagic fever. Bull Soc Pathol Exot 2005; 98 : 205–9. 19. Lupton HW, Lambert RD, Bumgardner DL, et al. Inactivated vaccine for Ebola virus efficacious in guinea pig model. Lancet 1980; 2 : 1294–5. 20. Geisbert TW, Pushko P, Anderson K, et al. Evaluation in nonhuman primates of vaccines against Ebola virus. Emerg Infect Dis 2002; 8 : 503–7. 21. Hevey M, Negley D, Pushko P, et al. Marburg virus vaccines based upon alphavirus replicons protect guinea pigs and nonhuman primates. Virology 1998; 251 : 28–37. 22. Gilligan JK, Geisbert JB, Jahrling PB, Anderson K. Assessment of protective immunity conferred by recombinant VACV to guinea pigs challenged with Ebola virus. In : Brown F, Burton D, Doherty P, et al., edS. Vaccines. Cold Spring Harbor (NY) : Cold Spring Harbor Laboratory Press, 1997 : 87–92. 23. Warfield KL, Bosio CM, Welcher BC, et al. Ebola virus-like particles protect from lethal Ebola virus infection. Proc Natl Acad Sci USA 2003; 100 : 15889–94. 24. Warfield KL, Swenson DL, Negley DL, et al. Marburg virus-like particles protect guinea pigs from lethal Marburg virus infection. Vaccine 2004; 22 : 3495–502. 25. Swenson DL, Warfield KL, Negley DL, et al. Virus-like particles exhibit potential as a pan-filovirus vaccine for both Ebola and Marburg viral infections. Vaccine 2005; 23 : 3033–42. 26. Vanderzanden L, Bray M, Fuller D, et al. DNA vaccines expressing either the GP or NP genes of Ebola virus protect mice from lethal challenge. Virology 1998; 246 : 134–44. 27. Xu L, Sanchez A, Yang Z, et al. Immunization for Ebola virus infection. Nat Med 1998; 4 : 37–42. 28. Sullivan NJ, Sanchez A, Rollin PE, et al. Development of a preventive vaccine for Ebola virus infection in primates. Nature 2000, 408 : 605–9. 29. Kobinger GP, Feldmann H, Zhi Y, et al. Chimpanzee adenovirus vaccine protects against Zaire Ebola virus. Virology 2006; 346 : 394–401. 30. Sullivan NJ, Geisbert TW, Geisbert JB, et al. Accelerated vaccination for Ebola virus haemorrhagic fever in non-human primates. Nature 2003; 424 : 681–4. 31. McKenna PM, McGettigan JP, Pomerantz RJ, et al. Recombinant rhabdoviruses as potential vaccines for HIV-1 and other diseases. Curr HIV Res 2003; 1 : 229–37. 32. Geisbert TW, Jones S, Fritz EA, et al. Development of a new vaccine for the prevention of Lassa fever. PLoS Med 2005; 2 : e183. |