| |
| Med Sci (Paris). 2006 April; 22(4): 389–395. Published online 2006 April 15. doi: 10.1051/medsci/2006224389.Gliomes de bas grade et plasticité cérébrale Implications fondamentales et cliniques François Bonnetblanc,1 Michel Desmurget,1 and Hugues Duffau2* 1Inserm U371, Vision et Cerveau, 18, avenue du Doyen Lépine, 69500 Bron, France 2Département de neurochirurgie, Hôpital Pitié-Salpêtrière, 47-83, boulevard de l’hôpital, 75651 Paris, Cedex 13, France |
En 1861, P. Broca présenta devant la société d’anthropologie de Paris un patient porteur d’une « perte de la parole » intervenant après une lésion de la partie rostrale de la circonvolution frontale inférieure gauche (appelée depuis aire de Broca). Quelques années plus tard, en 1874, C. Wernicke décrivit un autre sujet affichant des troubles de la compréhension dus à une atteinte de la partie postérieure de la circonvolution temporale gauche (aire de Wernicke). Ces deux communications marquèrent durablement les esprits en suggérant que le cerveau était subdivisé en aires fonctionnelles « éloquentes », hautement spécialisées, et qu’une lésion de ces aires provoquait des déficits majeurs et définitifs [
1]. Ces idées restent centrales dans la neurophysiologie moderne. Pourtant, depuis quelques années, différentes données issues de la chirurgie des gliomes infiltrants de bas grades (GIBG) sont venues bousculer ce dogme des « aires éloquentes ». Il a notamment été montré que des excisions cérébrales massives pouvaient ne s’accompagner d’aucune séquelle fonctionnelle [
2] : ainsi, un exemple particulièrement frappant concerne la préservation des fonctions langagières chez des patients ayant subi une ablation totale de l’aire de Broca [
3]. Ce type de résultats a d’évidentes implications fondamentales et cliniques. Par ailleurs, il ouvre de larges perspectives pour la compréhension des phénomènes de plasticité cérébrale et la neurologie. |
Plasticité cérébrale : un dynamisme sous-estimé Les patients souffrant d’une aphasie de type Broca et Wernicke sont typiques de la clinique des accidents vasculaires cérébraux (AVC). En effet, ils présentent le plus souvent des lésions relativement focales et des troubles fonctionnels persistant à long terme [
4]. Ce tableau correspond assez bien à l’idée largement répandue selon laquelle le cerveau posséderait une capacité de réorganisation limitée. Un modèle d’autant plus séduisant qu’il « cadre » parfaitement avec les données de la neurophysiologie moderne. Des travaux de plus en plus précis tendent en effet à mettre en lumière la haute spécialisation fonctionnelle de nombreuses aires cérébrales [
5–
7]. En accord avec ce modèle de spécialisation, un grand nombre d’observations cliniques, impliquant notamment la neuro-imagerie, ont montré l’existence d’une plasticité principalement périlésionnelle après un AVC [1]. L’idée d’une spécialisation anatomofonctionnelle élective s’accorde toutefois assez mal avec les images IRM rapportées dans les Figures 1 et 4, qui montrent le cerveau de patients ayant subi d’importantes résections cérébrales. Tous ces patients ont pourtant une vie socioprofessionnelle normale, et aucun d’eux ne montre de déficit fonctionnel identifiable sur la base de tests cliniques classiques [2,
8] : cela amène à nuancer ce que nous enseigne la clinique des AVC, en indiquant que de très larges lésions peuvent n’avoir que peu d’incidences fonctionnelles.
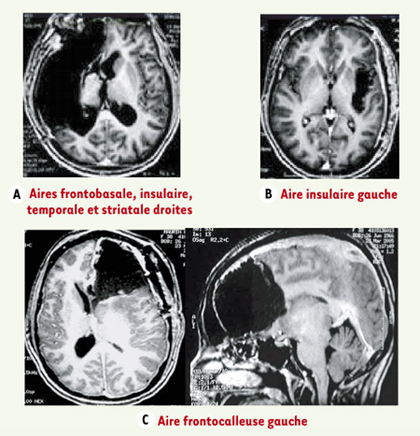
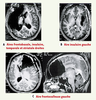 | Figure 1.
Exemples de résection de GIBG dans différents sites, sans induction de déficits fonctionnels détectables. A, B, C.Images IRM de différents patients, après chirurgie d’un GIBG infiltrant des aires éloquentes du cerveau. Aucun de ces patients ne présente de déficit fonctionnel détectable, tous ont repris une vie socioprofessionnelle normale malgré une résection massive de certaines aires cérébrales. |
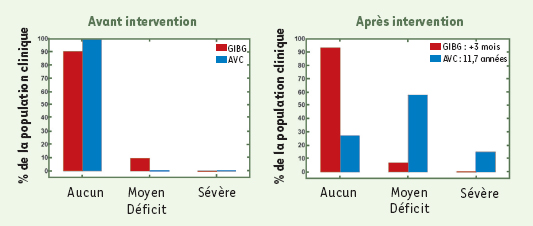
 | Figure 2.
Conséquences cliniques des gliomes infiltrants de bas grades (GIBG, en rouge) et des AVC (en bleu). Représentation du pourcentage de la population considérée en fonction du degré de sévérité des déficits mesurés avant (à gauche) et après (à droite) intervention (3 mois après résection chirurgicale pour les GIBG, 11,7 ± 7,9 années après traitement pour les AVC). Les données sur les GIBG et les AVC sont extraites, respectivement, de [ 2] (103 patients, âge moyen 36 ans [
17-63]) et [ 4] (272 patients, âge moyen 37 ans [
15-45]). |
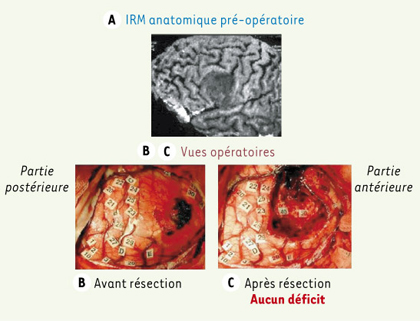
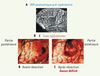 | Figure 3.
Résection complète d’un GIBG localisé dans l’aire de Broca, du côté dominant (gauche). Le patient ne présente aucun déficit neurologique pré- ou postopératoire. A. IRM anatomique pré-opératoire montrant un GIBG infiltrant l’aire de Broca ( pars opercularis et pars triangularis). B. Vue intra-opératoire avant résection de la tumeur. C. Vue après résection de la tumeur. La cartographie électrique ( voir partie ci-dessous) montre une redistribution des aires éloquentes, avec un recrutement des sites périlésionnels intervenant dans la compensation (marqués par des étiquettes numérotées). 23, 24, 25 : cortex prémoteur ventral ; 29 : cortex préfrontal dorsolatéral ; 30, 31 : partie orbitale du gyrus frontal inférieur. En profondeur, la résection a été continuée jusqu’au contact des voies associatives du langage, en particulier la partie antérieure du fasciculus fronto-occipital inférieur (déclenchant une paraphasie sémantique durant la stimulation électrique) et la partie antérieure du fasciculus arcuatus (induisant des perturbations phonologiques). Ces voies sont numérotées 50 et 40, respectivement (adaptée de [ 3]). |
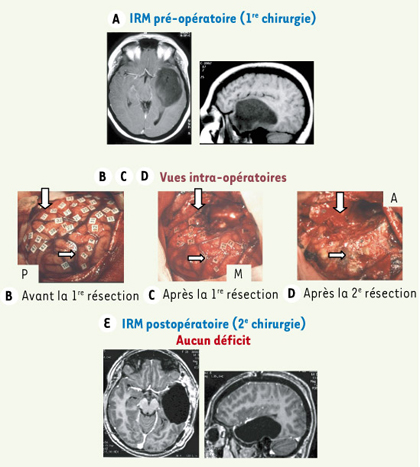
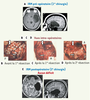 | Figure 4.
Résection en deux étapes d’un GIBG infiltrant le lobe temporal gauche. Le patient ne présente aucun déficit neurologique pré- ou postopératoire. A. Images IRM montrant un GIBG localisé dans l’hémisphère dominant et envahissant le lobe temporal gauche. B. Vue intra-opératoire avant résection. La cartographie fonctionnelle sous anesthésie locale autorise la détection des sites suivants : 1, 2, 3 et 4, aires motrices ; 10, aire somatosensorielle ; 11, 12 et 21, aires du langage, avec arrêt de la parole pendant les stimulations ; 37 et 38, aires du langage avec anomie induite par stimulations. Les frontières de la tumeur ont été identifiées par échographie. C. Vue intra-opératoire après la première résection. Les mêmes sites moteurs et langagiers ont été retrouvés en utilisant les mêmes paramètres électriques. Pour des raisons techniques, la marque 27 a été utilisée au lieu de la 37 et la marque 32 au lieu de la 27, mais elles indiquent les mêmes aires du langage impliquées dans la dénomination (comme confirmé par les stimulations répétées). En raison d’une infiltration par le gliome des deux sites langagiers temporaux moyens de la dénomination 32 et 27, la résection de la tumeur a été stoppée postérieurement et une résection incomplète a été réalisée. D. Vue intra-opératoire après la seconde résection, décidée 18 mois plus tard en raison de la récurrence de la tumeur. Aucun site du langage n’a été détecté dans le lobe temporal avec la stimulation électrique. Une résection totale du gliome a donc été réalisée. À la fin de la résection temporale, une cartographie fonctionnelle a été à nouveau réalisée : des stimulations du cortex insulaire gauche induisent un arrêt de la parole. E. Images IRM postopératoires après la seconde résection, illustrant une résection totale du gliome. Le patient ne présente pas de déficit. Petites flèches : sillon central ; grosses flèches : limites fonctionnelle de la première résection ; A : antérieur ; M : moyen ; P : postérieur (adaptée de [
14]). |
Les images IRM présentées sur la Figure 1 sont toutes relatives à des patients opérés de GIBG OMS grade II. Ces gliomes sont des tumeurs à développement lent, dont l’évolution se fait généralement en trois phases principales : croissance locale et continue du diamètre moyen de la tumeur (environ 4 mm par an), invasion progressive des voies principales de la substance blanche, au sein de l’hémisphère lésé ou controlatéral via le corps calleux ou les commissures et, enfin, transformation anaplasique. Concernant ce dernier point, il est désormais établi que les GIBG changent systématiquement de nature biologique et évoluent vers des gliomes de haut grade, avec une médiane de transformation de 7-8 ans et une médiane de survie estimée à 10 ans [
9]. Cette inévitable transformation, associée à l’optimisation des techniques opératoires, constituent les raisons principales du choix chirurgical. Alors que l’excision préventive des tumeurs de bas grade a longtemps semblé discutable, cette option semble désormais mieux acceptée. L’idée est d’enlever le tissu tumoral pour tenter de circonscrire son développement et retarder sa dégénérescence [
10]. Le succès de cette stratégie dépend largement, bien sûr, du volume de tumeur effectivement excisé : ainsi, dans une étude récente, aucune transformation anaplasique n’a été observée, sur une médiane de 5-6 ans, lorsque l’IRM postopératoire montrait que 100 % du GIBG avaient pu être réséqués [8]. Certains éléments suggèrent donc que la clinique des AVC pourrait aboutir à une sous-estimation des phénomènes de plasticité cérébrale, ce qui peut s’expliquer par les différences majeures existant entres les atteintes ictale et tumorale. En effet, les AVC se produisent de manière soudaine et brutale, impliquent souvent les voies d’associations profondes et touchent des sujets généralement âgés. À l’inverse, les GIBG évoluent lentement, laissant au système nerveux un temps important pour se réorganiser, sont réséqués dans le respect des grands faisceaux de substance blanche (cela est d’autant plus vrai que l’acte opératoire est, comme nous le verrons plus loin, guidé par la stimulation électrique peropératoire [8]) et concernent le plus souvent des individus relativement jeunes (36-37 ans [9]). L’existence de profondes différences entre la plasticité cérébrale consécutive à un AVC et celle induite par des GIBG est d’ailleurs nettement perceptible d’un point de vue quantitatif. La Figure 2 synthétise, à ce sujet, les résultats de deux méta-analyses récentes, impliquant deux populations comparables, et portant sur les effets à long terme des AVC et GIBG. Des bilans neurologiques classiques montrent clairement que les patients porteurs de tumeurs lentement infiltrantes ne présentent, dans 93 % des cas, aucun déficit fonctionnel décelable 3 mois après la chirurgie. Quatre-vingt treize pour cent des patients impliqués dans cette étude longitudinale ont pu reprendre leur vie socioprofessionnelle après la chirurgie. À l’inverse, 72 % des malades ayant souffert d’un AVC précoce continuent de présenter des troubles modérés ou sévères 11 ans après leur attaque, et près de 50 % des patients n’ont pu reprendre leur travail après leur AVC. La différence entre bilans cliniques est encore plus saisissante lorsque sont considérées les zones corticales dites « éloquentes ». Ainsi, si l’on prend l’exemple de l’aire gauche de Broca, on observe de très nettes différences selon que l’atteinte anatomique résulte d’un AVC soudain ou d’un GIBG progressif. Dans le cas d’un AVC, la récupération post-lésionnelle est usuellement limitée, et la sévérité du déficit initial est classiquement le facteur le mieux corrélé avec les éventuelles conséquences cliniques à long terme [1]. À l’inverse, chez les patients présentant des GIBG, de sévères aphasies postopératoires immédiates sont en général observées (n = 7) [
12,
13]. Celles-ci régressent toutefois très rapidement, pour finalement disparaître, dans la totalité des cas, en quelques semaines. Contrairement à une opinion largement répandue, il est même possible de réséquer complètement l’aire de Broca sans induire le moindre déficit langagier [3] (Figure 3). En outre, si des troubles aphasiques importants et définitifs ont été rapportés chez 25 patients ayant subi un AVC dans l’insula gauche, suggérant un rôle essentiel de cette aire pour les fonctions langagières [
11], il a été montré que lors d’une infiltration de l’insula gauche par des GIBG, cette aire pouvait être complètement réséquée sans induire de déficit langagier permanent (n = 7) [12, 13]. |
Mécanismes de la plasticité cérébrale Observations pré-opératoires Les patients atteints de GIBG présentent souvent un bilan neurologique pré-opératoire normal, ou quasi normal [ 2, 14–
16]. Cela peut s’expliquer si l’on admet que la lente infiltration tumorale induit une réorganisation fonctionnelle progressive. En accord avec cette idée, quatre grands patrons de redistribution ont été rapportés dans la littérature (Tableau I).
 | Tableau I.
Patrons de redistribution permettant une réorganisation fonctionnelle en cas de GIBG. Ces différents patrons de compensation coexistent généralement à des degrés divers : une combinaison d’activations péritumorales et controhémisphériques a, notamment, été rapportée pour des fonctions sensorimotrices [
24] et langagières [ 17,
19,
25]. |
Observations peropératoires Rôle de la stimulation électrique directe pour la traçabilité fonctionnelle L’évaluation des patrons de réorganisation pré-opératoires repose principalement sur des techniques récentes d’imagerie neurofonctionnelle. Malgré leur intérêt et leur indiscutable efficience, ces techniques restent toutefois encore trop imparfaites pour conduire l’acte chirurgical, c’est-à-dire pour circonscrire précisément les zones cérébrales à réséquer. Pour toute ablation d’un GIBG localisé dans les aires éloquentes, l’utilisation additionnelle de la stimulation électrique directe (SED) intra-opératoire est largement conseillée, sous anesthésie locale ou générale [ 8,
26]. En produisant des perturbations transitoires, cette technique permet la détection, en temps réel, des aires corticales et sous-corticales « essentielles à la fonction », pour la réalisation de tâches cognitives ou motrices relativement complexes. La SED permet également une étude anatomofonctionnelle des tractus de la substance blanche au cours de la résection [ 15,
27]. Le principe opératoire est alors le suivant : toute perturbation fonctionnelle induite de façon reproductive par SED doit stopper le processus chirurgical. La résection de la tumeur est, dans ce contexte, réalisée « par rapport aux limites de la fonction » : ce principe a permis d’effectuer d’importantes résections dans les aires du langage, et notamment dans l’aire de Broca, sans atteinte fonctionnelle consécutive détectable [ 12– 13] (Figure 3). Il a également permis d’identifier le réseau neuronal impliqué dans la production langagière [ 3] et les fonctions sémantiques [
28]. Réorganisation fonctionnelle induite par l’acte chirurgical lui-même Pendant la résection, la cartographie par SED montre une réorganisation à court terme, probablement due à un démasquage des connections intracorticales latentes via une hyperexcitabilité induite par l’acte chirurgical lui-même [
29–
31]. Ce démasquage de redondances fonctionnelles a été observé à l’intérieur du gyrus précentral (représentation motrices multiples) [
30] et du gyrus rétrocentral (représentation sensorielles multiples) [
32], mais aussi de part et d’autre du sillon central (redondances motrices et sensorielles multiples) [ 29]. Ces observations supportent l’hypothèse d’une organisation dynamique fonctionnelle en mosaïque de l’ensemble du cortex sensorimoteur, avec des connexions fortes entre les aires motrices et sensorielles [
33]. Observations postopératoires : plasticité à long terme Durant la dernière décennie, de nombreux travaux ont montré que la ré-organisation cérébrale fonctionnelle pouvait se poursuivre au-delà de la chirurgie. Ainsi, Krainik et ses collaborateurs [
21] ont observé une réorganisation postopératoire dans l’aire motrice supplémentaire et le cortex prémoteur controlésionnels, après une invasion ipsilatérale par un GIBG. Cette réorganisation dans l’hémisphère sain persistait à long terme et avait une valeur fonctionnelle réelle, corrélée à l’indice de récupération. Par delà les éléments précédents, l’exemple le plus frappant de plasticité postopératoire est fourni par les situations de chirurgies itératives : ce type de situation se produit lorsque la tumeur présente en son sein des sites fonctionnels qui empêchent sa résection totale lors du premier acte chirurgical. Il arrive alors qu’une seconde chirurgie soit planifiée en cas de nouvelle évolution tumorale, ce qui se produit généralement au bout de une à plusieurs années. Il a alors pu être observé, grâce à la SED, que les zones fonctionnelles infiltrées par le gliome et non réséquées initialement s’étaient réorganisées par rapport à la première chirurgie. Cette réorganisation s’était opérée en recrutant les aires périlésionnelles, ce qui a permis de retirer le résidu tumoral n’ayant pu être enlevé lors de la première intervention [14]. La Figure 4 illustre ce résultat pour une résection complète de « l’aire temporale gauche du langage » (résection compensée par le lobe insulaire). La résection s’est effectuée en deux étapes espacées de 18 mois. Aucun déficit fonctionnel ne fut enregistré, alors que, dans le cas d’un AVC impliquant cette région, le patient présente classiquement une aphasie complète [1]. |
Les éléments évoqués ci-dessus ont bien sûr des implications cliniques importantes. Bien que cette question ne constitue pas le point central du présent manuscrit (voir [31] pour une discussion), il semble important de souligner deux points. D’une part, la connaissance de la réorganisation fonctionnelle pré-opératoire est essentielle dans l’optique d’une planification chirurgicale : en effet, plus les aires éloquentes infiltrées sont redistribuées à distance, plus les chances de réaliser une résection totale augmentent, et plus le risque de déficits neurologiques postopératoires permanents diminue [2, 8]. D’autre part, lorsque plusieurs chirurgies consécutives sont réalisées, la plasticité induite par la première résection peut amener une redistribution à long terme des cartes fonctionnelles. Cette redistribution a une valeur clinique réelle, puisqu’elle peut permettre de pratiquer une résection de la tumeur résiduelle sans induire de séquelle. Ainsi, il serait possible d’envisager une planification dynamique de la chirurgie, impliquant plusieurs résections successives [14]. |
Il est possible d’optimiser la résection de GIBG localisés dans les régions éloquentes sans induire de déficits neurologiques chez les patients. L’usage de la SED est essentiel pour cartographier en temps réel les fonctions et leur réorganisation. Les résultats présentés au sein de cet article indiquent clairement que le cortex cérébral possède un potentiel plastique majeur, longtemps sous-estimé dans les études portant sur les AVC. Une telle capacité de compensation fonctionnelle peut être utilisée pour étendre les indications de chirurgie dans des structures critiques et pour augmenter la qualité de la résection en minimisant le risque de séquelles. À ce titre, il nous semble que le modèle physiopathologique des GIBG permet d’ouvrir une voie nouvelle dans la compréhension de la plasticité cérébrale et du fonctionnement du cerveau. |
Ce travail a été soutenu par un financement post-doctoral émanant de l’Association pour la Recherche sur le Cancer (ARC-France) alloué à FB sur les années 2005-2007.
|
Footnotes |
1. Rijntjes M, Weiller C. Recovery of motor and language abilities after stroke : the contribution of functional imaging. Prog Neurobiol 2002; 66 : 109–22. 2. Duffau H, Capelle L, Denvil D, et al. Usefulness of intraoperative electrical sub-cortical mapping in surgery of low-grade gliomas located within eloquent regions : functional results in a consecutive series of 103 patients. J Neurosurg 2003; 98 : 764–78. 3. Duffau H, Capelle L, Sichez N, et al. Intraoperative mapping of the subcortical language pathways using direct stimulations. An anatomo-functional study. Brain 2002; 125 : 199–214. 4. Varona JF, Bermejo F, Guerra JM, Molina JA. Long term prognosis of ischemic stroke in young adults. J Neurol 2004; 251 : 1507–14. 5. Desmurget M, Pelisson D, Urquizar C, et al. Functional anatomy of saccadic adaptation in humans. Nat Neurosci 1998; 1 : 524–8. 6. Clower DM, Hoffman JM, Votaw JR, et al. Role of posterior parietal cortex in the recalibration of visually guided reaching. Nature 1996; 383 : 618–21. 7. Desmurget M, Grea H, Grethe JS, et al. Functional anatomy of nonvisual feedback loops during reaching : a positron emission tomography study. J Neurosci 2001; 21 : 2919–28. 8. Duffau H, Lopes M, Arthuis F, et al. Contribution of intraoperative electrical stimulations in surgery of low-grade gliomas : a comparative study between two series without (1985-1996) and with (1996-2003) functional mapping in the same institution. J Neurol Neurosurg Psychiatry 2005; 76 : 845–51. 9. Walker DG, Kaye AH. Low grade glial neoplasms. J Clin Neurosci 2003; 10 : 1–13. 10. Keles GE, Lamborn KR, Berger MS. Low-grade hemispheric gliomas in adults : a critical review of extent of resection as a factor influencing outcome. J Neurosurg 2001; 95 : 735–45. 11. Dronckers NF. A new brain region for coordinating speech articulation. Nature 1996; 384 : 159–61. 12. Duffau H, Capelle L, Lopes M, et al. The insular lobe : physiopathological and surgical considerations. Neurosurgery 2000; 47 : 801–11. 13. Duffau H, Bauchet L, Lehéricy S, Capelle L. Functional compensation of the left insula dominant for language. NeuroReport 2001; 12 : 2159–63. 14. Duffau H, Denvil D, Capelle L. Long term reshaping of language, sensory and motor maps following glioma resection : a new parameter to integrate in the surgical strategy. J Neurol Neurosurg Psychiatry 2002; 72 : 511–6. 15. Duffau H, Capelle L, Denvil D, et al. Functional recovery after surgical resection of low grade gliomas in eloquent brain : hypothesis of brain compensation. J Neurol Neurosurg Psychiatry 2003; 74 : 901–7. 16. Duffau H, Capelle L. Preferential brain locations of low-grade gliomas : comparison with glioblastomas and review of hypothesis. Cancer 2004; 100 : 2622–6. 17. Meyer PT, Stuz L, Schreckenberger M, et al. Preoperative mapping of cortical language areas in adult brain tumour patients using PET and individual non-normalised SPM analyses. Eur J Nucl Med Mol Imaging 2003; 30 : 951–60. 18. Atlas SW, Howard RS, Maldjian J, et al. Functional magnetic resonance imaging of regional brain activity in patients with intracerebral gliomas : findings and implications for clinical management. Neurosurgery 1996; 38 : 329–38. 19. Thiel A, Herholz K, von Stockhausen HM, et al. Localization of language-related cortex with 15O-labeled water PET in patients with gliomas. NeuroImage 1998; 7 : 284–95. 20. Thiel A, Herholz K, Koyuncu A, et al. Plasticity of language networks in patients with brain tumors : a positron emission tomography activation study. Ann Neurol 2001; 50 : 620–9. 21. Krainik A, Duffau H, Capelle L, et al. Role of the healthy hemisphere in recovery after resection of the supplementary motor area. Neurology 2004; 62 : 1323–32. 22. Holodny AI, Schulder M, Ybasco A, Liu WC. Translocation of Broca’s area to the contralateral hemisphere as the result of the growth of a left inferior frontal glioma. J Comput Assist Tomogr 2002; 26 : 941–3. 23. Petrovich NM, Holodny AI, Brennan CW, et al. Isolated translocation of Wernicke’s area to the right hemisphere in a 62-year-man with a temporo-parietal glioma. Am J Neuroradiol 2004; 25 : 130–3. 24. Fandino J, Kollias SS, Wieser HG, et al. Intraoperative validation of functional magnetic resonance imaging and cortical reorganization patterns in patients with brain tumors involving the primary motor cortex. J Neurosurg 1999; 91 : 238–50. 25. Heiss WD, Thiel A, Kessler J, Herholz K. Disturbance and recovery of language function : correlates in PET activation studies. NeuroImage 2003; 20 : 42–9. 26. Berger MS, Rostomily RC. Low-grade gliomas : Functional mapping resection strategies, extent of resection, and outcome. J Neuro Oncol 1997; 34 : 85–101. 27. Keles GE, Lundin DA, Lamborn KR, et al. Intraoperative subcortical stimulation mapping for hemispherical perirolandic gliomas located within or adjacent to the descending motor pathways : evaluation of morbidity and assessment of functional outcome in 294 patients. J Neurosurg 2004; 100 : 369–75. 28. Duffau H, Gatignol P, Mandonnet E, et al. New insights into the anatomo-functional connectivity of the semantic system : a study using cortico-subcortical electrostimulations. Brain 2005; 128 : 797–810. 29. Duffau H, Sichez JP, Lehéricy S. Intraoperative unmasking of brain redundant motor sites during resection of a precentral angioma. Evidence using direct cortical stimulations. Ann Neurol 2000; 47 : 132–5. 30. Duffau H. Acute functional reorganisation of the human motor cortex during resection of central lesions : a study using intraoperative brain mapping. J Neurol Neurosurg Psychiatry 2001; 70 : 506–13. 31. Duffau H. Lessons from brain mapping in low-grade glioma surgery : insights into relationships between tumour and brain plasticity. Lancet Neurol 2005; 4 : 476–86. 32. Duffau H, Capelle L. Functional recovery after resection of gliomas infiltrating primary somatosensory fields. Study of intraoperative electrical stimulation. Neurochirurgie 2001; 47 : 534–41. 33. Nii Y, Uematsu S, Lesser RP, Gordon B. Does the central sulcus divide motor and sensory functions ? Cortical mapping of human hand areas as revealed by electrical stimulation through subdural grid electrodes. Neurology 1996; 46 : 360–7. |