| |
| Med Sci (Paris). 2006 April; 22(4): 359–361. Published online 2006 April 15. doi: 10.1051/medsci/2006224359.Activité neuronale avant synaptogenèse : canaux Na+, signal Ca2+ et sécrétion glutamatergique Ou « Comment jouer la pièce quand des acteurs célèbres manquent à la scène ? » Mireille Albrieux,* Jean-Claude Platel, Alain Dupuis, Jacques Brocard, Marc Savasta, and Michel Villaz Laboratoire Dynamique des Réseaux Neuronaux, Inserm U704, Université Joseph Fourier, 2280, rue de la Piscine, 38041 Grenoble, France MeSH keywords: Animaux, Canaux calciques, Signalisation du calcium, Communication cellulaire, Cortex cérébral, Acide glutamique, Transport des ions, Souris, Modèles neurologiques, Protéines tissu nerveux, Neurones, Récepteurs au AMPA, Récepteurs au N-méthyl-D-aspartate, Transduction du signal, Agonistes de canaux sodiques, Canaux sodiques, Échangeur sodium-calcium, Synapses, Vératridine |
La neurogenèse est un processus développemental complexe aboutissant à la formation du système nerveux en impliquant prolifération, migration et différenciation cellulaire. Sa coordination et sa reproductibilité sont dépendantes de certains acteurs clés, notamment les canaux ioniques membranaires qui se mettent en place progressivement au cours du développement et ce, bien avant la formation des synapses. L’excitabilité neuronale qui en découle joue un rôle crucial dans la transmission de l’information et le développement du système nerveux. Les neurotransmetteurs - tels que le glutamate et le GABA, mais également la taurine et la glycine [
1] - sont présents très tôt au cours du développement et régulent la prolifération des progéniteurs neuronaux [
2,
3] ainsi que la migration neuronale [
4]. Chez l’adulte, l’activité neuronale est sous-tendue par l’émission de potentiels d’action suivis de la libération de neurotransmetteurs au niveau de la synapse, déclenchant l’émission de potentiels post-synaptiques. Le terme « activité » regroupe l’activité électrique (changements de potentiel membranaire dus à l’ouverture de canaux ioniques membranaires) et l’activité calcique (variations de concentration du Ca2+ libre intracellulaire). Cette activité est dite spontanée lorsqu’elle n’est pas induite par un stimulus sensoriel ou moteur, mais qu’elle intervient de façon autonome [
5]. Chez la souris, les premières étapes de la neurogenèse du cortex cérébral ont lieu entre le onzième et le treizième jour embryonnaire (E11-E13) et donnent naissance à un groupe de neurones pionniers qui forme la préplaque (PP), au-dessus de la zone ventriculaire (VZ) proliférante. Alors que les cellules ne possèdent pas encore de connexions synaptiques, nous avons observé une activité calcique spontanée dès E13. À ce stade, les canaux Ca2+ activés par dépolarisation ne sont pas encore présents [
6] et seuls les canaux Na+, exprimés uniquement sur une fraction des neurones de la PP [
7], peuvent engendrer une activité électrique. Étant donné le rôle essentiel joué par les neurones pionniers dans la corticogenèse, nous avons étudié l’implication des canaux Na+ dans l’activité calcique spontanée. Ce travail nous a permis de démontrer l’existence d’une voie originale de communication entre neurones de la préplaque, rendant possible une communication intercellulaire bien avant la formation des synapses [
8]. |
Du canal activé au glutamate libéré La stimulation des canaux Na+, par application de l’agoniste spécifique vératridine, entraîne une augmentation du Ca2+ cytosolique de forte amplitude dans des tranches de cerveau embryonnaire au stade E13. Cette augmentation de Ca2+ est d’abord observée dans la région sub-piale de la PP puis s’étend à d’autres cellules de la PP et à quelques cellules de la VZ. Cette séquence traduit un premier effet direct de la vératridine sur les cellules exprimant les canaux Na+, probablement relayé par un second effet indirect qui prend place à la fois dans la PP et la VZ. Nous avons cherché à identifier (1) le mécanisme reliant l’activation des canaux Na+ à la réponse calcique et (2) le facteur responsable de la propagation de l’information à des cellules ne possédant pas de canal Na+. Chez l’adulte, l’activation des canaux Na+ dépolarise la membrane plasmique, ce qui entraîne l’ouverture des canaux calciques dépendants du voltage et induit une augmentation de calcium cytoplasmique. Nous avons toutefois montré que ces canaux ne sont pas encore exprimés dans le cortex au stade de développement E13. En revanche, nous avons identifié un nouveau mécanisme dans lequel une entrée de Na+ par les canaux Na+ suivie d’un échange Na+/Ca2+
via les échangeurs Na+/Ca2+ résulte en un influx net de Ca2+ dans la cellule. Comme les canaux Na+, ces échangeurs ne sont exprimés que dans la partie externe de la PP [8]. Ainsi, le tandem canal Na+-échangeur Na+/Ca2+ ne peut pas être directement impliqué dans l’augmentation de Ca2+ survenant dans les cellules plus internes de la PP et celles de la VZ, n’exprimant ni canaux Na+ ni échangeurs. Nous avons donc étudié le mécanisme moléculaire responsable de la propagation de l’activité Ca2+ induite par la vératridine dans l’ensemble du néocortex. À E13, les synapses ne sont pas encore formées [
9]. La propagation du signal Ca2+ doit donc impliquer un signal diffusible extracellulaire. Nous avons constaté que l’application de vératridine induit une exocytose massive au niveau de la PP, complètement bloquée par l’inhibition pharmacologique des échangeurs Na+/Ca2+ [8]. Par une analyse chromatographique, nous avons observé que l’activation des canaux Na+ induit une forte sécrétion de glutamate. Ce glutamate libéré induit une activité calcique dans une population mixte neuronale et proliférante via l’implication de récepteurs NMDA (N-méthyl-D-aspartate) et AMPA (α-amino-3-hydroxy-5-methyl-4 isoxazolepropionic acid) [8]. Nous avons donc mis en évidence, avant synaptogenèse, une voie de signalisation particulière activée par un canal Na+, relayée par un influx de Ca2+ et conduisant à une sécrétion de glutamate qui permet de propager le signal à d’autres populations de cellules. Nous avons enfin démontré que la glycine est un activateur physiologique potentiel de cette voie de signalisation au stade E13 du développement néocortical. La stimulation du récepteur de la glycine conduit en effet à la stimulation des canaux Na+ puis à l’ensemble des événements décrits ci-dessus, jusqu’à l’activation des cellules de la VZ. |
Une voie de signalisation immature Classiquement, ce sont les canaux Ca2+ activés par dépolarisation qui sont impliqués dans la libération vésiculaire des neurotransmetteurs. Chez la souris embryonnaire, les canaux Na+ activés par dépolarisation apparaissent dans les premières cellules neuronales bien avant la mise en place des canaux Ca2+ [6, 7]. Leur activation est couplée à une entrée de Ca2+ qui va induire une exocytose de glutamate. Cette sécrétion paracrine propage le signal dans d’autres populations cellulaires néocorticales via des récepteurs glutamatergiques NMDA ou AMPA (Figure 1). Le tandem canal Na+-échangeur Na+/Ca2+, présent dans une sous-population neuronale de la PP, va donc permettre la mise en place d’une exocytose en l’absence de canaux Ca2+ activés par dépolarisation [6]. Or, le glutamate sécrété est un agent important de contrôle de la prolifération des progéniteurs [2, 3] et de migration neuronale [4], ce qui suggère un impact physiologique d’envergure pour cette voie de signalisation immature.
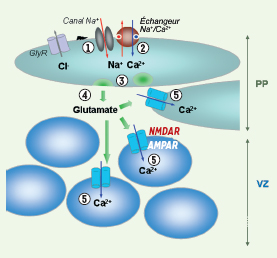
 | Figure 1.
Représentation schématique de la cascade de signalisation dépendante des canaux Na+ présents dans le néocortex murin à E13. L’activation des récepteurs glycinergiques (GlyR) et la dépolarisation qui en résulte constituent très probablement le déclencheur physiologique initial de la cascade. Cette dépolarisation induit une entrée rapide de Na+ dans la cellule via les canaux Na+ ➀. L’échange de ce Na+ contre du Ca2+ extracellulaire par l’échangeur Na+/Ca2+ induit une augmentation de Ca2+ dans les neurones de la PP activés ➁. Cette augmentation de Ca2+ entraîne une exocytose dans ces cellules ➂ qui permet la sécrétion de glutamate dans le milieu extracellulaire ➃. Le glutamate va activer d’autres cellules de la PP et de la zone proliférative (VZ), suivant un mécanisme de communication paracrine ➄. Ceci résulte en une augmentation de Ca2+ supplémentaire dans la PP et la VZ. |
Une communication paracrine similaire, impliquant le GABA, a été décrite dans l’hippocampe [
10]. Mais notre étude identifie pour la première fois l’existence d’une communication paracrine dans le néocortex à un stade aussi précoce et impliquant, cette fois, le glutamate. Le GABA ne semble pas intervenir dans cette voie de signalisation néocorticale [8]. Avant d’être les producteurs de potentiels d’action membranaires, les canaux Na+ assurent donc des fonctions inhabituelles au cours du développement cortical. Leur expression restreinte à certaines cellules pionnières de la PP, dont les cellules de Cajal-Retzius [7], fait penser à une implication majeure dans le développement cortical. Cette implication semble d’autant plus pertinente que l’analyse préliminaire de l’activité calcique spontanée montre l’existence de réseaux neuronaux organisés et synchrones au cours du temps. La compréhension moléculaire de cette signalisation calcique précoce constitue donc une étape primordiale dans la compréhension du développement cortical embryonnaire. |
1. Benitez-Diaz P, Miranda-Contreras L, Mendoza-Briceno RV, et al.Prenatal and postnatal contents of amino acid neurotransmitters in mouse parietal cortex. Dev Neurosci 2003; 25 : 366–74. 2. Haydar TF, Wang F, Schwartz ML,et al. Differential modulation of proliferation in the neocortical ventricular and subventricular zones. J Neurosci 2000; 20 : 5764–74. 3. LoTurco JJ, Owens DF, Heath MJ, et al. GABA and glutamate depolarize cortical progenitor cells and inhibit DNA synthesis. Neuron 1995; 15 : 1287–98. 4. Behar TN, Scott CA, Greene CL,et al.Glutamate acting at NMDA receptors stimulates embryonic cortical neuronal migration. J Neurosci 1999; 19 : 4449–61. 5. Moody WJ. The development of voltage-gated ion channels and its relation to activity dependent developmental events. Curr Top Dev Biol 1998; 39 : 159–85. 6. Picken-Bahrey HL, Moody WJ. Voltage-gated currents, dye and electrical coupling in the embryonic mouse neocortex. Cereb Cortex 2003; 13 : 239–51. 7. Albrieux M, Platel JC, Dupuis A,et al. Early expression of sodium channel transcripts and sodium current by Cajal-Retzius cells in the preplate of the embryonic mouse neocortex. J Neurosci 2004; 24 : 1719–25. 8. Platel JC, Boisseau S, Dupuis A, et al.Na+ channel-mediated Ca2+ entry leads to glutamate secretion in mouse neocortical preplate. Proc Natl Acad Sci USA 2005; 102 : 19174–9. 9. Molnar Z, Blakemore C. How do thalamic axons find their way to the cortex ? Trends Neurosci 1995;18 : 389–97. 10. Demarque M, Represa A, Becq H, et al.Paracrine intercellular communication by a Ca2+ - and SNARE -independent release of GABA and glutamate prior to synapse formation. Neuron 2002; 36 : 1051–61. |