| |
| Med Sci (Paris). 2006 April; 22(4): 356–357. Published online 2006 April 15. doi: 10.1051/medsci/2006224356.Le lactate est-il un substrat énergétique majeur pour les neurones ? Robert Costalat,1* Agnès Aubert,2 Pierre J. Magistretti,3 and Luc Pellerin2 1Université Pierre et Marie Curie-Paris 6, Inserm U678, CHU Pitié-Salpêtrière, 91, boulevard de l’Hôpital, 75634 Paris Cedex 13, France 2Département de Physiologie, Université de Lausanne, 1005 Lausanne, Suisse 3Brain and Mind Institute, École Polytechnique Fédérale de Lausanne et Centre de Neurosciences Psychiatriques, Département de Psychiatrie, Centre Hospitalier Universitaire Vaudois, 1011 Lausanne, Suisse MeSH keywords: Animaux, Astrocytes, Encéphale, Métabolisme énergétique, Humains, Cinétique, Lactates, Modèles neurologiques, Transporteurs d'acides monocarboxyliques, Neurones, Tomographie par émission de positons |
Pendant longtemps, le métabolisme énergétique cérébral a été considéré comme essentiellement aérobie, le glucose constituant son principal substrat [
1]. Dans ces conditions, une élévation du niveau de lactate était censée représenter essentiellement un signe de souffrance cérébrale, par exemple lors d’une ischémie. Des observations issues de l’imagerie fonctionnelle cérébrale et de la biologie cellulaire ont remis en cause ce schéma simple. Fox et Raichle [
2], en utilisant la tomographie par émission de positons chez l’homme, ont montré que des activations somato-sensorielles ou visuelles pouvaient s’accompagner d’une augmentation marquée de la consommation cérébrale de glucose, disproportionnée par rapport à l’augmentation concomitante de la consommation d’oxygène. De manière cohérente, une augmentation de la concentration tissulaire de lactate a été observée en spectroscopie par résonance magnétique lors de l’activation du cortex visuel [
3]. In vitro, Pellerin et Magistretti ont montré que l’activation des astrocytes par le glutamate entraîne une augmentation de la production astrocytaire de lactate, celui-ci étant sécrété dans le milieu extracellulaire [
4]. Sur cette base, ces deux auteurs ont proposé l’hypothèse de l’astrocyte-neuron lactate shuttle (ANLS), selon laquelle le lactate produit in vivo par les astrocytes serait capté par les neurones, transformé en pyruvate et ainsi métabolisé par les mitochondries neuronales. Cette hypothèse a fait l’objet d’un intense débat, certains auteurs soutenant que le glucose constituait de loin le principal substrat énergétique des neurones [
5]. |
Un modèle pour les cinétiques du lactate intracérébral Pour contribuer à cette discussion, nous avons utilisé une approche fondée sur la modélisation mathématique des réseaux métaboliques pour déterminer les mécanismes nécessaires pour expliquer les cinétiques du lactate intracérébral observées in vivo lors d’une activation. À partir d’un modèle qui simule les interactions métaboliques entre astrocytes et neurones [
6], nous avons construit un modèle des échanges de lactate entre cellules, milieu extracellulaire (interstitiel) et capillaires [
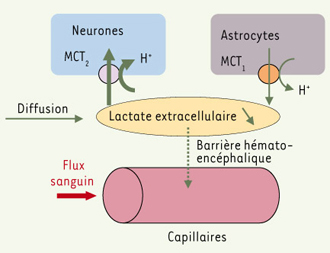
7]. Ce modèle inclut la production et/ou la consommation cellulaire de lactate, le flux sanguin cérébral, les échanges de lactate à travers la barrière hémato-encéphalique, la diffusion du lactate dans le milieu interstitiel et les variations du pH extracellulaire, le transport membranaire ayant lieu sous forme d’un cotransport lactate-H+
(Figure 1). Nous avons comparé directement les résultats théoriques aux cinétiques de lactate extracellulaire obtenues chez le rat in vivo par Hu et Wilson [
8]. Nous nous sommes plus particulièrement attachés à l’explication de la diminution initiale de la concentration de lactate (ou initial dip) observée tant chez l’animal [8] que chez l’homme [
9], diminution paradoxale qui avait été interprétée par certains auteurs comme allant à l’encontre de l’hypothèse de l’ANLS [9]. L’étude systématique du modèle montre que l’initial dip du lactate ne peut être expliqué ni par l’augmentation des échanges à travers la barrière hémato-encéphalique due à l’élévation du flux sanguin local, ni par des modifications du pH, ni par la diffusion extracellulaire du lactate. Ainsi, par une sorte de raisonnement par l’absurde, nous avons pu montrer qu’il était très probable que l’initial dip du lactate soit dû à une consommation précoce de lactate par certaines cellules. De plus, la modélisation des propriétés des isoformes des transporteurs membranaires du lactate (monocarboxylate transporters, MCT) montre que les neurones sont de meilleurs candidats que les astrocytes pour une consommation de lactate induite par l’activation (Figure 1). Par conséquent, au lieu d’exclure l’hypothèse de l’ANLS, l’initial dip du lactate constitue un argument majeur en faveur d’une consommation de lactate par les neurones dès le début d’une stimulation.
 | Figure 1.
Modèle de la cinétique du lactate intracérébral permettant d’évaluer les déterminants de l’
initial dip du lactate observé au début d’une activation. En réponse à une stimulation, la concentration de lactate extracellulaire diminue au-dessous de la ligne de base (initial dip), ce qui ne peut être dû à une diffusion du lactate provenant des régions non stimulées. L’étude systématique des contributions des échanges de lactate à travers la barrière hémato-encéphalique et des variations de pH montre que ces mécanismes sont insuffisants pour expliquer l’initial dip. Il apparaît ainsi indispensable de supposer une augmentation de la consommation cellulaire de lactate, ou une diminution de sa sécrétion par les cellules dans le milieu extracellulaire, cette dernière hypothèse étant peu plausible. Les caractéristiques des isoformes des transporteurs membranaires du lactate (MCT2 dans les neurones et MCT1 dans les astrocytes principalement) montrent que les astrocytes sont de bons candidats pour une sécrétion de lactate, les neurones étant plus aptes à consommer du lactate lors de l’initial dip. |
Nous avons enfin élaboré un modèle analogue pour le glucose, ce qui nous a permis d’estimer que la contribution de l’ANLS à l’apport supplémentaire de pyruvate aux mitochondries neuronales lors d’une stimulation est d’environ 30 % à 60 %. Ce pourcentage pourrait se révéler plus important, compte tenu des données récentes in vitro montrant notamment une inhibition du transport du glucose dans les neurones lors d’une activation [
10] : la confirmation in vivo de ces données renforcerait l’importance de la contribution de l’ANLS au métabolisme énergétique neuronal. Ainsi, il apparaît très probable que le lactate soit un substrat énergétique majeur pour les neurones dans des conditions physiologiques. Cette remise en cause du schéma classique peut contribuer à une meilleure compréhension de diverses maladies cérébrales dans lesquelles l’altération du métabolisme énergétique est un aspect essentiel, par exemple les gliomes intracérébraux, les maladies neuro-dégénératives ou les accidents vasculaires cérébraux ischémiques. En particulier, les nouvelles données sur le métabolisme énergétique doivent être prises en compte dans l’interprétation des données fournies par les différentes méthodes d’imagerie fonctionnelle cérébrale. |
1. Siesjö BK. Brain energy metabolism. New York : Wiley, 1978. 2. Fox PT, Raichle ME. Focal physiological uncoupling of cerebral blood flow and oxidative metabolism during somatosensory stimulation in human subjects. Proc Natl Acad Sci USA 1986; 83 : 1140–4. 3. Prichard J, Rothman D, Novotny E, et al. Lactate rise detected by 1H NMR in human visual cortex during physiologic stimulation. Proc Natl Acad Sci USA 1991; 88 : 5829–31. 4. Pellerin L, Magistretti PJ. Glutamate uptake into astrocytes stimulates aerobic glycolysis : a mechanism coupling neuronal activity to glucose utilization. Proc Natl Acad Sci USA 1994; 91 : 10625–9. 5. Dienel GA, Cruz NF. Nutrition during brain activation : does cell-to-cell lactate shuttling contribute significantly to sweet and sour food for thought ? Neurochem Int 2004; 45 : 321–51. 6. Aubert A, Costalat R. Interaction between astrocytes and neurons studied using a mathematical model of compartmentalized energy metabolism. J Cereb Blood Flow Metab 2005; 25 : 1476–90. 7. Aubert A, Costalat R, Magistretti PJ, Pellerin L. Brain lactate kinetics : modeling evidence for neuronal lactate uptake upon activation. Proc Natl Acad Sci USA 2005; 102 : 16448–53. 8. Hu Y, Wilson GS. A temporary local energy pool coupled to neuronal activity : fluctuations of extracellular lactate levels in rat brain monitored with rapid-response enzyme-based sensor. J Neurochem 1997; 69 : 1484–90. 9. Mangia S, Garreffa G, Bianciardi M, et al. The aerobic brain : lactate decrease at the onset of neural activity. Neuroscience 2003; 118 : 7–10. 10. Porras OH, Loaiza A, Barros LF. Glutamate mediates acute glucose transport inhibition in hippocampal neurons. J Neurosci 2004; 24 : 9669–73. |